


2022年高中化学必修2暑假同步测试卷(三)化学键 Word版含答案
展开 www.ks5u.com高中同步测试卷(三)
www.ks5u.com高中同步测试卷(三)
化学键
(时间:90分钟,满分:100分)
一、选择题(本题包括16小题,每小题只有一个选项符合题意,共48分)
1.下列每组物质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH B.Cl2、Na2S、HF、SO2
C.HBr、CO2、NH3、H2O D.Na2O2、H2O2、O3、CH4
2.下列关于电子式的说法错误的是( )
A.每种元素的原子都可以写出电子式
B.简单阳离子的电子式与它的离子符号相同
C.阴离子的电子式要加方括号表示
D.电子式就是核外电子排布的式子
3.下列化学用语或说法正确的是( )
A.氯原子的结构示意图:![]()
B.作为相对原子质量测定标准的碳原子:C
C.氯化镁的电子式:![]()
D.共价键:阴、阳离子通过静电引力所形成的化学键
4.如图形象地表示了氯化氢分子的形成过程。下列相关叙述中错误的是 ( )
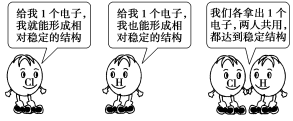
A.氯化氢是共价化合物
B.氯化氢分子中所有原子最外层都有8个电子
C.氯化氢分子比氯原子和氢原子都稳定
D.氯化氢分子中含有1对共用电子对
5.一定条件下,氨气与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是( )
A.反应过程中有白烟产生
B.NF3既是氧化产物,又是还原产物
C.NH4F中既含有离子键又含有共价键
D.上述反应中,反应物和生成物均属于共价化合物
6.科学家研究发现普通盐水在无线电波的照射下可以燃烧,未来将有望解决人类的能源危机。其原理是无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
A.离子键 B.极性共价键
C.非极性共价键 D.离子键与共价健
7.下列叙述不正确的是( )
A.离子化合物中可能存在非极性键
B.硫酸分子中有H+和SO两种离子
C.某元素原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键
D.离子键和共价键的实质都是电性的相互作用
8.关于离子键、共价键和各种叙述,下列说法中正确的是( )
A.CaCl2中既有离子键又有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
9.下列用电子式表示物质的形成过程,其中正确的是( )
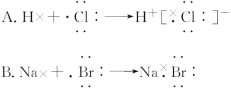
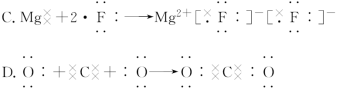
10.下列叙述中正确的是( )
A.P4和NO2都是共价化合物
B.有化学键断裂的变化属于化学变化
C.在离子化合物与共价化合物中,都不存在单个小分子
D.在反应O3+2KI+H2O===2KOH+I2+O2中,参加反应的所有臭氧都作氧化剂
11.下列叙述中正确的是( )
①元素周期表第一周期内的元素之间不可能形成离子键 ②元素周期表第ⅠA族内的元素之间不可能形成离子键 ③离子化合物中一定含有阴离子和阳离子 ④离子化合物中一定含有金属元素
A.①② B.③④
C.①③ D.②④
12.下列关于化学用语“NH4Cl”的意义,不正确的是( )
A.氯化铵分子中含有一个NH和一个Cl-
B.氯化铵由N、H、Cl三种元素组成
C.氯化铵固体由NH和Cl-构成
D.氯化铵固体中阴、阳离子个数比为1∶1
13.XY2是离子化合物,X和Y离子电子层结构都与氖原子相同,则X、Y分别为( )
A.Ca和Cl B.K和S
C.Ca和F D.Mg和F
14.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化 ⑥NH4Cl“升华” ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A.①④⑥⑦ B.④⑥⑧
C.①②④⑤ D.④⑥
15.同主族元素形成的同类型的化合物,往往其结构和性质相似。下列对化合物碘化磷(PH4I)的叙述错误的是( )
A.它是一种离子化合物
B.这种化合物加热时,可能产生有色气体
C.这种化合物的电子式为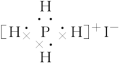
D.这种化合物可以和烧碱发生反应
16.关于含正离子N的化合物N5AsF6,下列叙述中错误的是( )
A.N共有34个核外电子 B.N中氮原子间以共价键结合
C.化合物N5AsF6中As的化合价为+1价 D.化合物N5AsF6中F的化合价为-1价
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、非选择题(本题包括4小题,共52分)
17.(12分)短周期元素A、B、C、D、E的原子序数依次增大,元素的特征信息如下表:
元素 | 元素的特征信息 |
A | 最高正化合价与最低负化合价的绝对值之差为2 |
B | 和E同主族 |
C | 1 mol C单质与冷水反应,在标准状况下生成11.2 L氢气 |
D | 原子的最外层电子数等于其所在的周期数 |
E | 负一价阴离子的核外电子排布与氩原子的核外电子排布相同 |
(1)元素D的原子结构示意图为________,A元素的最高价氧化物对应的水化物与其气态氢化物反应的产物中含有的化学键类型为__________________。
(2)元素B和元素C形成的化合物的化学式为________,该化合物属于________(填“离子”或“共价”)化合物,构成该物质的微粒半径由大到小的顺序为________。
(3)已知元素A、E能形成一种四原子分子,该分子的电子式为____________________。
18.(12分)已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。
(1)写出元素名称:X________,Y________,Z________。
(2)写出下列物质的电子式:Y2Z2____________________,XZ2____________________。
(3)用电子式表示Y2Z的形成过程:
________________________________________________________________________。
19.(14分)A、B、C、D、E为短周期元素,在元素周期表中的相对位置如图所示。A、C两元素原子的核外电子数之和等于B原子的质子数,B原子的质子数和中子数相等。
A |
| C |
D | B | E |
请回答下列问题:
(1)E元素位于元素周期表中第________周期第________族。
(2)几种元素中最高价氧化物对应的水化物的酸性最强的是(用化学式表示)____________________。
(3)C元素的原子结构示意图为________,用电子式表示C的氢化物的形成过程:________________________________。
(4)由元素A、C及氢元素形成的化合物中含有的化学键类型为____________________。
20.(14分)汽车的安全气囊内有叠氮化钠(NaN3)或硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速分解,产生大量气体,充满气囊。请回答下列问题:
(1)下列判断正确的是 ________。
A.道路起雾与H2O分子中化学键的断裂有关
B.NH4NO3属于共价化合物
C.NaN3受到猛烈撞击时化学键一定断裂
D.NaN3中Na+的最外层达到了8电子稳定结构
(2)叠氮化钠是一种无色晶体,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法为2NaNH2+N2O===NaN3+NaOH+NH3;3NaNH2+NaNO3===NaN3+3NaOH+NH3↑。
①N2O、NH3属于________(填“共价化合物”或“离子化合物”)。
②NaNH2中含有的化学键类型为________。
(3)已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。X、Y、Z所形成的某种常见化合物M是汽车安全气囊中的一种填充物。请回答下列问题:
①请用化学键知识解释通常情况下,Y2分子化学性质稳定的原因:
________________________________________________________________________
________________________________________________________________________。
②X、Y、Z所形成的某种常见化合物M与W的最高价氧化物对应的水化物的浓溶液在加热时所发生反应的离子方程式为________________________________,该离子方程式中电子总数为10的微粒有________________________。
参考答案与解析
1.解析:选C。A项,NaCl中只含离子键,HCl、H2O中只含共价键,NaOH中既含离子键又含共价键;B项,Cl2、HF、SO2中只含有共价键,Na2S中只含有离子键;D项,H2O2、O3、CH4中只含有共价键,Na2O2中既含有共价键,又含有离子键。
2.解析:选D。电子式应该是在元素符号周围标出原子最外层电子的式子。
3. 解析:选C。氯原子最外层有7个电子,不是8个,A错;作为相对原子质量测定标准的碳原子为C,B错;MgCl2中Mg2+带两个单位的正电荷,Cl-带一个单位的负电荷,C对;使带相反电荷的阴、阳离子结合的相互作用,称为离子键,D错。
4. 解析:选B。氯化氢分子中的氢原子最外层有2个电子,B项错误。
5. 解析:选D。反应中的化合价变化为N:-3―→+3,F:0―→-1,NF3既是氧化产物又是还原产物,D选项中NH4F是离子化合物。
6. 解析:选B。水分子中的氢原子和氧原子以极性共价键的形式结合,要释放出氢原子,就必须破坏这种极性共价健,故B项正确。
7. 解析:选B。Na2O2中含有非极性键,A项正确;硫酸分子是共价化合物,各原子之间以共用电子对形成共价键,不存在H+和SO,B项错误;最外层只有一个电子的原子位于周期表中的ⅠA族,可以是H,也可以是Na、K等,与卤族元素可能形成离子键或共价键,C项正确;离子键和共价键都是电子与电子、原子核与原子核、原子核与电子之间的电性作用,D项正确。
8. 解析:选C。CaCl2中无共价键,A项错误;非极性键存在于单质分子和化合物中,如H2O2中氧原子间为非极性键,B、D项错误;若有离子键,则属于离子化合物,共价化合物中一定无离子键,C项正确。
9.解析:选D。HCl是共价化合物,A错误;NaBr是离子化合物,B错误;离子化合物电子式中,阴、阳离子均匀排列在带相反电荷的离子周围,C错误;CO2中C原子分别与2个O原子各共用2对电子,D正确。
10. 解析:选D。P4为单质,A项错误;化学变化的实质是旧化学键断裂和新化学键生成,仅有化学键断裂的变化不是化学反应,如氯化钠溶于水,离子键断裂,属于物理变化,B项错误;离子化合物中不存在分子,共价化合物中有的不含有分子(如二氧化硅),有的却含有分子(如水、氯化氢等),C项错误;臭氧中的三个氧原子是按照一定方式结合的,虽然反应后有两个氧原子化合价没有变化,但臭氧作为一个整体,化合价发生变化,D项正确。
11. 解析:选C。第一周期内的元素是氢(非金属元素)和氦(性质特别稳定),它们不可能形成离子键,①正确;元素周期表第ⅠA族内有非金属元素氢和很活泼的碱金属元素,可以形成离子键,如离子化合物NaH,②错;离子化合物中一定含有阴离子和阳离子,但不一定含有金属元素,如NH4Cl是离子化合物,但不含金属元素,故③正确,④错。
12. 解析:选A。氯化铵是由离子构成的,没有分子存在,A错;注意物质由元素组成,由粒子构成,B、C、D都是正确的。
13. 解析:选D。Ca2+、Cl-、S2-都与氩原子的电子层结构相同,且K2S不是XY2型离子化合物,故A、B、C三项均不正确。
14. 解析:选D。①碘升华只破坏分子间作用力,错误;②溴蒸气被木炭吸附不破坏共价键,错误;③酒精溶于水不破坏共价键,错误;④HCl气体溶于水电离产生氢离子、氯离子,共价键被破坏,正确; ⑤冰融化只破坏分子间作用力,错误;⑥NH4Cl受热分解生成氨气和氯化氢,既破坏离子键又破坏共价键,正确;⑦氢氧化钠熔化只破坏离子键,错误;⑧(NH4)2SO4溶于水只破坏离子键,错误,选D。
15. 解析:选C。主族元素形成的同类型的化合物,其结构和性质相似。通过对比碘化磷(PH4I)和NH4Cl的性质,可知A、D对;加热时PH4I分解生成的HI可分解产生I2,B对;电子式应为
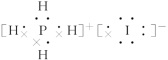 ,C错。
,C错。
16. 解析:选C。含正离子N的化合物N5AsF6中同时含有阴离子AsF,F元素只有-1价,因此,As元素显+5价,C错误,D正确。
17. 解析:元素A的最高正化合价与最低负化合价的绝对值之差为2,设元素A的原子最外层有x个电子,则x-(8-x)=2,x=5,A为N或P;因为A、B、C、D、E的原子序数依次增大,故A为N;1 mol C单质与冷水反应,在标准状况下生成11.2 L H2,则C为Na;D位于第三周期,且最外层电子数等于其所在的周期数,D为Al;E的负一价阴离子的核外电子排布与氩原子的核外电子排布相同,E为Cl;又B和E同主族,则B为F。
答案:(1)![]() 离子键、共价键
离子键、共价键
(2)NaF 离子 F->Na+
(3)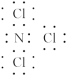
18. 解析:由题意知,Z可形成Y2Z2和H2Z,则Z可有-1价、-2价,因此Z为O,Y为+1价,且Y的阳离子和Z的阴离子的核外电子排布相同,因此Y为Na;Na2O2与XO2反应可生成O2,因此X为C(碳)。
答案:(1)碳 钠 氧
(2)![]()
(3)![]()
19. 解析:设A的质子数为x,则B的质子数为x+9,C的质子数为x+2,则x+x+2=x+9,计算得x=7,则A为N,B为S,C为F,D为P,E为Cl。由元素A、C及氢元素形成的化合物为NH4F,其属于离子化合物,含有离子键和共价键。
答案:(1)三 ⅦA (2)HClO4
(3)![]()
(4)离子键、共价键
20. 解析:(1)选项B,NH4NO3中NH与NO以离子键形式结合,它属于离子化合物。选项C,NaN3受到猛烈撞击发生分解反应,所以化学键一定断裂。选项D,NaN3中Na+最外层有8个电子。
(2)①N2O、NH3分子中只存在共价键,属于共价化合物。②Na+与NH之间形成离子键,NH中N、H之间形成共价键。
(3)结合题目信息可知X为H,W应为Na。由于W原子的质子数等于Y、Z原子的最外层电子数之和且Y、Z为同周期的相邻元素,可推知Y为N,Z为O,则X、Y、Z所形成的常见化合物M为NH4NO3。①由于N2分子中存在NN键,很难被破坏,所以通常情况下N2的化学性质很稳定。②NH4NO3与NaOH浓溶液共热生成NH3:NH+OH-NH3↑+H2O。
答案:(1)CD
(2)①共价化合物 ②离子键、共价键
(3)①N2分子内部存在很强的共价键,很难被破坏,所以通常情况下,N2性质稳定
②NH+OH-NH3↑+H2O NH、OH-、NH3、H2O
2022年高中化学必修2暑假同步测试卷(十五)综合检测卷C Word版含答案: 这是一份2022年高中化学必修2暑假同步测试卷(十五)综合检测卷C Word版含答案,共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2022年高中化学必修2暑假同步测试卷(十四)综合检测卷B Word版含答案: 这是一份2022年高中化学必修2暑假同步测试卷(十四)综合检测卷B Word版含答案,共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2022年高中化学必修2暑假同步测试卷(十三)综合检测卷A Word版含答案: 这是一份2022年高中化学必修2暑假同步测试卷(十三)综合检测卷A Word版含答案,共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












