


2022年高中化学必修2章末系统总结2 Word版含解析
展开
这是一份高中化学人教版 (2019)必修 第二册全册综合课后练习题,共9页。试卷主要包含了重点知识梳理,实验专项探究等内容,欢迎下载使用。
章末系统总结2一、重点知识梳理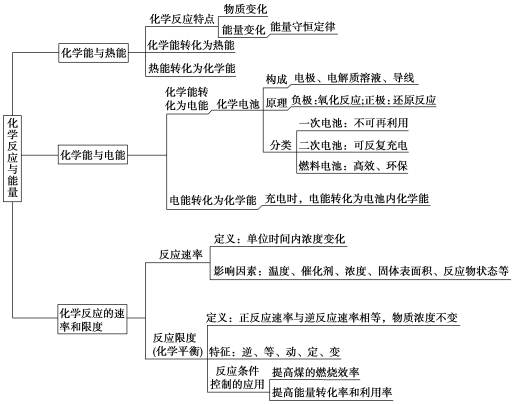 二、实验专项探究1.原电池工作原理的实验探究。 实验人教版教材实验设计苏教版教材实验设计实验原理Zn+H2SO4(稀)===ZnSO4+H2↑实验装置
二、实验专项探究1.原电池工作原理的实验探究。 实验人教版教材实验设计苏教版教材实验设计实验原理Zn+H2SO4(稀)===ZnSO4+H2↑实验装置
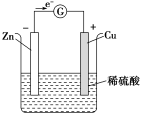 实验用品锌片、铜片、电流计、烧杯、导线、稀硫酸实验步骤将锌片和铜片用导线连接(导线中间接入一个电流计),平行插入盛有稀硫酸的烧杯中,观察现象实验1:把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象实验2:把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象实验3:用导线把实验2中的锌片和铜片连接起来,观察实验现象实验4:在导线中间连接一个灵敏电流计,观察实验现象现象与结论元件现象铜片有气泡产生锌片锌片逐渐溶解电流表指针发生偏转结论:线路中有电流产生
实验用品锌片、铜片、电流计、烧杯、导线、稀硫酸实验步骤将锌片和铜片用导线连接(导线中间接入一个电流计),平行插入盛有稀硫酸的烧杯中,观察现象实验1:把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象实验2:把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象实验3:用导线把实验2中的锌片和铜片连接起来,观察实验现象实验4:在导线中间连接一个灵敏电流计,观察实验现象现象与结论元件现象铜片有气泡产生锌片锌片逐渐溶解电流表指针发生偏转结论:线路中有电流产生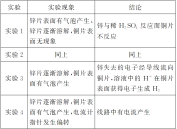 创新发掘1.你知道电子是如何流动的吗?分析:锌片表面无气泡而铜片表面有气泡产生,说明锌失去的电子经导线流向铜片2.你能写出锌片、铜片上发生反应的电极反应式吗?分析:锌片:Zn-2e-===Zn2+铜片:2H++2e-===H2↑3.锌片和铜片上发生反应的类型是什么?分析:锌片上锌失去电子,发生氧化反应;铜片上,H+获得电子,发生还原反应1.实验4中电流计的指针为什么发生偏转?分析:因为在锌片上,锌失去电子形成锌离子进入溶液,电子经导线流向铜电极,将化学能转化为电能2.如何判断实验4装置中的正、负极?分析:锌片失去电子发生氧化反应,做原电池的负极;铜片上H+获得电子,发生还原反应,做原电池的正极3.实验1、2中能否形成原电池?依据实验1~4,你能否总结出原电池的形成条件?分析:实验1、2不能形成原电池,原因是未构成闭合回路。构成原电池的条件有:①有两个活泼性不同的金属作电极②电极需插入电解质溶液中③形成闭合回路个性评点1.人教版教材实验直接将Cu-Zn-稀硫酸形成原电池通过实验现象分析原电池的反应原理,而苏教版教材实验通过设计对比实验,逐层深入,探究化学能转化成电能的原理,体现了实验探究过程,更易总结,提炼原电池的构成条件2.人教版教材实验相比苏教版实验,设计的“学与问”栏目,提出了两个有思考性的问题,引导学生深入了解,探讨原电池的反应原理,并利用已掌握的知识和提供的实验用品,设计一套水果电池装置,拓展了学生的视野,加深了学生对原电池原理的理解2.化学反应速率影响因素的实验探究。 实验人教版教材实验设计苏教版教材实验设计实验目的探究浓度、温度、催化剂对化学反应速率的影响实验原理2H2O22H2O+O2↑实验用品试管、烧杯、火柴、药匙、温度计、5%的H2O2溶液、1 mol/L FeCl3溶液、MnO2、冷水、热水试管、烧杯、酒精灯、药匙、4%H2O2溶液、12%H2O2溶液、MnO2、0.2 mol/L FeCl3溶液实验步骤实验1:在两支试管中,装有2~3 mL 5%的H2O2溶液,分别加入1~2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将其中的一支试管放入盛有5 ℃左右冷水的烧杯中,另一支试管放入盛有40 ℃左右热水的烧杯中,观察现象并进行对比实验2:在3支大小相同的试管中各装入2~3 mL 5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末,1~2滴1 mol·L-1 FeCl3溶液,对比观察现象实验1:取两支试管,各加入5 mL 12%的H2O2溶液,将其中一支试管用水浴加热,观察并比较两支试管中发生的变化实验2:取两支试管,各加入5 mL 4%的H2O2溶液,用药匙向其中一支试管内加入少量MnO2粉末,观察发生的变化实验3:取两支试管,分别加入5 mL 4%、5 mL 12%的H2O2溶液,再各加入几滴0.2 mol/L的FeCl3溶液,观察气泡产生的快慢现象及结论
创新发掘1.你知道电子是如何流动的吗?分析:锌片表面无气泡而铜片表面有气泡产生,说明锌失去的电子经导线流向铜片2.你能写出锌片、铜片上发生反应的电极反应式吗?分析:锌片:Zn-2e-===Zn2+铜片:2H++2e-===H2↑3.锌片和铜片上发生反应的类型是什么?分析:锌片上锌失去电子,发生氧化反应;铜片上,H+获得电子,发生还原反应1.实验4中电流计的指针为什么发生偏转?分析:因为在锌片上,锌失去电子形成锌离子进入溶液,电子经导线流向铜电极,将化学能转化为电能2.如何判断实验4装置中的正、负极?分析:锌片失去电子发生氧化反应,做原电池的负极;铜片上H+获得电子,发生还原反应,做原电池的正极3.实验1、2中能否形成原电池?依据实验1~4,你能否总结出原电池的形成条件?分析:实验1、2不能形成原电池,原因是未构成闭合回路。构成原电池的条件有:①有两个活泼性不同的金属作电极②电极需插入电解质溶液中③形成闭合回路个性评点1.人教版教材实验直接将Cu-Zn-稀硫酸形成原电池通过实验现象分析原电池的反应原理,而苏教版教材实验通过设计对比实验,逐层深入,探究化学能转化成电能的原理,体现了实验探究过程,更易总结,提炼原电池的构成条件2.人教版教材实验相比苏教版实验,设计的“学与问”栏目,提出了两个有思考性的问题,引导学生深入了解,探讨原电池的反应原理,并利用已掌握的知识和提供的实验用品,设计一套水果电池装置,拓展了学生的视野,加深了学生对原电池原理的理解2.化学反应速率影响因素的实验探究。 实验人教版教材实验设计苏教版教材实验设计实验目的探究浓度、温度、催化剂对化学反应速率的影响实验原理2H2O22H2O+O2↑实验用品试管、烧杯、火柴、药匙、温度计、5%的H2O2溶液、1 mol/L FeCl3溶液、MnO2、冷水、热水试管、烧杯、酒精灯、药匙、4%H2O2溶液、12%H2O2溶液、MnO2、0.2 mol/L FeCl3溶液实验步骤实验1:在两支试管中,装有2~3 mL 5%的H2O2溶液,分别加入1~2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将其中的一支试管放入盛有5 ℃左右冷水的烧杯中,另一支试管放入盛有40 ℃左右热水的烧杯中,观察现象并进行对比实验2:在3支大小相同的试管中各装入2~3 mL 5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末,1~2滴1 mol·L-1 FeCl3溶液,对比观察现象实验1:取两支试管,各加入5 mL 12%的H2O2溶液,将其中一支试管用水浴加热,观察并比较两支试管中发生的变化实验2:取两支试管,各加入5 mL 4%的H2O2溶液,用药匙向其中一支试管内加入少量MnO2粉末,观察发生的变化实验3:取两支试管,分别加入5 mL 4%、5 mL 12%的H2O2溶液,再各加入几滴0.2 mol/L的FeCl3溶液,观察气泡产生的快慢现象及结论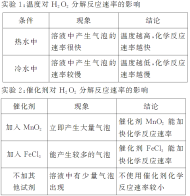
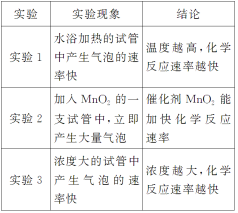 创新发掘1.如何通过实验检验H2O2分解产生气体的成分?分析:用带火星的火柴梗能否复燃检验放出的气体是否是O22.FeCl3溶液、MnO2固体对H2O2分解的催化效果相同吗?分析:不相同,通过产生气泡的快慢可以看出,MnO2对H2O2分解的催化效果更好1.实验1中所用H2O2的浓度为12%,能否使用4%的H2O2进行实验?分析:不能,因为4%的H2O2浓度低,加热时,产生气泡的速率慢,不宜观察实验现象2.实验3中,为什么要在两支试管中加入几滴FeCl3溶液?只在一支试管中加入FeCl3溶液可行吗?分析:两支试管中加入几滴FeCl3溶液是为了同时增大H2O2的分解速率,便于观察实验现象。而只在一支试管中加入FeCl3溶液,则无法得出正确的实验结论个性评点1.人教版教材通过实验探究了温度、催化剂对化学反应速率的影响,但并未对浓度影响化学反应速率快慢做相应的实验探究。而苏教版实验有效地解决了这一问题2.苏教版教材(实验3)中,往不同浓度的H2O2溶液中滴加FeCl3溶液,这步实验操作来的过于突然,原因是学生不了解FeCl3溶液的作用。而人教版教材通过对比实验有效地解答了这一问题续上表 实验人教版教材实验设计苏教版教材实验设计思维引领(1)影响化学反应速率的外界因素主要有浓度、温度、催化剂、固体表面积等。设计实验探究某一外界因素对化学反应速率影响时,要求控制其他“变量”保持不变,而只改变其中的一个“变量”,看该条件对化学反应速率的影响(2)一个实验结果会受多种因素的影响,为了使实验结论更具说服力,可以采用对照实验的方法,通过对比,更易得出实验结论(3)要求设计的实验中,实验现象要明显,且不要对环境造成不利影响
创新发掘1.如何通过实验检验H2O2分解产生气体的成分?分析:用带火星的火柴梗能否复燃检验放出的气体是否是O22.FeCl3溶液、MnO2固体对H2O2分解的催化效果相同吗?分析:不相同,通过产生气泡的快慢可以看出,MnO2对H2O2分解的催化效果更好1.实验1中所用H2O2的浓度为12%,能否使用4%的H2O2进行实验?分析:不能,因为4%的H2O2浓度低,加热时,产生气泡的速率慢,不宜观察实验现象2.实验3中,为什么要在两支试管中加入几滴FeCl3溶液?只在一支试管中加入FeCl3溶液可行吗?分析:两支试管中加入几滴FeCl3溶液是为了同时增大H2O2的分解速率,便于观察实验现象。而只在一支试管中加入FeCl3溶液,则无法得出正确的实验结论个性评点1.人教版教材通过实验探究了温度、催化剂对化学反应速率的影响,但并未对浓度影响化学反应速率快慢做相应的实验探究。而苏教版实验有效地解决了这一问题2.苏教版教材(实验3)中,往不同浓度的H2O2溶液中滴加FeCl3溶液,这步实验操作来的过于突然,原因是学生不了解FeCl3溶液的作用。而人教版教材通过对比实验有效地解答了这一问题续上表 实验人教版教材实验设计苏教版教材实验设计思维引领(1)影响化学反应速率的外界因素主要有浓度、温度、催化剂、固体表面积等。设计实验探究某一外界因素对化学反应速率影响时,要求控制其他“变量”保持不变,而只改变其中的一个“变量”,看该条件对化学反应速率的影响(2)一个实验结果会受多种因素的影响,为了使实验结论更具说服力,可以采用对照实验的方法,通过对比,更易得出实验结论(3)要求设计的实验中,实验现象要明显,且不要对环境造成不利影响![]() 即时训练1.在如图所示的装置中,金属a的金属活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
即时训练1.在如图所示的装置中,金属a的金属活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )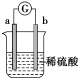 A.碳棒上有气体放出,溶液pH变大B.a是正极,b是负极C.导线中有电子流动,电子从a极到b极D.a极上发生了氧化反应解析:显然,电极a、b与电解质溶液稀H2SO4组成原电池,因活泼性a>b(碳棒),所以a为电池的负极,失电子,发生氧化反应,b为正极,H+在表面得电子,发生还原反应。由于正极消耗H+,溶液中c(H+)减小,pH增大,在外电路中,电子由a极流向b极。答案:B2.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
A.碳棒上有气体放出,溶液pH变大B.a是正极,b是负极C.导线中有电子流动,电子从a极到b极D.a极上发生了氧化反应解析:显然,电极a、b与电解质溶液稀H2SO4组成原电池,因活泼性a>b(碳棒),所以a为电池的负极,失电子,发生氧化反应,b为正极,H+在表面得电子,发生还原反应。由于正极消耗H+,溶液中c(H+)减小,pH增大,在外电路中,电子由a极流向b极。答案:B2.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图: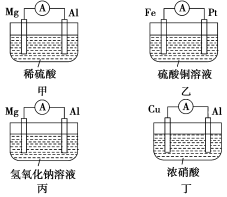 回答下列问题:(1)根据原电池原理填写下表。 装置序号正极负极反应式阳离子移动方向甲 乙 丙 Al+4OH--3e-===AlO+2H2O 丁 (2)电极类型除与电极材料的性质有关外,还与______________________有关。(3)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲________,丙________。(填“酸性”或“碱性”“增强”或“减弱”)。解析:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应;乙电池:铁比铂活泼,铁为负极;丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水;丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极。(2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。(3)根据溶液中离子参加反应情况判断溶液酸碱性的变化。答案:(1)装置序号正极负极反应式阳离子移动方向甲AlMg-2e-===Mg2+铝极乙PtFe-2e-===Fe2+铂极丙Mg 镁极丁AlCu-2e-===Cu2+铝极(2)电解质溶液的性质 (3)酸性减弱 碱性减弱3.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
回答下列问题:(1)根据原电池原理填写下表。 装置序号正极负极反应式阳离子移动方向甲 乙 丙 Al+4OH--3e-===AlO+2H2O 丁 (2)电极类型除与电极材料的性质有关外,还与______________________有关。(3)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲________,丙________。(填“酸性”或“碱性”“增强”或“减弱”)。解析:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应;乙电池:铁比铂活泼,铁为负极;丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水;丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极。(2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。(3)根据溶液中离子参加反应情况判断溶液酸碱性的变化。答案:(1)装置序号正极负极反应式阳离子移动方向甲AlMg-2e-===Mg2+铝极乙PtFe-2e-===Fe2+铂极丙Mg 镁极丁AlCu-2e-===Cu2+铝极(2)电解质溶液的性质 (3)酸性减弱 碱性减弱3.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )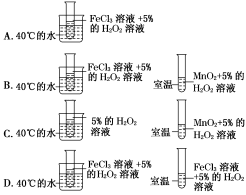 解析:探究温度对化学反应速率的影响,要求在催化剂相同,H2O2浓度相同,而温度不同的条件下做对比实验。通过产生气泡的快慢来体现温度对化学反应速率的影响。D选项符合上述要求。答案:D
解析:探究温度对化学反应速率的影响,要求在催化剂相同,H2O2浓度相同,而温度不同的条件下做对比实验。通过产生气泡的快慢来体现温度对化学反应速率的影响。D选项符合上述要求。答案:D
相关试卷
这是一份高中化学人教版 (2019)必修 第二册全册综合随堂练习题,共3页。试卷主要包含了重点知识梳理等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册全册综合课时作业,共10页。试卷主要包含了重点知识梳理,实验专项探究等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册全册综合课后作业题,共5页。试卷主要包含了重点知识梳理等内容,欢迎下载使用。










