


2022年高中化学必修二章末综合测评2 Word版含解析
展开
这是一份高中化学人教版 (2019)必修 第二册全册综合巩固练习,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
章末综合测评(二) (时间45分钟,满分100分)一、选择题(本题包括12小题,每小题4分,共48分)1.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: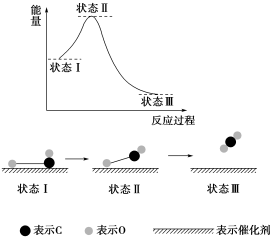 下列说法正确的是( ) A.CO和O生成CO2是吸热反应B.在该过程中,CO断键形成C和OC.CO和O形成了具有极性共价键的CO2D.状态 Ⅰ→状态 Ⅲ 表示CO与O2反应的过程【解析】 A.状态 Ⅰ 总能量为反应物总能量,状态 Ⅲ 总能量为生成物总能量,由图示知反应物的总能量大于生成物的总能量,故该反应为放热反应。B.从状态 Ⅰ、Ⅱ、Ⅲ的图示可以看出,反应中CO并未断裂成C和O,C、O原子间一直有化学键。C.由图示可以看出,CO和O生成了CO2,CO2分子中C与O形成极性共价键。D.状态 Ⅰ→状态Ⅲ表示CO与O反应生成CO2的过程,并不是CO与O2的反应过程。【答案】 C2.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )A.Q1+Q2>Q3 B.Q1+Q2>2Q3C.Q1+Q2<Q3 D.Q1+Q2<2Q3【解析】 H2在Cl2中燃烧是放热反应,故Q1+Q2<2Q3。【答案】 D3.下列有关能源的说法正确的是( )A.煤、石油、天然气是重要的化石燃料,加快化石燃料的开采与使用,有利于国民经济的发展B.核电站是利用原子核发生聚变,释放能量来发电的C.夏天为了更凉快,把室内空调温度设置很低,这样不符合“低碳生活”理念D.煤炉生火时,用木材引燃是为了提高煤的着火点【解析】 化石燃料的过度开采与使用,不利于国民经济的长远发展,A项错误;核电站是利用原子核发生裂变释放能量来发电的,氢弹的爆炸才是原子核的聚变,B项错误;温差越大消耗电能越多,则耗电量越大,不符合“低碳生活”理念,C项正确;煤炉生火时,用木材引燃是为了升高温度使之达到煤的着火点,而不是提高煤的着火点,D项错误。【答案】 C4.氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池。下列氧化还原反应中,在一定条件下不能构成原电池的是( )A.2FeCl2+Cl2===2FeCl3B.Zn+Ag2O+H2O===Zn(OH)2+2AgC.Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2OD.2H2+O2===2H2O【解析】 本题考查构成原电池的条件,由题意可知,构成原电池的条件有两个:一是必须是氧化还原反应,二是要求氧化剂、还原剂各为一种物质,分别在正、负极发生反应。A、B、D项所示反应均为氧化还原反应,且氧化剂和还原剂分别为不同物质,符合题意;C项虽是氧化还原反应,但氧化剂和还原剂均为Na2S2O3,不合题意。【答案】 C5.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )A.对该反应体系加热B.向溶液中滴加浓硝酸,以增大氢离子浓度C.滴加少量CuSO4溶液D.改用铁粉【解析】 升高温度、增加固体的接触面积都可以加快反应速率,即A、D项可以使氢气生成速率加快;C项,滴加少量CuSO4溶液后,铁置换出的铜可与铁在硫酸溶液中形成原电池,加快反应速率,C项可以;若加入硝酸,由于其具有强氧化性,生成的气体为NO,所以选择B。【答案】 B6.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应式为4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是( )A.正极反应式为O2+2H2O+4e-===4OH-B.电池工作时,电流由铝电极沿导线流向铂电极C.以网状的铂为正极,可增大与氧气的接触面积D.该电池通常只需更换铝板就可以继续使用【解析】 从电池总反应式可知,Al失电子为负极,O2为正极上反应的物质,A正确;电池工作时电子从铝电极沿导线流向铂电极;而电流方向则相反;铂网面积大,C正确;反应消耗铝,D正确。【答案】 B7.对于反应Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述不正确的是( )
下列说法正确的是( ) A.CO和O生成CO2是吸热反应B.在该过程中,CO断键形成C和OC.CO和O形成了具有极性共价键的CO2D.状态 Ⅰ→状态 Ⅲ 表示CO与O2反应的过程【解析】 A.状态 Ⅰ 总能量为反应物总能量,状态 Ⅲ 总能量为生成物总能量,由图示知反应物的总能量大于生成物的总能量,故该反应为放热反应。B.从状态 Ⅰ、Ⅱ、Ⅲ的图示可以看出,反应中CO并未断裂成C和O,C、O原子间一直有化学键。C.由图示可以看出,CO和O生成了CO2,CO2分子中C与O形成极性共价键。D.状态 Ⅰ→状态Ⅲ表示CO与O反应生成CO2的过程,并不是CO与O2的反应过程。【答案】 C2.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )A.Q1+Q2>Q3 B.Q1+Q2>2Q3C.Q1+Q2<Q3 D.Q1+Q2<2Q3【解析】 H2在Cl2中燃烧是放热反应,故Q1+Q2<2Q3。【答案】 D3.下列有关能源的说法正确的是( )A.煤、石油、天然气是重要的化石燃料,加快化石燃料的开采与使用,有利于国民经济的发展B.核电站是利用原子核发生聚变,释放能量来发电的C.夏天为了更凉快,把室内空调温度设置很低,这样不符合“低碳生活”理念D.煤炉生火时,用木材引燃是为了提高煤的着火点【解析】 化石燃料的过度开采与使用,不利于国民经济的长远发展,A项错误;核电站是利用原子核发生裂变释放能量来发电的,氢弹的爆炸才是原子核的聚变,B项错误;温差越大消耗电能越多,则耗电量越大,不符合“低碳生活”理念,C项正确;煤炉生火时,用木材引燃是为了升高温度使之达到煤的着火点,而不是提高煤的着火点,D项错误。【答案】 C4.氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池。下列氧化还原反应中,在一定条件下不能构成原电池的是( )A.2FeCl2+Cl2===2FeCl3B.Zn+Ag2O+H2O===Zn(OH)2+2AgC.Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2OD.2H2+O2===2H2O【解析】 本题考查构成原电池的条件,由题意可知,构成原电池的条件有两个:一是必须是氧化还原反应,二是要求氧化剂、还原剂各为一种物质,分别在正、负极发生反应。A、B、D项所示反应均为氧化还原反应,且氧化剂和还原剂分别为不同物质,符合题意;C项虽是氧化还原反应,但氧化剂和还原剂均为Na2S2O3,不合题意。【答案】 C5.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )A.对该反应体系加热B.向溶液中滴加浓硝酸,以增大氢离子浓度C.滴加少量CuSO4溶液D.改用铁粉【解析】 升高温度、增加固体的接触面积都可以加快反应速率,即A、D项可以使氢气生成速率加快;C项,滴加少量CuSO4溶液后,铁置换出的铜可与铁在硫酸溶液中形成原电池,加快反应速率,C项可以;若加入硝酸,由于其具有强氧化性,生成的气体为NO,所以选择B。【答案】 B6.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应式为4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是( )A.正极反应式为O2+2H2O+4e-===4OH-B.电池工作时,电流由铝电极沿导线流向铂电极C.以网状的铂为正极,可增大与氧气的接触面积D.该电池通常只需更换铝板就可以继续使用【解析】 从电池总反应式可知,Al失电子为负极,O2为正极上反应的物质,A正确;电池工作时电子从铝电极沿导线流向铂电极;而电流方向则相反;铂网面积大,C正确;反应消耗铝,D正确。【答案】 B7.对于反应Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述不正确的是( )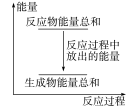 A.其反应物或生成物都能用来表示该反应的速率B.反应过程中能量关系可用上图表示C.若将该反应设计成原电池,锌为负极D.若设计为原电池,当有32.5 g锌溶解时,正极放出标准状况下11.2 L气体【解析】 锌是固体,一般不能用固体或纯液体来表示化学反应速率。【答案】 A8.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )A.水既是氧化剂又是溶剂B.放电时正极上有氢气生成C.放电时OH-向正极移动D.总反应式为2Li+2H2O===2LiOH+H2↑【解析】 原电池放电时OH-向负极移动,C项错误。由此电池的名称锂水电池可推测其总反应式为2Li+2H2O===2LiOH+H2↑,据此可再写出其电极反应:(负极)2Li-2e-===2Li+,(正极)2H2O+2e-===2OH-+H2↑,综上分析,A、B、D三项均正确。【答案】 C9.下列说法正确的是( ) A.化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率B.在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值C.同一化学反应中,化学反应速率可用反应物浓度的改变表示,也可用生成物浓度的改变表示,其值可能相同,也可能不同D.化学反应速率的单位通常是g·L-1·s-1,也可以是kg·L-1·s-1【解析】 由化学反应速率的概念“单位时间内反应物浓度的减少量或生成物浓度的增加量”,可以看出它适合于所有的化学反应,并非专指可逆反应,故A项不正确;单位时间是正值,反应物浓度的减少量或生成物浓度的增加量也是正值,故其比值也必为正值,B项不正确;由化学反应速率的计算公式vB=可以看出,其单位中不可能出现g、kg等质量单位,D项不正确。【答案】 C10.根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
A.其反应物或生成物都能用来表示该反应的速率B.反应过程中能量关系可用上图表示C.若将该反应设计成原电池,锌为负极D.若设计为原电池,当有32.5 g锌溶解时,正极放出标准状况下11.2 L气体【解析】 锌是固体,一般不能用固体或纯液体来表示化学反应速率。【答案】 A8.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )A.水既是氧化剂又是溶剂B.放电时正极上有氢气生成C.放电时OH-向正极移动D.总反应式为2Li+2H2O===2LiOH+H2↑【解析】 原电池放电时OH-向负极移动,C项错误。由此电池的名称锂水电池可推测其总反应式为2Li+2H2O===2LiOH+H2↑,据此可再写出其电极反应:(负极)2Li-2e-===2Li+,(正极)2H2O+2e-===2OH-+H2↑,综上分析,A、B、D三项均正确。【答案】 C9.下列说法正确的是( ) A.化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率B.在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值C.同一化学反应中,化学反应速率可用反应物浓度的改变表示,也可用生成物浓度的改变表示,其值可能相同,也可能不同D.化学反应速率的单位通常是g·L-1·s-1,也可以是kg·L-1·s-1【解析】 由化学反应速率的概念“单位时间内反应物浓度的减少量或生成物浓度的增加量”,可以看出它适合于所有的化学反应,并非专指可逆反应,故A项不正确;单位时间是正值,反应物浓度的减少量或生成物浓度的增加量也是正值,故其比值也必为正值,B项不正确;由化学反应速率的计算公式vB=可以看出,其单位中不可能出现g、kg等质量单位,D项不正确。【答案】 C10.根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )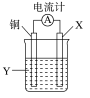 A.X可以是银或石墨B.Y是硫酸铜溶液C.电子从铜电极经外电路流向X电极D.X极上的电极反应式为Ag++e-===Ag【解析】 由电池反应2Ag++Cu===2Ag+Cu2+可知,铜作负极,电极反应为Cu-2e-===Cu2+,X为正极,可以是比铜不活泼的银或石墨等,电极反应为Ag++e-===Ag;电解质溶液中需含有Ag+,故B说法错误。【答案】 B11.(2016·沈阳高一检测)在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g)当m、n、p、q为任意整数时,不能作为达到平衡标志的是( )A.体系的压强不再改变B.体系的温度不再改变C.各组分的浓度不再改变D.各组分的质量分数不再改变【解析】 平衡状态的直接标志是各组分的浓度不再改变,则各组分的质量分数不再改变,C、D正确;间接标志是体系的温度不再改变,故B正确;但因m+n与p+q的相对大小不确定,故A无法确定。若m+n=p+q,则压强始终不变化,则A不能作为达到平衡的标志,因此选A。【答案】 A12.一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。t/min0246810V(O2)/mL0.09.917.222.426.529.9下列叙述不正确的是(溶液体积变化忽略不计)( )A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)C.反应至6 min时,c(H2O2)=0.30 mol/LD.反应至6 min时,H2O2分解了50%【解析】 2H2O22H2O+O2↑A.6 min时,生成O2的物质的量n(O2)==1×10-3 mol,依据反应方程式,消耗n(H2O2)=2×10-3 mol,所以0~6 min时,v(H2O2)=≈3.3×10-2 mol/(L·min),A正确。B.6~10 min时,生成O2的物质的量n(O2)=≈0.335×10-3 mol,依据反应方程式,消耗n(H2O2)=0.335×10-3mol×2=0.67×10-3 mol,6~10 min时,v(H2O2)=≈1.68×10-2 mol/(L·min)<3.3×10-2 mol/(L·min),B正确。C.反应至6 min时,消耗n(H2O2)=2×10-3 mol,剩余n(H2O2)=0.40 mol/L×0.01 L-2×10-3 mol=2×10-3 mol,c(H2O2)==0.20 mol/L,C错误。D.反应至6 min时,消耗n(H2O2)=2×10-3 mol,n(H2O2)总=4×10-3 mol,所以H2O2分解了50%,D正确。【答案】 C二、非选择题(本题包括4小题,共52分)13.(10分)利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:(1)实验原理:Fe+2H+===Fe2++H2↑。(2)实验装置(如图)。
A.X可以是银或石墨B.Y是硫酸铜溶液C.电子从铜电极经外电路流向X电极D.X极上的电极反应式为Ag++e-===Ag【解析】 由电池反应2Ag++Cu===2Ag+Cu2+可知,铜作负极,电极反应为Cu-2e-===Cu2+,X为正极,可以是比铜不活泼的银或石墨等,电极反应为Ag++e-===Ag;电解质溶液中需含有Ag+,故B说法错误。【答案】 B11.(2016·沈阳高一检测)在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g)当m、n、p、q为任意整数时,不能作为达到平衡标志的是( )A.体系的压强不再改变B.体系的温度不再改变C.各组分的浓度不再改变D.各组分的质量分数不再改变【解析】 平衡状态的直接标志是各组分的浓度不再改变,则各组分的质量分数不再改变,C、D正确;间接标志是体系的温度不再改变,故B正确;但因m+n与p+q的相对大小不确定,故A无法确定。若m+n=p+q,则压强始终不变化,则A不能作为达到平衡的标志,因此选A。【答案】 A12.一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。t/min0246810V(O2)/mL0.09.917.222.426.529.9下列叙述不正确的是(溶液体积变化忽略不计)( )A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)C.反应至6 min时,c(H2O2)=0.30 mol/LD.反应至6 min时,H2O2分解了50%【解析】 2H2O22H2O+O2↑A.6 min时,生成O2的物质的量n(O2)==1×10-3 mol,依据反应方程式,消耗n(H2O2)=2×10-3 mol,所以0~6 min时,v(H2O2)=≈3.3×10-2 mol/(L·min),A正确。B.6~10 min时,生成O2的物质的量n(O2)=≈0.335×10-3 mol,依据反应方程式,消耗n(H2O2)=0.335×10-3mol×2=0.67×10-3 mol,6~10 min时,v(H2O2)=≈1.68×10-2 mol/(L·min)<3.3×10-2 mol/(L·min),B正确。C.反应至6 min时,消耗n(H2O2)=2×10-3 mol,剩余n(H2O2)=0.40 mol/L×0.01 L-2×10-3 mol=2×10-3 mol,c(H2O2)==0.20 mol/L,C错误。D.反应至6 min时,消耗n(H2O2)=2×10-3 mol,n(H2O2)总=4×10-3 mol,所以H2O2分解了50%,D正确。【答案】 C二、非选择题(本题包括4小题,共52分)13.(10分)利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:(1)实验原理:Fe+2H+===Fe2++H2↑。(2)实验装置(如图)。 (3)原电池设计及注意的问题:①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓——”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是________________,发生了________反应。【解析】 根据电池反应:Fe+2H+===Fe2++H2↑可知,正极为比铁不活泼的金属或非金属导体。耳机发出声音是电能转化为声音。由于铁为负极,应连接电流计的负极。【答案】 ①电能 电能 ②负 Fe-2e-===Fe2+ 氧化14.(14分)某同学为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表所示(累计值):时间/min12345氢气体积/mL50120232290310(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大?________,原因是___________________________。(2)哪一时间段的反应速率最小________,原因是_______________。(3)求2~3 min时间段以盐酸的浓度变化表示的该反应速率是________。(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是________。【解析】 (1)由表中的数据知,反应速率在2~3 min时最大,原因是Zn与HCl反应放热,使溶液的温度升高。(2)由表中的数据知,反应速率在4~5 min时最小,原因是随着反应的进行,c(H+)减小。(3)n(H2)==0.005 mol,Zn+2HCl===ZnCl2+H2↑0.01 mol 0.005 mol则Δc==0.1 mol·L-1v(HCl)===0.1 mol·L-1·min-1。(4)加入C,H+和NO与Zn反应不产生H2;加入D,Cu2+与Zn反应使生成H2的速率加快;加入E,CO消耗H+,使生成的H2也减少。【答案】 (1)2~3 min 该反应是放热反应,此时温度高(2)4~5 min 此时H+浓度小(3)0.1 mol·L-1·min-1 (4)A、B15.(12分)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH--2e-===Zn(OH)2,Ag2O+H2O+2e-===2Ag+2OH-。
(3)原电池设计及注意的问题:①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓——”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是________________,发生了________反应。【解析】 根据电池反应:Fe+2H+===Fe2++H2↑可知,正极为比铁不活泼的金属或非金属导体。耳机发出声音是电能转化为声音。由于铁为负极,应连接电流计的负极。【答案】 ①电能 电能 ②负 Fe-2e-===Fe2+ 氧化14.(14分)某同学为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表所示(累计值):时间/min12345氢气体积/mL50120232290310(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大?________,原因是___________________________。(2)哪一时间段的反应速率最小________,原因是_______________。(3)求2~3 min时间段以盐酸的浓度变化表示的该反应速率是________。(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是________。【解析】 (1)由表中的数据知,反应速率在2~3 min时最大,原因是Zn与HCl反应放热,使溶液的温度升高。(2)由表中的数据知,反应速率在4~5 min时最小,原因是随着反应的进行,c(H+)减小。(3)n(H2)==0.005 mol,Zn+2HCl===ZnCl2+H2↑0.01 mol 0.005 mol则Δc==0.1 mol·L-1v(HCl)===0.1 mol·L-1·min-1。(4)加入C,H+和NO与Zn反应不产生H2;加入D,Cu2+与Zn反应使生成H2的速率加快;加入E,CO消耗H+,使生成的H2也减少。【答案】 (1)2~3 min 该反应是放热反应,此时温度高(2)4~5 min 此时H+浓度小(3)0.1 mol·L-1·min-1 (4)A、B15.(12分)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH--2e-===Zn(OH)2,Ag2O+H2O+2e-===2Ag+2OH-。  根据上述反应式,完成下列题目。(1)判断下列叙述中正确的是________。A.在使用过程中,电解质KOH不断被消耗B.使用过程中,电子由Ag2O极经外电路流向Zn极C.Zn是负极,Ag2O是正极D.Zn电极发生还原反应,Ag2O电极发生氧化反应(2)写出电池的总反应式:_____________________。(3)使用时,负极区的c(OH-)________(填“增大”、“减小”或“不变”,下同),正极区的c(OH-)________,电解质溶液的c(OH-)________。【解析】 (1)由正、负电极反应式可知:Zn电极为负极,发生氧化反应,负极区c(OH-)减小,Ag2O为正极,发生还原反应,正极区c(OH-)增大;使用时电子由Zn极流向Ag2O极,正、负极反应式相加可得总反应式为Zn+Ag2O+H2O===Zn(OH)2+2Ag,故电解质KOH未被消耗,电解质溶液的c(OH-)不变。【答案】 (1)C(2)Zn+Ag2O+H2O===Zn(OH)2+2Ag(3)减小 增大 不变16.(16分)将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若2 s(秒)时测得C的浓度为0.6 mol/L,填写下列空白:(1)用物质A表示反应的平均速率为________。(2)用物质B表示反应的平均速率为________。(3)2 s时物质A的转化率为________。(4)2 s时物质B的体积分数为________。【解析】 2A(g) + B(g) 2C(g)起始浓度 2 mol/L 1 mol/L 0变化浓度 0.6 mol/L 0.3 mol/L 0.6 mol/L2 s时浓度 1.4 mol/L 0.7 mol/L 0.6 mol/L(1)v(A)==0.3 mol/(L·s)。(2)v(B)==0.15 mol/(L·s)。(3)A的转化率=×100%=30%。(4)B的体积分数=×100%≈25.9%。【答案】 (1)0.3 mol/(L·s) (2)0.15 mol/(L·s) (3)30% (4)25.9%
根据上述反应式,完成下列题目。(1)判断下列叙述中正确的是________。A.在使用过程中,电解质KOH不断被消耗B.使用过程中,电子由Ag2O极经外电路流向Zn极C.Zn是负极,Ag2O是正极D.Zn电极发生还原反应,Ag2O电极发生氧化反应(2)写出电池的总反应式:_____________________。(3)使用时,负极区的c(OH-)________(填“增大”、“减小”或“不变”,下同),正极区的c(OH-)________,电解质溶液的c(OH-)________。【解析】 (1)由正、负电极反应式可知:Zn电极为负极,发生氧化反应,负极区c(OH-)减小,Ag2O为正极,发生还原反应,正极区c(OH-)增大;使用时电子由Zn极流向Ag2O极,正、负极反应式相加可得总反应式为Zn+Ag2O+H2O===Zn(OH)2+2Ag,故电解质KOH未被消耗,电解质溶液的c(OH-)不变。【答案】 (1)C(2)Zn+Ag2O+H2O===Zn(OH)2+2Ag(3)减小 增大 不变16.(16分)将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若2 s(秒)时测得C的浓度为0.6 mol/L,填写下列空白:(1)用物质A表示反应的平均速率为________。(2)用物质B表示反应的平均速率为________。(3)2 s时物质A的转化率为________。(4)2 s时物质B的体积分数为________。【解析】 2A(g) + B(g) 2C(g)起始浓度 2 mol/L 1 mol/L 0变化浓度 0.6 mol/L 0.3 mol/L 0.6 mol/L2 s时浓度 1.4 mol/L 0.7 mol/L 0.6 mol/L(1)v(A)==0.3 mol/(L·s)。(2)v(B)==0.15 mol/(L·s)。(3)A的转化率=×100%=30%。(4)B的体积分数=×100%≈25.9%。【答案】 (1)0.3 mol/(L·s) (2)0.15 mol/(L·s) (3)30% (4)25.9%
相关试卷
这是一份化学必修 第二册全册综合课后练习题,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册全册综合巩固练习,共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册全册综合同步练习题,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。










