高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应学案
展开![]() 第一章 第二节 离子反应
第一章 第二节 离子反应
第一课时
【学习目标】
1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.知道酸碱盐在溶液中能发生电离,并能熟练书写电离方程式。
【目标一】电解质的电离
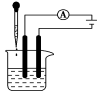
【实验1-2】探究物质的导电性
装置 | 烧杯中药品 | 实验现象 | 烧杯中药品 | 实验现象 |
| 干燥的NaCl固体 | 电流表指针 | NaCl溶液 | 电流表指针 |
KNO3固体 | 电流表指针 | KNO3溶液 | 电流表指针 | |
蒸馏水 | 电流表指针 | |||
结论:
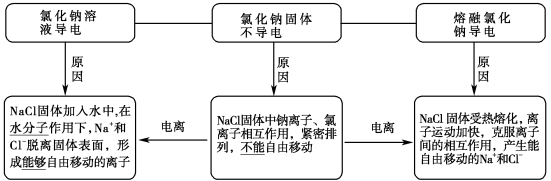
结合初中做过的物质导电性实验,我们知道盐酸、NaOH溶液、NaCl溶液等都能导电。不仅如此,如果将NaCl、KNO3、NaOH等固体分别加热至熔化,它们也都能导电。
一. 电解质和非电解质
1.电解质
⑴ 概念: 化合物。
⑵ 常见物质类别
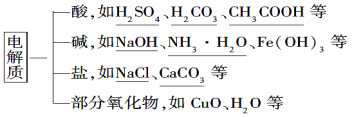
【注意事项】
①“化合物”:电解质讨论的对象必须是化合物。
② “或”:二者具备其一即可,若两者都具备也行。
③ 纯净的或固态的电解质本身不一定能导电。
如:HCl气体、NaCl固体等。
④ 离子化合物在水溶液或熔融状态下,都能电离。如:NaOH、NaCl、NaNO3等。
而共价化合物只能在水溶液中发生电离,如:HCl、HNO3、H2SO4等。
⑤ 溶于水能导电的化合物,不一定是电解质。如:NH3、SO2、CO2等。
它们的水溶液都能导电,是因为跟水反应生成了电解质,而非本身能电离,故它们本身都不是电解质。
【思考】铝、NaCl溶液、氨水是电解质吗?
2.电解质导电的原因
⑴ 电解质导电原因:具有能自由移动的、带电荷的粒子。
3.非电解质
⑴ 概念: 化合物。
 ⑵ 常见物质类别
⑵ 常见物质类别
【注意事项】
① “都”的理解;
② “化合物”:非电解质讨论的对象必须是化合物。单质、混合物既不是电解质,也不是非电解质。
【导练1】下列物质:①金属铜; ②固态NaCl; ③CO2; ④H2SO4; ⑤碳棒; ⑥酒精;
⑦KOH晶体; ⑧熔融状态的KNO3; ⑨葡萄糖; ⑩氨气。
电解质有: ;非电解质有: ;
能导电的物质有: 。
【导练2】下列叙述正确的是( )。
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.固体氯化钠不导电,但氯化钠是电解质
C.三氧化硫溶于水能导电,所以三氧化硫是电解质
D.BaSO4的水溶液不能导电,所以BaSO4是非电解质
二.强电解质和弱电解质
1.强电解质:在水溶液里 的电解质。
包括以下几种:
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI(六大强酸);
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2(四大强碱);
绝大多数盐:NaCl、Na2CO3、CaCO3、AgCl等;
金属氧化物:Na2O、CaO等。
2.弱电解质:在水溶液里 的电解质。
包括以下几种:
弱酸:H2CO3、CH3COOH、HClO、HF、H2SO3等;
弱碱:NH3·H2O、Cu(OH)2、Mg(OH)2等;
少数盐:(CH3COO)2Pb等;以及H2O
【注意】① 划分强、弱电解质的唯一标准是看电解质能否完全电离。
② 强电解质的导电能力不一定强,导电性强弱取决于溶液中自由移动的离子的浓度。
③ 电解质的强弱与溶解性无关,易溶的物质不一定是强电解质,难溶的物质不一定是弱电
解质。如:CH3COOH易溶,但是弱电解质; BaSO4、AgCl 等难溶于水,熔化或溶于水的部
分全部电离,所以它们是强电解质。
三.酸、碱、盐在水溶液中的电离
1.电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
2.电离方程式
⑴ 定义:电离方程式是用化学式和离子符号表示电解质电离过程的式子。
⑵ 举例
①强电解质电离方程式: 用“===”连接。
HCl === H++Cl- KNO3 === K++NO3-
H2SO4 === NaOH ===
②弱电解质电离方程式:用“![]() ”连接。
”连接。
CH3COOH ![]() CH3COO-+H+ NH3·H2O
CH3COO-+H+ NH3·H2O![]() NH4+ + OH-
NH4+ + OH-
多元弱酸分步电离,且第一步电离程度远大于第二步
H2CO3 ![]() HCO3-
HCO3-![]()
多元弱碱一步电离 Cu(OH)2![]()
③酸式盐的电离方程式
酸式盐均为强电解质,电离用“===”连接。
a.NaHSO4的电离
NaHSO4 在水溶液能完全电离出H+和SO2- 4,在熔融状态下只能电离出Na+和 HSO4-。
在水溶液中:NaHSO4 ===
在熔融状态下:NaHSO4(熔融)===
b.NaHCO3的电离
NaHCO3在水溶液HCO3-不拆成离子,但HCO3-在水溶液中能继续电离。
在水溶液中:NaHCO3 ===
HCO3-![]()
【归纳】认识酸、碱、盐的本质:
电离时生成的阳离子 的化合物叫做酸,如:
电离时生成的阴离子 的化合物叫做碱,如:
电离时能生成 和 的化合物叫做盐,如:
【讨论】NaHSO4溶液能电离出H+和Na+,NaHSO4属于酸吗?
【导练3】写出下列物质的电离方程式:
Na3PO4
HF
H2SO3
Mg(OH)2
第二课时
【学习目标】
1.了解离子反应的本质。
2.正确书写离子方程式。
3.初步掌握离子共存的判断方法。
【目标一】离子反应及方程式书写
1.离子反应
定义:
【实验1-3】
实验 | 向盛有2mL Na2SO4稀溶液的试管中加入2 mL BaCl2稀溶液,观察现象并分析。 | ||
现象 | 分析 | ||
Na2SO4和BaCl2的电离方程式 | 混合前两种溶液中离子 | 混合后溶液中离子 | |
|
|
|
|
2.离子方程式:用 式子叫做离子方程式。
3.离子方程式的书写步骤:
①写:正确书写反应的化学方程式。
②拆:把易溶于水且易电离的物质拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
③删:删去方程式两边不参加反应的离子,并将方程式化为最简。
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
4.书写离子方程式的拆分原则
⑴ 能拆写成离子的物质

⑵ 微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。如石灰水和石灰乳:石灰水写成离子形式,而石灰乳则写化学式;微溶物作为生成物,一般写化学式(标“↓”)。
⑶ 氨水作反应物可写作NH3·H2O;作生成物,若有加热条件或浓度很大时,可写作NH3(标“↑”)。
⑷ 固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应;浓硫酸与固体反应不能写离子方程式。
⑸ 多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3与盐酸反应的离子方程
式为HCO+H+===CO2↑+H2O。
【思考与讨论】完成下表中各反应的化学方程式和离子方程式,思考两种方程式在表示某一类反应时,表达的含义有什么不同,并进行讨论。
反应物 | 化学方程式 | 离子方程式 | 两种方程式的不同 |
HCl + NaOH |
|
|
|
HCl + KOH |
|
| |
H2SO4 + NaOH |
|
| |
H2SO4 + KOH |
|
|
上面4个反应都是中和反应,虽然4个反应的化学方程式不同,但它们的离子方程式却是相同的。
揭示强酸与强碱发生中和反应的实质是 。
5.离子方程式表示的意义:
①表示某一个具体的化学反应。
AgNO3+NaCl===AgCl↓+NaNO3 如离子反应可表示为 。
②表示同一类型的离子反应。如可以表示强酸和可溶性强碱生成水和可溶性盐的反应。
6.离子反应发生的条件:
⑴ 从微观角度看,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中相互交换离子的反应。离子之间的交换反应发生的条件就是 反应发生的条件即有 或 或 生成,这类反应就能发生。
⑵ 离子反应还有其他类型,如有离子参加的置换反应等。例如,Zn与稀硫酸反应的离子方程式为: Zn+ 2H+==== Zn2++H2↑
【练习】写出下列反应的离子方程式
⑴ 醋酸与氢氧化钠反应:
⑵ 硫酸与氢氧化钡反应:
⑶ 锌粒与稀硫酸反应:
⑷ 氢氧化铜溶于盐酸:
⑸ 碳酸氢钠溶液与稀硫酸反应:
⑹ 碳酸钙与稀盐酸反应:
7.判断离子方程式正误,一般从以下几方面考虑:
⑴ 必需依据物质反应的客观事实,如铁与盐酸反应:
2Fe+6H+==== 2Fe3++3H2↑(错误),正确的是:
⑵ 必须看表示物质的化学式是否正确,如氢氧化铜和稀硫酸反应
OH-+H+==== H2O(错误),正确的是:
⑶ 必须遵守原子守恒和电荷守恒,如铜和硝酸银溶液反应:
Cu +Ag+==== Cu2++Ag(错误),正确的是:
⑷ 必须检查是否漏掉参加反应的离子,如氢氧化钡和硫酸铜溶液反应
Ba2++SO42-==== BaSO4↓(错误),正确的是:
⑸ 必须遵守反应物或生成物的配比,如氢氧化钡和稀硫酸溶液的反应
Ba2++OH-+H++SO42-==== BaSO4+H2O(错误),正确的是:
【例1】下列不能发生离子反应的是( )。
A.NaCl溶液与AgNO3溶液
B.KNO3溶液与NaOH溶液
C.稀硫酸与BaCl2溶液
D.盐酸与Na2CO3溶液
【例2】下列化学反应的离子方程式错误的是( )。
A.BaCl2溶液与K2SO4溶液的反应:Ba2++SO===BaSO4↓
B.NaOH溶液与硝酸的反应:OH-+H+===H2O
C.Na2CO3溶液与硫酸的反应:CO+2H+===CO2↑+H2O
D.碳酸钙与盐酸的反应:CO+2H+===CO2↑+H2O
【目标二】离子共存问题
判断离子能否共存实际上是看离子之间能否反应,若反应,则不共存;若不反应,则大量共存。
1.离子不能大量共存的三种情况
⑴ 生成难溶性或微溶性物质的离子不能大量共存:
①生成难溶性的盐:如Ca2+与CO,Ba2+与CO、SO,Ag+与Cl-等。
②生成难溶性的碱:如OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等。
⑵ 生成气体的离子不能大量共存:如H+与CO、HCO等。
⑶ 生成水或其他难电离物质的离子不能大量共存:如H+与OH-、CH3COO-,OH-与NH等。
2.判断离子能否大量共存的“隐含条件”
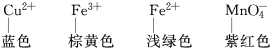
⑴ “无色透明”溶液不存在有色离子,如:
⑵ 酸性溶液中不能大量存在与H+反应的离子。
“酸性”溶液的不同描述:
①酸性溶液。 ②pH<7的溶液。 ③使石蕊溶液变红色的溶液。
⑶ 碱性溶液中不能大量存在与OH-反应的离子。
“碱性”溶液的不同描述:
①碱性溶液。 ②pH>7的溶液。 ③使石蕊溶液变蓝的溶液。
【例3】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )。
A.Ba2+、Na+、NO、SO B.Mg2+、Cl-、Al3+、SO
C.K+、Cl-、CO、NO D.Ca2+、Na+、Fe3+、NO
【例4】某溶液中存在大量的H+、SO、Cl-,该溶液中还可能大量存在的离子是( )。
A.OH- B.NO C.Ag+ D.Ba2+
【例5】
有下列9种离子:Mg2+、H+、Na+、Cl-、OH-、Cu2+、SO、NO、CO。
⑴ 与H+不能大量共存的离子有哪些________________________________________。
⑵ 与OH-不能大量共存的离子有哪些_______________________________________。
⑶ 与Ba2+不能大量共存的离子有哪些_______________________________________。
⑷ 无色溶液中一定不能大量存在的离子有哪些_______________________________。
高中人教版 (2019)第二节 离子反应导学案及答案: 这是一份高中人教版 (2019)第二节 离子反应导学案及答案,共5页。学案主要包含了电解质的电离,离子反应等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案及答案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案及答案,共8页。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时学案设计: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时学案设计,共9页。