高中人教版 (2019)第二节 离子反应导学案及答案
展开![]() 第二节 离子反应
第二节 离子反应
P13
一、电解质的电离
实验表明,干燥的NaCl固体、KNO3固体 导电,蒸馏水也 导电(严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出)。但是,NaCl溶液、KNO3溶液却 导电。
在 里或 下能够导电的 叫做 。HCl、H2SO4、NaOH、Ca(OH)2、NaCl、KNO3等都是电解质。
P14
电解质的水溶液(或熔化而成的液体)能够导电,说明在这些水溶液(或液体)中,存在着能 的、 的粒子。
如下图,氯化钠溶于水生成 和 。氯离子周围的水分子比钠离子周围的水分子 ,原因是氯离子半径比钠离子半径 。氯离子周围的水分子中的 原子朝向氯离子,钠离子周围的水分子中的 原子朝向钠离子。
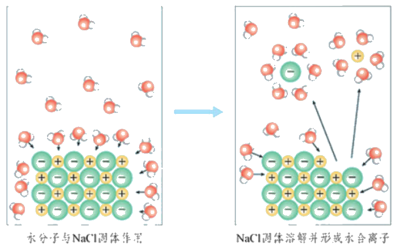
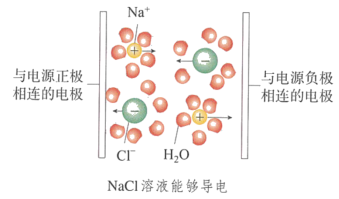
当在NaCl溶液中插入电极并接通电源时,带正电荷的水合钠离子向与电源 极相连的电极移动,带负电荷的水合氯离子向与电源 极相连的电极移动,因而NaCl溶液能够导电(如下图)。
P15
电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做 。电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。例如:
NaCl= KNO3= HCl=
H2SO4= HNO3=
可以看出,HCl、H2SO4和HNO3在水溶液中都能电离出 ,因此,我们可以从电离的角度认识酸的本质。即电离时生成的阳离子全部是 的化合物叫做酸。
注:氢原子失去电子后,剩余1个质子构成的核,即氢离子。水合氢离子,通常用 表示。为了简便,也常把H3O+写作 。
P16
二、离子反应
P17
电解质在溶液中的反应实质上是 之间的反应,这样的反应属于 。用实际参加反应的离子符号来表示反应的式子叫做 。
离子方程式的书写一般按以下步骤:
(1)写出反应的化学方程式。
(2)把 且 (如强酸、强碱和大部分可溶性盐)写成离子形式, 、
和 等仍用化学式表示。
(3)删去方程式两边 ,并将方程式化为最简。
(4)检查离子方程式两边各元素的 和 是否相等。
P18
可以看出,离子方程式不仅可以表示某个具体的化学反应,还可以表示 的离子反应。
这类离子反应发生的条件就是复分解反应发生的条件,即 、 或 。只要具备上述条件之一,反应就能发生。
除了以离子互换形式进行的复分解反应,离子反应还有其他类型,如有离子参加的 等。例如,Zn与稀硫酸的反应。
![]() 第二节 离子反应
第二节 离子反应
P13
一、电解质的电离
实验表明,干燥的NaCl固体、KNO3固体 都不 导电,蒸馏水也 不 导电(严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出)。但是,NaCl溶液、KNO3溶液却 都能够 导电。
在 水溶液 里或 熔融状态 下能够导电的 化合物 叫做 电解质 。HCl、H2SO4、NaOH、Ca(OH)2、NaCl、KNO3等都是电解质。
P14
电解质的水溶液(或熔化而成的液体)能够导电,说明在这些水溶液(或液体)中,存在着能 自由移动 的、 带电荷 的粒子。
如下图,氯化钠溶于水生成 水合氯离子 和 水合钠离子 。氯离子周围的水分子比钠离子周围的水分子 多 ,原因是氯离子半径比钠离子半径 大 。氯离子周围的水分子中的 氢 原子朝向氯离子,钠离子周围的水分子中的 氧 原子朝向钠离子。

当在NaCl溶液中插入电极并接通电源时,带正电荷的水合钠离子向与电源 负 极相连的电极移动,带负电荷的水合氯离子向与电源 正 极相连的电极移动,因而NaCl溶液能够导电(如下图)。
P15

电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做 电离 。电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。例如:
NaCl= Na++ Cl- KNO3= K++NO3- HCl= H++Cl-
H2SO4= 2H++ SO42- HNO3= H+ + NO3-
可以看出,HCl、H2SO4和HNO3在水溶液中都能电离出 H+ ,因此,我们可以从电离的角度认识酸的本质。即电离时生成的阳离子全部是 氢离子(H+) 的化合物叫做酸。
注:氢原子失去电子后,剩余1个质子构成的核,即氢离子。水合氢离子,通常用 H3O+ 表示。为了简便,也常把H3O+写作 H+ 。
P16
二、离子反应
P17
电解质在溶液中的反应实质上是 离子 之间的反应,这样的反应属于 离子反应 。用实际参加反应的离子符号来表示反应的式子叫做 离子方程式 。
离子方程式的书写一般按以下步骤:
(1)写出反应的化学方程式。
(2)把 易溶于水 且 易电离的物质 (如强酸、强碱和大部分可溶性盐)写成离子形式, 难溶的物质 、 气体 和 水 等仍用化学式表示。
(3)删去方程式两边 不参加反应的离子 ,并将方程式化为最简。
(4)检查离子方程式两边各元素的 原子个数 和 电荷总数 是否相等。
P18
可以看出,离子方程式不仅可以表示某个具体的化学反应,还可以表示 同一类型 的离子反应。
这类离子反应发生的条件就是复分解反应发生的条件,即 生成沉淀 、 放出气体 或 生成水 。只要具备上述条件之一,反应就能发生。
除了以离子互换形式进行的复分解反应,离子反应还有其他类型,如有离子参加的 置换反应 等。例如,Zn与稀硫酸的反应。
化学人教版 (2019)第二节 离子反应导学案: 这是一份化学人教版 (2019)第二节 离子反应导学案,共12页。学案主要包含了电离方程式的书写,离子反应,离子方程式的书写步骤等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应学案: 这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应学案,共8页。学案主要包含了学习目标,实验1-2,注意事项,实验1-3,思考与讨论等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时学案设计: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时学案设计,共9页。