


高考化学一轮复习跟踪检测9铁铜及其化合物 含解析
展开铁、铜及其化合物
1.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含有铁元素 ③铁位于元素周期表中第四周期第ⅧB族 ④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 ⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3 ⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②④ C.②⑤ D.④⑥
解析:选B ①当铁中含有杂质时,在潮湿的空气中会发生电化学腐蚀,而纯铁的抗腐蚀能力较强,错误;③铁位于元素周期表的第Ⅷ族,而不是第ⅧB族,错误;⑤铁与HNO3反应被氧化为Fe3+,但若铁过量,则Fe3+被Fe还原为Fe2+,所以,Fe与HNO3反应的产物可能因铁过量而生成Fe(NO3)2,错误;⑥FeCl2、Fe(OH)3可分别通过化合反应Fe+2FeCl3===3FeCl2、4Fe(OH)2+O2+2H2O===4Fe(OH)3制得,错误。
2.氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种反应物在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是( )
A.这里的“另一种反应物”具有还原性
B.CuH可作氧化剂、还原剂
C.CuH+Cl2===CuCl+HCl(燃烧)
D.CuH+HCl===CuCl+H2↑(常温)
解析:选C Cl2具有强氧化性,与多价态金属或化合物反应时,生成最高价态的金属化合物,CuH与Cl2反应产物应为CuCl2和HCl,C项错误。
3.为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用( )
A.KMnO4溶液 B.H2O2溶液
C.氯水 D.HNO3溶液
解析:选B A、C、D三项中的氧化剂虽均能使Fe2+氧化为Fe3+,但同时会引入新的杂质,故此三项不符合题意;H2O2具有氧化性,能氧化Fe2+为Fe3+,还原产物为水,不引入新杂质,B项符合题意。
4.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
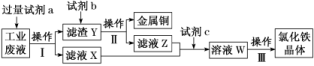
则下列说法正确的是( )
A.试剂a是铁、试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C.试剂c是氯气,相应的反应为2Fe2++Cl2===2Fe3++2Cl-
D.用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
解析:选C A项,由最终要得到氯化铁晶体及流程图知,b是盐酸,错误;B项,操作Ⅰ和操作Ⅱ是过滤,操作Ⅲ为蒸发结晶,所用仪器不相同,错误;C项,滤液Z和X中均含有氯化亚铁,因此c为氯气,正确;D项,高锰酸钾能氧化Cl-而褪色,因此不能用于检验是否含有Fe2+,错误。
5.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A.用如图装置可以制备沉淀Fe(OH)2
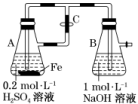
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
解析:选C 反应开始时生成的H2进入B中,可排出其中的空气,防止生成的Fe(OH)2被氧化,一段时间后关闭止水夹C,A中硫酸亚铁进入B中可生成Fe(OH)2,A正确;FeCl3易水解,为防止水解配制溶液时先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,B正确;Fe3+与铁反应可生成Fe2+,则向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化,D正确。
6.已知酸性条件下有如下反应:2Cu+===Cu2++Cu↓。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
实验现象 | 有红色固体剩余,溶液变为蓝色 | 产生无色气体 | 产生无色气体,溶液变为蓝色 | 产生红棕色气体,溶液变为绿色 |
由此推出本次氢气还原氧化铜实验的产物( )
A.是Cu
B.是Cu2O
C.一定有Cu,一定有Cu2O
D.一定有Cu2O,可能有Cu
解析:选D 浓H2SO4(加热)、硝酸均能氧化Cu或Cu2O;而稀H2SO4与Cu不反应,与Cu2O反应。
7.将铜和氧化铁的混合物溶于足量稀盐酸,再向所得溶液中滴入2滴KSCN溶液后出现红色。下列有关说法错误的是( )
A.容器中可能有固体残渣
B.所得溶液中存在Fe2+、Fe3+、Cu2+
C.原固体中n(Fe2O3)>n(Cu)
D.再加入铜后,溶液红色逐渐褪去
解析:选A 将铜和氧化铁的混合物溶于足量稀盐酸中,发生反应Fe2O3+6HCl===2FeCl3+3H2O、2FeCl3+Cu===2FeCl2+CuCl2,向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜在溶液中一定全部溶解,容器中不可能有固体残渣,A错误,B正确;根据化学方程式可得关系式Fe2O3~2Fe3+~Cu,铁离子过量,所以原固体中n(Fe2O3)>n(Cu),C正确;再加入Cu和Fe3+反应,溶液红色褪去,D正确。
8.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
选项 | 操作、现象 | 解释 |
A | 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
C | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
解析:选D A项中Fe3+将I-氧化为I2,淀粉遇碘变蓝;B项中红棕色斑点是Fe2O3;C项中铁与稀硝酸反应产生的气体为NO。
9.(2019·南通模拟)某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
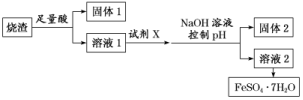
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
解析:选D 流程设计意图是用硫酸把Fe2O3、Al2O3转化为硫酸盐,除去SiO2,然后用铁粉还原Fe3+得到硫酸亚铁,A正确;固体1为SiO2,分离FeSO4和Al2(SO4)3采用的是调控pH的方法,使Al3+转化为Al(OH)3沉淀从而与FeSO4分离,B正确;Fe2+容易被氧化,所以在得到FeSO4·7H2O产品的过程中,要防止其氧化和分解,C正确;在溶液1中直接加过量的NaOH得到的是Fe(OH)2沉淀,但Fe(OH)2不稳定,很容易被氧化为Fe(OH)3,这样的话,最终所得的产品不纯,混有较多的Fe2(SO4)3杂质,D不正确。
10.下列图像是表示铁与一定量硝酸反应时,铁和硝酸铁之间物质的量(mol)的关系,其中正确的是( )

解析:选B 根据反应Fe+2Fe(NO3)3===3Fe(NO3)2可知,和硝酸反应生成Fe(NO3)3的Fe与Fe3+所消耗的Fe的物质的量之比为2∶1,B项正确。
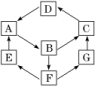 11.某兴趣活动小组利用物质间的互变,设计成一个平面“魔方”,如图所示。
11.某兴趣活动小组利用物质间的互变,设计成一个平面“魔方”,如图所示。
已知:
①A、B、C、D、G含有同种元素。
②
物质 | 纯A(单质) | B(溶液) | C(固体) | D(固体) | G(溶液) |
颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
③E是通常状况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;在水溶液中B也能将一种氧化物氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G。
试回答下列问题:
(1)写出D的化学式:_________________________________________________。
(2)G生成C的过程中所出现的现象为_______________________。
(3)写出下列反应的化学方程式:
E→A:_______________________________________________________;
A→B:_________________________________________________________。
(4)B→F的离子方程式为_______________________________。G与次氯酸反应的离子方程式为_____________________________________________________________。
解析:红褐色固体为Fe(OH)3,红棕色固体为Fe2O3,浅绿色溶液为含Fe2+的溶液,黄色溶液为含Fe3+的溶液。
由①知,A、B、C、D、G都含Fe元素,由②表中的颜色知,A为铁单质,B含Fe3+,C为Fe(OH)3,D为Fe2O3,G含Fe2+。再由③知,E为H2,B为FeCl3,因F是含有三种元素的共价化合物,F与A反应生成E和G,又因为F是由FeCl3在水溶液中将一种氧化物氧化得到的,可推知F为一种含氧酸,结合Fe3+可氧化SO2的水溶液生成H2SO4可推测此氧化物为SO2,F为H2SO4。
答案:(1)Fe2O3
(2)先产生白色沉淀,迅速变成灰绿色,最后变成红褐色
(3)Fe3O4+4H23Fe+4H2O
2Fe+3Cl22FeCl3
(4)2Fe3++SO2+2H2O ===2Fe2++SO+4H+
2Fe2++HClO+H+ === 2Fe3++Cl-+H2O
12.(2019·苏州模拟)α铁纳米粉在现代电子工业上用途极为广泛,用赤铁矿石(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备纳米铁颗粒的实验流程如图:
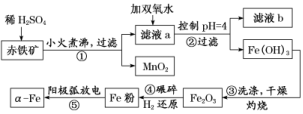
已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 6.7 |
(1)步骤②中用pH试纸测定溶液pH的操作是__________________________________。
步骤②滤液中含有的金属阳离子是____________,步骤④中碾碎的目的是________________________________________________________________________。
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4,此反应的化学方程式是______________________________________________________________。
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、________________________________。
(4)若步骤⑤是利用电弧加热使金属熔融蒸发成蒸汽,使大量颗粒状烟灰尘与周围X气体原子激烈碰撞进行充分的能量交换和电荷交换生成αFe,X气体可以为_______。
a.O2 b.N2 c.He d.H2
(5)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式________________________________________________________。
解析:(1)Fe2O3、FeO、Al2O3、CuO与硫酸反应,滤液a中金属阳离子为Cu2+、Al3+、Fe2+、Fe3+,加双氧水将Fe2+氧化为Fe3+。根据阳离子沉淀时的pH数据可知控制pH=4时,Fe3+已全部变成Fe(OH)3沉淀,滤液中主要为Cu2+、Al3+。(2)MnO2与KClO3、KOH溶液共热,MnO2作还原剂生成K2MnO4,KClO3作氧化剂生成KCl。(3)灼烧需用到酒精灯、三脚架、泥三角、坩埚、坩埚钳。(4)X气体不能与Fe发生反应。
答案:(1)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照 Cu2+、Al3+ 增大接触面积,提高原料的转化率和反应速率
(2)3MnO2+6KOH+KClO33K2MnO4+KCl+3H2O
(3)泥三角、坩埚、坩埚钳 (4)c
(5)3Fe+2O2Fe3O4
13.工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
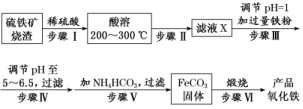
试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为________(填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有____________________;步骤Ⅳ中应选用________试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液
C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是_______________________________________。
(4)步骤Ⅴ的反应温度一般需控制在35 ℃以下,其目的是________________________。
(5)步骤Ⅵ中发生反应的化学方程式为_________________________________________。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取a g样品,充分“酸溶”“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体b g。
①写出加入足量的H2O2发生反应的离子方程式:
________________________________________________________________________;
②测得该样品中Fe元素的质量分数为____________。
解析:(1)SiO2为酸性氧化物,不与稀H2SO4反应。(2)NaOH溶液不易控制溶液pH,应选氨水。(4)既防止NH4HCO3分解,又减少Fe2+水解。(5)FeCO3转变为Fe2O3,肯定有氧化剂O2参与反应。(6)残留b g固体为Fe2O3,根据Fe原子守恒,Fe元素的质量分数为×100%=×100%。
答案:(1)SiO2
(2)漏斗、玻璃棒、烧杯 D
(3)KSCN溶液(或其他合理答案)
(4)防止NH4HCO3分解,减少Fe2+的水解
(5)4FeCO3+O22Fe2O3+4CO2
(6)①2Fe2++H2O2+2H+===2Fe3++2H2O
②×100%
14.铜是生活中常见的金属,请回答下列问题:
(1)Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式:______________________________。
(2)将硫酸铜溶液和碳酸钠溶液混合,会析出Cu2(OH)2CO3 绿色固体,试写出该反应的离子方程式:___________________________________________________________。
(3)火法炼铜的原理:Cu2S+O22Cu+SO2,在该反应中每生成1 mol Cu,转移________mol e-。
(4)据报道,有一种叫Thibacillus Ferroxidans的细菌在有氧气存在的酸性溶液中,可将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O,利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):

①检验溶液B中Fe3+是否被除尽的实验方法__________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式:
方案一:____________________________________________________;
方案二:__________________________________________________________。
解析:(1)金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,说明H2O2在酸性溶液中具有氧化性,能溶解铜,离子方程式为Cu+H2O2+2H+===Cu2++2H2O。(2)将CuSO4溶液和Na2CO3溶液混合,会析出 Cu2(OH)2CO3,反应的离子方程式为2Cu2++CO+2H2O ===Cu2(OH)2CO3↓+2H+。(3)反应中Cu元素化合价由+1价降低到0价,O元素化合价由0价降低到-2价,S元素化合价由-2价升高到+4价,由方程式可知生成2 mol Cu,转移6 mol电子,则该反应中每生成1 mol Cu,转移3 mol电子。(4)①检验溶液B中Fe3+是否被除尽的试剂是KSCN溶液,加入KSCN溶液若变红证明含有Fe3+,若加入后溶液不变红证明不含Fe3+。②CuSO4溶液得到金属铜的方法,可以加入铁粉置换铜,反应的化学方程式为CuSO4+Fe===FeSO4+Cu;也可用惰性电极通电电解CuSO4溶液,反应的化学方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4。
答案:(1)Cu+H2O2+2H+===Cu2++2H2O
(2)2Cu2++CO+2H2O===Cu2(OH)2CO3↓+2H+
(3)3
(4)①取适量上层清液于试管中,加入KSCN溶液若变红证明含有Fe3+,否则不含Fe3+
②CuSO4+Fe===FeSO4+Cu
2CuSO4+2H2O2Cu+O2↑+2H2SO4
2023届新高考化学一轮复习铁、铜及其化合物单元测试含答案: 这是一份2023届新高考化学一轮复习铁、铜及其化合物单元测试含答案,共16页。试卷主要包含了单项选择题,多项选择题,非选择题等内容,欢迎下载使用。
全国通用高考化学一轮复习专练14铁铜及其化合物含答案: 这是一份全国通用高考化学一轮复习专练14铁铜及其化合物含答案
检测卷17 铁铜及其化合物检测卷-2023届高考化学一轮复习考点过关检测卷: 这是一份检测卷17 铁铜及其化合物检测卷-2023届高考化学一轮复习考点过关检测卷,文件包含检测卷17铁铜及其化合物检测卷-2023届高考化学一轮复习考点过关检测卷解析版docx、检测卷17铁铜及其化合物检测卷-2023届高考化学一轮复习考点过关检测卷原卷版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。












