


(通用版)高考化学一轮复习检测01 化学计量在实验中的应用(含答案解析)
展开高考化学复习检测:01
化学计量在实验中的应用
1.实验室里需要使用480 mL 0.10 mol·L-1的硫酸铜溶液,下列实验用品及实验操作正确的是( )

A.标准状况下,22.4 L H2S与22.4 L H2O中所含的分子数均为NA
B.由6.2 g Na2O与7.8 g Na2O2组成的混合物中阴离子总数为0.2NA
C.10 g 49%的硫酸与10 g 49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.0.1 mol Fe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
3.实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液100 mL,造成所配溶液浓度偏低原因是( )
A.暴露在空气中称量碳酸钠晶体(Na2CO3·10H2O)的时间太长
B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C.定容时俯视刻度线
D.洗涤液移至容量瓶中时,洒出一部分
4.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( )
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸
C.配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体
D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
5.设NA为阿伏加德罗常数的值,下列与NA有关的说法正确的是( )
A.在反应KClO3+6HCl===KCl+3Cl2↑+3H2O中,当得到标准状况下67.2 L Cl2时,反应中转移的电子数为6NA
B.6.0 g SiO2晶体中含有的硅氧键数目为0.2NA
C.标准状况下,22.4 L NO和11.2 L O2混合后气体的分子总数为NA
D.S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2NA
A.C2H4和C3H6的混合物的质量为a g,所含碳氢键数目为
B.标准状况下,2.24 L 2H35Cl中所含中子数为1.8NA
C.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子数为2NA
D.相同物质的量的OH-和CH含有相同数目的电子
A.常温下,22 g CO2含碳氧双键数目为2NA
B.12.0 g NaHSO4固体中含阳离子数为0.1NA
C.标准状况下,22.4 L Br2中所含分子数为NA
D.7.8 g Na2O2与足量的水反应转移电子数为0.2NA
A.1 mol Na2O2与SO2完全反应时转移电子数为NA
B.18 g重水(D2O)所含的电子数为10NA
C.0.5 mol NH4HSO4晶体中,含有H+数目约为0.5NA
D.常温常压下,3 g HCHO和CH3COOH的混合物中含有0.4NA个原子
A.温度相同、体积相同的O2和N2
B.压强相同、体积相同的H2和O2
C.质量相等、密度不等的N2和CO
D.体积相等、密度相等的CO和C2H4
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温、同压、同体积的CO和NO含有的原子数
D.等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数
11.利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是( )
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准状况)
D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量
12.将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为( )
A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1
13.标准状况下有以下四种气体:①6.72 L CH4;②3.01×1023个HCl分子;③13.6 g H2S;④0.2 mol NH3。下列关系不正确的是( )
A.体积:④<①<③<②
B.质量:④<①<③<②
C.物质的量:①<②<③<④
D.氢原子数:②<④<③<①
14.下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( )
A.10 g NaOH固体溶解在水中配成250 mL溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.标准状况下,将22.4 L氯化氢气体溶于水配成1 L溶液
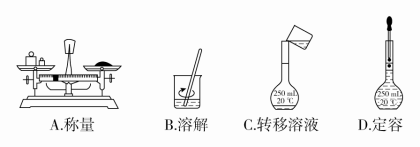
15.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
16.实验室欲用碳酸钠固体配制500 mL 0.10 mol·L-1的Na2CO3溶液,下列叙述正确的是( )
A.实验用到的仪器有:托盘天平、烧杯、500 mL容量瓶、玻璃棒
B.将称量好的固体放入500 mL容量瓶中溶解
C.定容时若俯视刻度,则所得溶液浓度偏高
D.定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线
17.同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同。若相同条件下,A气球放在CO中静止不动,B气球放在O2中上浮。下列叙述或表示正确的是( )
A.X气体的相对分子质量比Y气体的相对分子质量大
B.X可能是N2,Y可能是CH4
C.X气体的密度小于Y气体的密度
D.充气后A气球质量比B气球质量大
18.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1
B.0.2 mol·L-1
C.0.3 mol·L-1
D.0.4 mol·L-1
A.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1
B.100 g硫酸溶液的物质的量浓度为18.4 mol·L-1,用水稀释到物质的量浓度为9.2 mol·L-1,需要水100 g
C.配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀
D.将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液
20.如图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:

该同学的错误步骤有( )
A.1处 B.2处 C.3处 D.4处
21.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
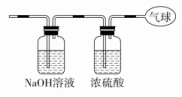
22.现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
23.奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体奶粉样品,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨转化成硫酸铵,再经过碱化蒸馏后,使氨转变为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白质含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.0 mL,则该样品中N的含量为________(保留两位小数)。
已知滴定过程中涉及的反应方程式:
(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3
24.一定质量的液态化合物XY2与标准状况下的一定质量的O2恰好完全反应,化学方程式为XY2(l)+3O2(g)XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g/L,则
(1)反应前O2的体积是________。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和________。(写元素符号)
解析:实验室里需要使用480 mL 0.10 mol·L-1的CuSO4溶液,由于没有规格为480 mL的容量瓶,所以要选择规格是500 mL的容量瓶;溶质若是硫酸铜,则需要8.0 g,若是胆矾则需要12.5 g,应配成500 mL溶液,而不是加入500 mL水。
解析:标准状况下,水为液态,22.4 L H2O的物质的量远大于1 mol,故所含分子数远大于NA,A错误;
Na2O由 Na+和O2-构成,Na2O2由Na+和O构成,6.2 g Na2O与7.8 g Na2O2的物质的量均为0.1 mol,故混合物中阴离子总数为0.2NA,B正确;
H2SO4、H3PO4及溶剂H2O都含有O原子,故两溶液中所含氧原子数远大于0.2NA,C错误;
0.1 mol Fe与足量盐酸反应生成0.1 mol FeCl2,转移0.2NA个电子,0.1 mol Fe与足量Cl2反应生成0.1 mol FeCl3,转移0.3NA个电子,D错误。
解析:称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中,会造成结晶水的挥发,则所称量的晶体中Na2CO3的含量升高,所配溶液的浓度偏高;容量瓶中原有少量蒸馏水,对溶液的浓度无影响;定容时俯视刻度线,会导致溶液体积偏小,浓度偏高;洗涤液移至容量瓶中时,洒出一部分会导致溶质的损失,浓度偏低。
解析:10 mL量筒的精确度为0.1 mL,B错误;
托盘天平的精确度为0.1 g,C错误;
胶头滴管应悬空垂直于容量瓶上方,D错误。
解析:该反应中,KClO3中+5价Cl元素被还原为0价,HCl中-1价Cl元素部分被氧化为0价,故当得到标准状况下67.2 L Cl2(即3 mol)时,反应中转移的电子数为5NA,A错误;
SiO2晶体每个Si原子与周围4个O原子形成Si—O键,6.0 g SiO2的物质的量为0.1 mol,则所含Si—O键的数目为0.4NA,B错误;
标准状况下,22.4 L NO和11.2 L O2混合后反应生成1 mol NO2,由于存在平衡:2NO2N2O4,则所得气体分子总数小于NA,C错误;
6.4 g S2和S8的混合物所含S原子的物质的量为=0.2 mol,则所含硫原子数为0.2NA,D正确。
解析:乙烯与丙烯的最简式都为CH2,所含氢原子的物质的量为×2 mol,含有碳氢键的个数与氢原子的个数相同,都为×NA,A正确;
标准状况下,0.1 mol 2H35Cl含有的中子数为0.1×(1+18)×NA=1.9NA,B错误;
含1 mol H2SO4的浓硫酸与足量铜反应时,实际反应的H2SO4不足1 mol,故转移的电子总数小于2NA,C错误;
1个OH-含有10个电子,1个CH含有8个电子,相同物质的量的OH-和CH中含有的电子数目不同,D错误。
解析:1个CO2分子中含有2个C===O键,22 g CO2为0.5 mol,所含C===O键数目为NA,A错误;
NaHSO4固体中的离子为Na+和HSO,12.0 g NaHSO4为0.1 mol,所含阳离子数为0.1NA,B正确;
标准状况下,Br2为液体,不能用标准状况下的气体摩尔体积进行计算,C错误;
Na2O2与H2O发生反应: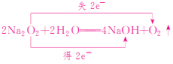 ,7.8 g Na2O2为0.1 mol,与足量水反应转移的电子数为0.1NA,D错误。
,7.8 g Na2O2为0.1 mol,与足量水反应转移的电子数为0.1NA,D错误。
解析:Na2O2+SO2===Na2SO4,1 mol Na2O2完全反应时转移2 mol电子,A错误;
18 g重水(D2O)所含电子的物质的量为×10<10 mol,B错误;
NH4HSO4晶体中,只有阳离子NH和阴离子HSO,不含H+,C错误;
HCHO和CH3COOH的最简式均为CH2O,
故3 g HCHO和CH3COOH的混合物含有的原子为4×=0.4 mol,D正确。
解析:根据阿伏加德罗定律及其推论,同温、同压、同体积、同分子数,三同定一同,A项压强不一定相同,B项温度不一定相同,故两种气体的分子数不一定相等,所含原子数不一定相等,A、B错误;N2和CO的摩尔质量相同,若质量相等,则物质的量相等,二者均为双原子分子,故所含原子数相同,C正确;体积、密度相等,质量相等,两者的摩尔质量相同,则物质的量相同,前者为双原子分子,后者为六原子分子,所含原子数不相等,D错误。
解析:A项,1 mol水(H2O)中含有的中子数是8NA,1 mol 重水(D2O)中含有的中子数是10NA,等物质的量的水与重水含有的中子数不相等;
B项,乙烯、丙烯最简式都是CH2,所以若二者的质量相等,含CH2的个数相等,含有的共用电子对数也相等;
C项,同温同压下,同体积的CO和NO分子数相同,且每个分子均为双原子分子,所以同温同压下,同体积的CO和NO含有的原子数相同;
D项,由于Cl2的氧化性很强,与变价金属Fe反应时生成的是FeCl3,与Al发生反应生成AlCl3,所以等物质的量的铁和铝分别与足量的氯气完全反应转移电子数目相等。
解析:根据方程式2H2O===2H2↑+O2↑,光解0.02 mol水,可产生0.02 mol H2和0.01 mol O2。
则可得:可生成H2的质量为0.04 g,A错误;
可生成氢的原子数为2.408×1022个,B错误;
可生成标准状况下H2的体积为0.448 L,C错误;
0.04 mol Na与水反应产生H2和光解0.02 mol水生成H2理论上均为0.02 mol,D正确。
解析:Na和Al一同投入m g足量水中时,发生反应的化学方程式为2Na+2H2O===2NaOH+H2↑、
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。由于Na、Al的物质的量均为a mol,结合化学方程式可知生成2a mol H2,所得溶液中只有NaAlO2一种溶质,其物质的量为a mol。
所得溶液的质量为m(Na)+m(Al)+m(H2O)-m(H2)=(46a+m) g,
所得溶液的体积为 L,所得溶液的物质的量浓度为 mol·L-1。故本题选A。
解析:①6.72 L CH4的物质的量为=0.3 mol,②3.01×1023个HCl分子的物质的量为
=0.5 mol,③13.6 g H2S的物质的量为=0.4 mol,④0.2 mol NH3。标准状况下体积之比等于其物质的量之比,体积:④<①<③<②,A正确;
CH4的质量为0.3 mol×16 g·mol-1=4.8 g,HCl的质量为0.5 mol×36.5 g·mol-1=18.25 g,NH3的质量为0.2 mol×17 g·mol-1=3.4 g,质量:④<①<③<②,B正确;
物质的量大小顺序为④<①<③<②,C错误;
CH4中n(H)=0.3 mol×4=1.2 mol,HCl中n(H)=0.5 mol,H2S中n(H)=0.4 mol×2=0.8 mol,NH3中n(H)=0.2 mol×3=0.6 mol,氢原子数:②<④<③<①,D正确。
解析:A项,c(NaOH)==1 mol·L-1;
B项,c(H2SO4)==1 mol·L-1;
C项,蒸发掉50 g水后,溶液的体积并不是50 mL,NaNO3的浓度也不是1 mol·L-1;
D项,c(HCl)==1 mol·L-1。
解析:托盘天平的左盘应放物体,右盘应放砝码,A错误;
将溶液转移到容量瓶中时,应用玻璃棒引流,C错误;
定容时,胶头滴管不能伸入容量瓶内部,D错误;B正确。
解析:A项缺少胶头滴管,错误;不能直接在容量瓶中溶解药品,B错误;俯视刻度会造成溶液体积偏小,浓度偏高,C正确;D项操作会使所配制溶液浓度偏低,错误。
解析:A气球放在CO中静止不动,B气球放在O2中上浮,说明X气体的密度和CO的密度接近,Y的密度小于O2,同温同压下,气体密度与摩尔质量成正比,所以X的相对分子质量与CO的相近,大约为28,Y的相对分子质量小于O2,即小于32。但X气体的相对分子质量不一定比Y大,A错误;
N2的相对分子质量为28,CH4的相对分子质量为16,所以X可能是N2,Y可能是CH4,B正确;
X的密度接近CO,但不一定小于Y的密度,C错误;
相同条件下,等体积的两种气体的物质的量相等,因为其摩尔质量相对大小未知,所以无法确定其质量相对大小,D错误。
解析:根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO)+c(OH-),
而溶液中c(OH-)很小,可以忽略不计,则有3c(Al3+)+c(K+)+c(H+)=2c(SO),
所以:c(K+)=2c(SO)-3c(Al3+)-c(H+)
=2×0.8 mol·L-1-3×0.4 mol·L-1-0.1 mol·L-1=0.3 mol·L-1,C正确。
解析:最后溶液的体积不为1 L,A错误;
由c1×=c2×,且ρ1≠ρ2可知,m2≠2m1,B错误;
最后溶液的体积不一定是1000 mL,且不能在容量瓶中溶解物质,C错误。
解析:配制500 mL 0.1 mol·L-1 NaOH溶液需用NaOH的质量为0.5 L×0.1 mol·L-1×40 g·mol-1=2.0 g。步骤①,NaOH固体易潮解,不能直接放在托盘中称量;步骤④,向容量瓶中转移液体时,玻璃棒下端要伸入到刻度线以下;步骤⑤,定容时,不能仰视刻度线,否则结果偏低。
(1)4.0;
(2)0.04;
(3)C;
(4)①4.6 ②250
解析:
(1)由c=得,c(NaClO)=≈4.0(mol·L-1)。
(2)稀释前后溶液中NaClO的物质的量不变,
则有100 mL×10-3 L·mL-1×4.0 mol·L-1=100 mL×100×10-3 L·mL-1×c(NaClO),
解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1。
(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的a、b不需要,但还需玻璃棒和胶头滴管。
选项B,配制过程中需要加入水,所以已经洗涤干净的容量瓶不必烘干后再使用。
选项C,未洗涤烧杯和玻璃棒将导致配制的溶液中溶质的物质的量减小,结果偏低。
选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149.0 g。
(4)①根据H2SO4的组成可知,溶液中c(H+)=2c(H2SO4)=4.6 mol·L-1;
②2000 mL 2.3 mol·L-1的稀硫酸中溶质的物质的量为2 L×2.3 mol·L-1=4.6 mol,
设需要98%(密度为1.84 g·cm-3)的浓硫酸的体积为V mL,
则有:=4.6 mol,解得V=250。
(1)36 g·mol-1
(2)0.4NA
(3)①28 g·mol-1 ②4.48 L ③2.8NA
解析:
(1)混合气体的体积为8.96 L,则其物质的量为n===0.4 mol,混合气体的平均摩尔质量为=36 g·mol-1。
(2)设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol,则根据混合物的质量为14.4 g可得:28x+44y=14.4①;根据气体的物质的量为0.4 mol,所得x+y=0.4②;解①②得:x=0.2 mol,y=0.2 mol;由于CO和CO2分子中均含1个碳原子,故0.2 mol CO和0.2 mol CO2中共含0.4 mol C原子即0.4NA个。
(3)将混合气体依次通过图中装置,则CO2会被NaOH溶液吸收,则在气球中收集到的是干燥纯净的CO气体;①CO摩尔质量为28 g·mol-1;②其体积V=nVm=0.2 mol×22.4 L·mol-1=4.48 L;③一个CO含有14个电子,则电子的物质的量为0.2 mol×14=2.8 mol,电子总数为2.8NA个。
(1)B;
(2)10.73%
解析:
(1)由c=判断A、D操作会使n偏小,浓度偏小;B中俯视刻度线,使V偏小,浓度偏大;C中仰视刻度线,使V偏大,浓度偏小。
(2)n(N)=5n(HCl)=0.0115 mol,该样品中N的含量w=×100%≈10.73%。
(1)672 mL;
(2)76 g/mol;
(3)C S
解析:
(1)由反应XY2(l)+3O2(g)XO2(g)+2YO2(g)可知,反应前后气体的体积变化为0,故V(O2)=672 mL。
(2)由m=ρV,生成物的质量m=0.672 L×2.56 g/L=1.72 g,O2的物质的量:n==0.03 mol,XY2的物质的量为0.01 mol,所以M(XY2)==76 g/mol。
(3)由=,M(X)+2M(Y)=76,解得M(X)=12,M(Y)=32,即X为C,Y为S。
高考化学一轮复习检测:第1章 化学计量在实验中的应用1-2a Word版含解析: 这是一份高考化学一轮复习检测:第1章 化学计量在实验中的应用1-2a Word版含解析,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
高考化学一轮复习检测:第1章 化学计量在实验中的应用1-1a Word版含解析: 这是一份高考化学一轮复习检测:第1章 化学计量在实验中的应用1-1a Word版含解析,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
(通用版)高考化学一轮复习检测19 化学实验(含答案解析): 这是一份(通用版)高考化学一轮复习检测19 化学实验(含答案解析),共12页。试卷主要包含了2 g Na2O与7,82 mL浓盐酸等内容,欢迎下载使用。












