【培优导学案】浙教版科学九年级全册:11、化学计算 学案(含解析)
展开化学计算
【回顾】
1.化学式的计算
(1)分析不同物质的化学式,找出组成元素的质量关系,利用某组成元素的质量分数,可计算混合物中另一种组成元素的质量分数或某物质的质量分数等。
(2)分析不同物质的化学式,找出组成元素间的质量关系,借助极值的方法,可确定混合物中某组成成分的含量范围。
(3)由离子构成的物质,阳离子所带电荷的数量与阴离子所带电荷的数量相等,据此可判断相关微粒间的数量关系。
2.化学方程式的计算
根据化学方程式的计算中,差量法、守恒法和关系式法是常见的方法,现简要介绍如下:
(1)差量法是依据化学反应前后的某些“差量”(固体质量差、溶液质量差、气体体积差等)与反应物或生成物的变化量成正比而建立的一种解题法。本法将“差量”看作化学方程式右端的一项,将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,其他解题步骤与化学方程式列比例式解题完全一致。用差量法解题的关键是正确找出理论差量。
(2)守恒法就是以化学反应过程中存在的某些守恒关系(如元素守恒等)作为依据来解题。运用守恒法解题既可避免书写烦琐的化学方程式,提高解题的速度,又可避免在复杂的解题背景中寻找关系式,提高解题的准确度。
(3)关系式法常常应用于多步进行的连续反应,因前一个反应的产物是后一个反应的反应物,可以根据中间物质的传递关系,找出原料和最终产物的相应关系。它是化学计算中的基本解题方法之一,利用关系式法可以将多步计算转化为一步计算,免去逐步计算中的麻烦,简化解题步骤,减少运算量,且计算结果不易出错,准确率高。
![]()
例1 竞赛试题由NaHS、MgSO4、NaHSO3组成的混合物中,已知硫元素的质量分数w(S)为a%,则氧元素的质量分数w(O)为( )
A.1.75a% B.1-1.75a% C.1.25a% D.无法计算
[答案] B
钠的相对原子质量为23,氢的相对原子质量为1,镁的相对原子质量为24,故一个钠原子与一个氢原子的相对原子质量之和等于一个镁原子的相对原子质量。若用R表示相对质量为24的原子(镁原子)或原子组合(NaH),则NaHS、MgSO4、NaHSO3中R与S的质量比为24∶32=3∶4,根据硫元素的质量分数为a%,所以R的质量分数为0.75a%,所以混合物中氧元素的质量分数为10.75a%=1-1.75a%。
例2 竞赛试题某同学为了探究生石灰(CaO)露置于空气中变质的情况,设计了如图11-1所示的实验。
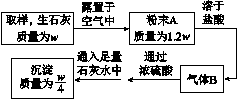
图11-1
请通过计算推断粉末A的成分,并计算粉末A中CaO的质量分数。(提示:氧化钙与水反应生成氢氧化钙,氧化钙与二氧化碳反应生成碳酸钙,二氧化碳使澄清石灰水变浑浊的实质是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,氧化钙、氢氧化钙都能与稀盐酸反应,产物均为氯化钙和水,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳)
[答案] 解:推测粉末A中含有CaCO3,质量为。根据气体B与足量澄清石灰水反应生成碳酸钙的质量为,可知气体B的质量为0.11w。若粉末A由CaCO3、Ca(OH)2和CaO组成,可设转化为Ca(OH)2的CaO质量为x1,转化为CaCO3的CaO质量为x2。
CaO+H2O ===Ca(OH)2 固体增加的质量
56 74 74-56=18
x1
CaO+CO2===CaCO3 固体增加的质量
56 100 100-56=44
x2 0.11w
+0.11w=0.20w x1=0.28w
= x2=0.14w
故变质的CaO的质量为0.28w+0.14w=0.42w。
A中未变质的CaO的质量为w-0.42w=0.58w。
A中CaO的质量分数为×100%≈48.3%。
答:粉末A中有CaO、Ca(OH)2和CaCO3,CaO的质量分数为48.3%。
例3 温州自主招生模拟某探究小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应过程中溶液紫色消失快慢的方法探究影响反应速率的因素。实验条件做如下限定:所用酸性KMnO4溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量为0.5 g、实验温度为298 K,每次实验酸性KMnO4溶液的用量均为4 mL,H2C2O4溶液(0.1 mol·L-1)的用量均为2 mL。某同学用两种不同浓度的酸性KMnO4溶液进行实验(其他条件相同),测得如下表所示的实验数据(从混合振荡均匀开始计时)。则实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为(忽略混合前后溶液的体积变化)( )
实验编号 | 溶液褪色所需时间/min | ||
第1次 | 第2次 | 第3次 | |
Ⅰ | 14 | 13 | 11 |
Ⅱ | 6 | 7 | 7 |
A.1.0×10-4 mol·L-1·min-1
B.1.0×10-3 mol·L-1·min-1
C.1.5×10-4 mol·L-1·min-1
D.无法计算
[答案] A
计算出高锰酸钾的浓度和三次平均时间,再根据v=计算。
反应开始时:
c(KMnO4)=≈0.00067 mol·L-1,
反应时间:
Δt=≈6.7 min,
KMnO4的平均反应速率:v(KMnO4)===1×10-4 mol·L-1·min-1。
![]()
1.在19世纪,化学家对氧化锆的化学式有争议。经测定,锆的相对原子质量为91,其氯化物的相对分子质量为233。若氧化锆中锆的化合价与氯化物中的相同,试判断氧化锆的化学式为( )
A.ZrO2 B.Zr2O C.Zr2O3 D.ZrO
2.由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物5 g,将其投入适量的稀硫酸中恰好完全反应,所得溶液中溶质的质量为( )
A.6 g B.12 g C.18 g D.24 g
3.在Na2SO4、NaCl、NaNO3的混合溶液中,含有Na+、SO42-、Cl-、NO3-,已知其中Na+、SO42-、NO3-的个数比为8∶1∶2,则溶液中Na2SO4、NaCl、NaNO3的“分子”个数比为( )
A.1∶1∶1 B.1∶4∶2
C.1∶2∶4 D.1∶3∶2
4.(多选)已知FeO、Fe2O3、Fe3O4组成的混合物中,铁元素与氧元素的质量比为21∶8,则混合物中FeO、Fe2O3、Fe3O4三种物质的质量比可以是( )
A.9∶20∶5 B.18∶40∶33
C.2∶5∶3 D.5∶6∶3
5.竞赛试题喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组成为:C占69.0%、O占18.4%,且O含量为H的4倍,其余为N,则一个喜树碱分子中含有的原子总数为( )
A.42 B.43 C.44 D.45
6.等物质的量的下列物质充分燃烧生成二氧化碳和水,所消耗的氧气量相同的是( )
A.C6H6和C5H10 B.C4H8和C5H10
C.C4H8和C6H6 D.C6H6和C6H12O6
7.温州自主招生模拟将一定量的CuS和Cu2S的混合物投入足量的硝酸中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g。若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为( )
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
8.(多选)已知2NaAl(OH)4+CO2===2Al(OH)3↓+Na2CO3+H2O。向含2 mol NaOH、1 mol Ba(OH)2、2 mol NaAl(OH)4的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是( )
选项 | A | B | C | D |
n(CO2)/mol | 2 | 3 | 4 | 6 |
n(沉淀)/mol | 1 | 2 | 3 | 3 |
9.(多选)把碳和氧化铜组成的混合物隔绝空气加热,充分反应后称量所得剩余固体的质量为112 g,向此剩余固体中加入200 g稀硫酸,稀硫酸恰好被完全反应,过滤后所得滤渣呈红色。同时将反应所得的气体全部通入含溶质37 g的澄清石灰水中,得到沉淀25 g。下列有关说法正确的是( )
A.生成气体的质量可能是11 g或33 g
B.滤渣中的红色物质可能是32 g或96 g
C.参与反应的氧化铜质量可能是40 g或120 g
D.稀硫酸的溶质质量可能是38.4 g或115.2 g
10.同学们利用如图11-2所示装置,对质量守恒定律进行了探究,实验结束后,老师另外提出了几个问题,请你一起参与思考。

图11-2
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是__________(填“A”“B”或“A和B”)。
(2)若图乙装置内Na2CO3溶液的质量为5 g,滴入试管的稀盐酸质量也是5 g,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22 g,向试管中滴加紫色石蕊试液变红,根据上述已知条件,通过分析可以确定的是______(填序号)。
①原稀盐酸的溶质质量分数
②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数
④反应后试管中NaCl的质量分数
请你选择所填的其中一项,通过计算确定其结果。
11.现有16 g Fe2O3和CuO的混合物,进行如下实验:把混合物全部加入到100 g足量的硫酸中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图11-3所示,回答下列问题。
(1)写出上述实验过程中可能发生反应的化学方程式。
(2)当a=25时,求CuO的质量。
(3)求所用硫酸中溶质的质量分数。
(4)求a的取值范围。
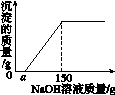
图11-3
答案
1.A 氯元素的化合价为-1,设氯化锆的化学式为ZrCln,则氯化锆的相对分子质量为91+35.5n=233,解得n=4,即氯化锆的化学式为ZrCl4,所以锆元素的化合价为+4,氧元素的化合价为-2,根据化合物中正负化合价的代数和为零,所以氧化锆的化学式为ZrO2。
2.B 因Mg(OH)2+H2SO4===MgSO4+2H2O,MgO+H2SO4===MgSO4+H2O,混合物恰好完全反应,则混合物中镁元素的质量等于MgSO4中镁元素的质量,
设反应后溶液中溶质MgSO4的质量为x,则
Mg ~ MgSO4
24 120
5 g×48% x
=
计算得出x=12 g。
3.B 设混合溶液中钠离子的数目为8N,则硫酸根离子的数目为N,硝酸根离子的数目为2N。设该溶液中氯离子的数目为xN,根据溶液中电荷守恒,有8N-N×2-2N-xN=0,解得x=4。溶液中Na2SO4、NaCl、NaNO3的“分子”个数比为硫酸根离子、氯离子和硝酸根离子的数目之比, 即1∶4∶2。
4.AB FeO、Fe2O3、Fe3O4中铁元素与氧元素的质量比依次为56∶16,112∶48,168∶ 64=21∶8。因 Fe3O4中铁元素和氧元素的质量比为21∶8,则任意量都可满足混合物中铁、氧元素的质量之比为21∶8;FeO和Fe2O3“叠加”可写成Fe3O4,即它们的“分子”个数的比应保持在1∶1,即质量比为9∶20时,两种物质的混合物中铁元素和氧元素的质量比也恰好为21∶8。
5.A 6.A 7.A
8.AC 反应的先后顺序为①Ba2++2OH-+CO2===BaCO3↓+H2O、②2OH-+CO2===CO32-+H2O、③2Al(OH)4-+CO2===2Al(OH)3↓+CO32-+H2O、④CO32-+CO2+H2O===2HCO3-、⑤BaCO3+CO2+H2O===Ba2++2HCO3-。则当通入2 mol CO2时,生成1 mol 碳酸钡沉淀;当通入3 mol CO2时,生成1 mol 碳酸钡沉淀和2 mol氢氧化铝沉淀,共计是 3 mol;当通入 4 mol CO2时,生成1 mol碳酸钡沉淀和2 mol氢氧化铝沉淀,共计是3 mol;当通入6 mol CO2时,只有2 mol氢氧化铝沉淀。
9.ABC
10.(1)B
(2)②④
解:设Na2CO3溶液中溶质质量为x,生成NaCl的质量为y。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 117 44
x y 0.22 g
= x=0.53 g
= y=0.585 g
原Na2CO3溶液的溶质质量分数为:×100%=10.6%,
反应后试管中NaCl的质量分数为:×100%≈5.98%。
答:原Na2CO3溶液的溶质质量分数为10.6%;反应后试管中NaCl的质量分数为5.98%。
(1)A中反应产物五氧化二磷是固体,不会使气球胀大,B中反应产物氢气是气体,可以使气球胀大。(2)向试管中滴加紫色石蕊试液变红,说明溶液显酸性,碳酸钠全部反应完,氢氧化钠溶液增加的质量即为反应生成的二氧化碳的质量,据此可以得出反应消耗的碳酸钠的质量和生成的氯化钠的质量,从而计算出原碳酸钠溶液的溶质质量分数和反应后试管中氯化钠的质量分数,根据已知条件,不能计算出稀盐酸的溶质质量分数和原氢氧化钠溶液的溶质质量分数。
11.(1)Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
CuO+H2SO4===CuSO4+H2O
Fe2(SO4)3+6NaOH===2Fe(OH)3↓+3Na2SO4
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
H2SO4+2NaOH===Na2SO4+2H2O
解:(2)设含有Fe2O3的质量为x,CuO的质量为y。由化学方程式得:
Fe2O3~6NaOH CuO~2NaOH
160 240 80 80
x 1.5x y y
解得x=y=8 g。
(3)设100 g硫酸中含H2SO4的质量为z。
由化学方程式得:
H2SO4~Na2SO4~2NaOH
98 80
z 150 g×16%
= z=29.4 g
硫酸中溶质的质量分数为:×100%=29.4%。
(4)若16 g混合物全是Fe2O3,设需NaOH的质量为m。
由化学方程式得关系式:
Fe2O3~6NaOH
160 240
16 g m
= m=24 g
NaOH溶液质量==150 g,此时a=0;
若16 g混合物全是CuO,设需NaOH的质量为n。由化学方程式得关系式:
CuO~2NaOH
80 80
16 g n
= n=16 g
NaOH溶液质量==100 g,此时a=50;
故0<a<50。
答:(2)当a=25时,CuO的质量为8 g;(3)所用硫酸中溶质的质量分数为29.4%;(4)a的取值范围是0<a<50。
【培优导学案】浙教版科学九年级全册:9、有机物 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:9、有机物 学案(含解析),共8页。
【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析),共8页。
【培优导学案】浙教版科学九年级全册:21、遗传与进化 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:21、遗传与进化 学案(含解析),共8页。