


所属成套资源:2023-2024学年高中化学人教版(2019)选择性必修一学案
- 2023-2024学年-高中化学人教版(2019)选择性必修一第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 试卷 试卷 2 次下载
- 2023-2024学年-高中化学人教版(2019)选择性必修一第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 试卷 试卷 2 次下载
- 2023-2024学年-高中化学人教版(2019)选择性必修一第三章第二节 水的电离和溶液pH(学案)(含答案) 试卷 1 次下载
- 2023-2024学年-高中化学人教版(2019)选择性必修一实验活动 4 简单的电镀实验(学案)- 试卷 0 次下载
- 2023-2024学年-高中化学人教版(2019)选择性必修一实验活动5 制作简单的燃料电池(学案)(含答案) 试卷 1 次下载
高中化学人教版 (2019)选择性必修1第一节 电离平衡练习
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡练习,共10页。试卷主要包含了从电离,了解电离平衡常数的含义,能利用电离平衡常数进行相关计算等内容,欢迎下载使用。
第三章 水溶液中的离子反应与平衡 第一节 电离平衡 ![]() 1、从电离、离子反应和化学平衡的角度认识电解质水溶液的组成、性质和反应。2、认识弱电解质在水溶液中存在电离平衡。3、了解电离平衡常数的含义。4、能用化学用语表示弱电解质水溶液中的电离平衡;能从电离的角度分析溶液的导电性。5、能利用电离平衡常数进行相关计算。
1、从电离、离子反应和化学平衡的角度认识电解质水溶液的组成、性质和反应。2、认识弱电解质在水溶液中存在电离平衡。3、了解电离平衡常数的含义。4、能用化学用语表示弱电解质水溶液中的电离平衡;能从电离的角度分析溶液的导电性。5、能利用电离平衡常数进行相关计算。![]() 1、重点:强、弱电解质的概念和弱电解质的电离平衡。2、难点:弱电解质的电离平衡。
1、重点:强、弱电解质的概念和弱电解质的电离平衡。2、难点:弱电解质的电离平衡。![]() 电解质和非电解质 定义种类本质区别相同点电解质在水溶液里或熔融状态下能够导电的化合物酸、碱、盐活泼金属氧化物和水等在水溶液里或熔融状态下自身能否发生电离均为化合物非电解质在水溶液里和熔融状态下都不能导电的化合物多数有机化合物、非金属氧化物(水除外)和氨等
电解质和非电解质 定义种类本质区别相同点电解质在水溶液里或熔融状态下能够导电的化合物酸、碱、盐活泼金属氧化物和水等在水溶液里或熔融状态下自身能否发生电离均为化合物非电解质在水溶液里和熔融状态下都不能导电的化合物多数有机化合物、非金属氧化物(水除外)和氨等![]() 一、强电解质和弱电解质【实验探究】酸0.1mol/L盐酸0.1mol/L醋酸pH1>1导电能力强较强与镁条反应的装置
一、强电解质和弱电解质【实验探究】酸0.1mol/L盐酸0.1mol/L醋酸pH1>1导电能力强较强与镁条反应的装置 实验现象剧烈反应,产生大量气泡反应平缓,产生少量气泡实验结论①Mg与盐酸的反应速率大,而与相同物质的量浓度的醋酸的反应速率小,表明相同物质的量浓度时盐酸中的c(H+)较大,说明在水溶液中,HCl易电离,CH3COOH较难电离;②由相同物质的量浓度的盐酸与醋酸的pH、导电能力及与活泼金属反应的剧烈程度知,在稀溶液中,HCl完全电离,CH3COOH部分电离。1、根据电解质在水溶液中是否全部电离,可把电解质分为强电解质和弱电解质。2、强电解质:在水溶液中能够全部电离的电解质称为强电解质。3、弱电解质:在水溶液中只有部分电离的电解质称为弱电解质。4、常见的强电解质有强酸、强碱、绝大多数的盐。常见弱电解质有弱酸、弱碱、极少数的盐[Pb(Ac)2]、水。二、弱电解质的电离1、电离方程式(1)电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程叫电离。(2)电离方程式:表示电解质在水溶液中或熔融状态下电离成能够自由移动的离子式子叫做电离方程式。2、电离方程式的书写(1)强电解质:完全电离,不可逆过程,只有电离出的离子,不存在电解质分子,用“ == ”。如:
实验现象剧烈反应,产生大量气泡反应平缓,产生少量气泡实验结论①Mg与盐酸的反应速率大,而与相同物质的量浓度的醋酸的反应速率小,表明相同物质的量浓度时盐酸中的c(H+)较大,说明在水溶液中,HCl易电离,CH3COOH较难电离;②由相同物质的量浓度的盐酸与醋酸的pH、导电能力及与活泼金属反应的剧烈程度知,在稀溶液中,HCl完全电离,CH3COOH部分电离。1、根据电解质在水溶液中是否全部电离,可把电解质分为强电解质和弱电解质。2、强电解质:在水溶液中能够全部电离的电解质称为强电解质。3、弱电解质:在水溶液中只有部分电离的电解质称为弱电解质。4、常见的强电解质有强酸、强碱、绝大多数的盐。常见弱电解质有弱酸、弱碱、极少数的盐[Pb(Ac)2]、水。二、弱电解质的电离1、电离方程式(1)电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程叫电离。(2)电离方程式:表示电解质在水溶液中或熔融状态下电离成能够自由移动的离子式子叫做电离方程式。2、电离方程式的书写(1)强电解质:完全电离,不可逆过程,只有电离出的离子,不存在电解质分子,用“ == ”。如:![]() ;
;![]() (2)弱电解质:部分电离,可逆过程,既有电离出的离子,又存在电解质分子,用“
(2)弱电解质:部分电离,可逆过程,既有电离出的离子,又存在电解质分子,用“![]() ”。如:
”。如:![]() ;
;![]() 3、电离平衡(1)电离平衡的建立以CH3COOH的电离过程为例: c(CH3COOH)c(CH3COO-)c(H+)CH3COOH溶于水时最大00达到平衡前减小增大增大达到平衡时不变不变不变(2)电离平衡
3、电离平衡(1)电离平衡的建立以CH3COOH的电离过程为例: c(CH3COOH)c(CH3COO-)c(H+)CH3COOH溶于水时最大00达到平衡前减小增大增大达到平衡时不变不变不变(2)电离平衡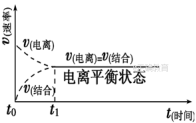 在一定条件下,当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡状态。(3)电离平衡的特征
在一定条件下,当弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡状态。(3)电离平衡的特征 (4)电离平衡的影响因素①内因:电解质本身的性质决定了弱电解质在水中达到电离平衡时电离程度的大小。②外因A.温度:一般情况下,由于弱电解质的电离过程吸热,因此升高温度,电离平衡向电离方向移动,电离程度增大。B.浓度:同一弱电解质,增大溶液的浓度,电离平衡向电离方向移动,但电离程度减小;稀释溶液时,电离平衡向电离方向移动,且电离程度增大,但往往会使溶液中离子的浓度减小。C.加入其他试剂a.同离子效应:增大(或减小)弱电解质电离出的某离子的浓度,可抑制(或促进)弱电解质电离。如:向CH3COOH溶液中加入CH3COONa固体,增大了c(CH3COO-),电离平衡逆向移动,电离程度减小。b.加入能与弱电解质电离出的离子反应的物质:电离平衡向电离方向移动,电离程度增大。如:向CH3COOH溶液中加入NaOH固体,因H+与OH-反应生成H2O,使c(H+)减小,平衡向电离方向移动,电离程度增大。三、电离常数1、概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对一元弱酸或元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数叫做电离平衡常数,简称电离常数。弱酸、弱碱的电离常数通常分别用Ka、Kb表示。2、表达方式
(4)电离平衡的影响因素①内因:电解质本身的性质决定了弱电解质在水中达到电离平衡时电离程度的大小。②外因A.温度:一般情况下,由于弱电解质的电离过程吸热,因此升高温度,电离平衡向电离方向移动,电离程度增大。B.浓度:同一弱电解质,增大溶液的浓度,电离平衡向电离方向移动,但电离程度减小;稀释溶液时,电离平衡向电离方向移动,且电离程度增大,但往往会使溶液中离子的浓度减小。C.加入其他试剂a.同离子效应:增大(或减小)弱电解质电离出的某离子的浓度,可抑制(或促进)弱电解质电离。如:向CH3COOH溶液中加入CH3COONa固体,增大了c(CH3COO-),电离平衡逆向移动,电离程度减小。b.加入能与弱电解质电离出的离子反应的物质:电离平衡向电离方向移动,电离程度增大。如:向CH3COOH溶液中加入NaOH固体,因H+与OH-反应生成H2O,使c(H+)减小,平衡向电离方向移动,电离程度增大。三、电离常数1、概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对一元弱酸或元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数叫做电离平衡常数,简称电离常数。弱酸、弱碱的电离常数通常分别用Ka、Kb表示。2、表达方式![]()
 (1)一元弱酸、一元弱碱的电离常数
(1)一元弱酸、一元弱碱的电离常数![]()
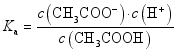
![]()
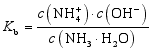 (2)多元弱酸、多元弱碱的电离常数多元弱酸的电离分步进行,各步的电离常数通常分别用Ka1、Ka2、Ka3等来表示。一般多元弱酸各步电离常数的大小为Ka1≫Ka2≫Ka33、影响因素①电离平衡常数只与温度有关,升高温度,K值增大。②在相同条件下,弱酸的电离常数越大,酸性越强。③多元弱酸的各级电离常数的大小关系是K1≫K2,所以其酸性决定于第一步电离。4、意义CH3COOH的Ka和H2CO3的Ka1的大小比较
(2)多元弱酸、多元弱碱的电离常数多元弱酸的电离分步进行,各步的电离常数通常分别用Ka1、Ka2、Ka3等来表示。一般多元弱酸各步电离常数的大小为Ka1≫Ka2≫Ka33、影响因素①电离平衡常数只与温度有关,升高温度,K值增大。②在相同条件下,弱酸的电离常数越大,酸性越强。③多元弱酸的各级电离常数的大小关系是K1≫K2,所以其酸性决定于第一步电离。4、意义CH3COOH的Ka和H2CO3的Ka1的大小比较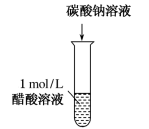 实验操作向盛有2 mL 1mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液实验现象有气泡产生原理反应生成了CO2,化学方程式为2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑结论CH3COOH的酸性比H2CO3的强,Ka(CH3COOH)>Kal(H2CO3)四、电离度
实验操作向盛有2 mL 1mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液实验现象有气泡产生原理反应生成了CO2,化学方程式为2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑结论CH3COOH的酸性比H2CO3的强,Ka(CH3COOH)>Kal(H2CO3)四、电离度
![]() 1.下列叙述中,正确的是( )A.
1.下列叙述中,正确的是( )A.![]() 固体不导电,所以
固体不导电,所以![]() 不是电解质B.铜丝、石墨均能导电,所以它们都是电解质C.
不是电解质B.铜丝、石墨均能导电,所以它们都是电解质C.![]() 溶于水能导电,所以
溶于水能导电,所以![]() 是电解质D.熔融的KCl能导电,所以KCl是电解质2.下列可以证明某一元酸是弱电解质的是( )A.1 mol/L的某一元酸溶液中
是电解质D.熔融的KCl能导电,所以KCl是电解质2.下列可以证明某一元酸是弱电解质的是( )A.1 mol/L的某一元酸溶液中![]() 约为
约为![]() B.某一元酸能与水以任意比例互溶C.10 mL 1 mol/L的某一元酸溶液恰好与10 mL 1 mol/L的NaOH溶液完全反应D.在相同条件下,某一元酸溶液的导电性比硫酸的弱3.下列电离方程式的书写正确的是( )A.熔融状态下
B.某一元酸能与水以任意比例互溶C.10 mL 1 mol/L的某一元酸溶液恰好与10 mL 1 mol/L的NaOH溶液完全反应D.在相同条件下,某一元酸溶液的导电性比硫酸的弱3.下列电离方程式的书写正确的是( )A.熔融状态下![]() 的电离:
的电离:![]() B.
B.![]() 的电离:
的电离:![]() C.
C.![]() 的电离:
的电离:![]() D.水溶液中
D.水溶液中![]() 的电离:
的电离:![]() 4.在0.1
4.在0.1![]() 的
的![]() 溶液中,要促进醋酸电离且使
溶液中,要促进醋酸电离且使![]() 浓度增大,应采取的措施是( )A.升温 B.加水 C.加入NaOH溶液 D.加入稀盐酸5.在0.1
浓度增大,应采取的措施是( )A.升温 B.加水 C.加入NaOH溶液 D.加入稀盐酸5.在0.1![]() 的HCN溶液中存在如下电离平衡:
的HCN溶液中存在如下电离平衡:![]() ,下列叙述正确的是( )A.加入少量NaOH固体,平衡正向移动
,下列叙述正确的是( )A.加入少量NaOH固体,平衡正向移动
B.加水,平衡逆向移动
C.滴加少量0.1 ![]() 的HCl溶液,溶液中
的HCl溶液,溶液中![]() 减小
减小
D.加入少量NaCN固体,平衡正向移动6.0.10![]() HA溶液中有1%的HA电离,则HA的电离平衡常数
HA溶液中有1%的HA电离,则HA的电离平衡常数![]() 为( )A.
为( )A.![]() B.
B.![]() C.
C.![]() D.
D.![]() 7.将10 mL 0.1
7.将10 mL 0.1![]() 的氨水加蒸馏水稀释到1 L后,下列变化正确的是( )①
的氨水加蒸馏水稀释到1 L后,下列变化正确的是( )①![]() 的电离程度增大②
的电离程度增大②![]() 增大③
增大③![]() 的数目增多④
的数目增多④![]() 增大⑤导电性增强⑥
增大⑤导电性增强⑥![]() 增大A.仅①②③ B.仅①③⑤ C.仅①③⑥ D.仅②④⑥
增大A.仅①②③ B.仅①③⑤ C.仅①③⑥ D.仅②④⑥ ![]() 1.答案:D解析:硝酸钠在水溶液中和熔融状态下都能导电,属于电解质,A错误;铜丝和石墨都是单质,既不是电解质也不是非电解质,B错误;二氧化硫本身不能电离产生自由移动的离子,是非电解质,C错误;熔融的KCl能导电,且氯化钾为化合物,所以KCl是电解质,D正确。2.答案:A解析:A项,1 mol/L的某一元酸溶液中
1.答案:D解析:硝酸钠在水溶液中和熔融状态下都能导电,属于电解质,A错误;铜丝和石墨都是单质,既不是电解质也不是非电解质,B错误;二氧化硫本身不能电离产生自由移动的离子,是非电解质,C错误;熔融的KCl能导电,且氯化钾为化合物,所以KCl是电解质,D正确。2.答案:A解析:A项,1 mol/L的某一元酸溶液中![]() 约为
约为![]() ,说明该酸不能完全电离,故是弱电解质,正确;B项,溶解性与电解质强弱无关,错误;C项,完全反应与酸的强弱无关,不能证明该酸为弱电解质,错误;D项,温度相同时,相同浓度的某一元酸和硫酸溶液,硫酸是二元酸,而该酸为一元酸,不能根据某一元酸溶液的导电性比硫酸的弱而判断该酸为弱电解质,错误。3.答案:C解析:熔融状态下
,说明该酸不能完全电离,故是弱电解质,正确;B项,溶解性与电解质强弱无关,错误;C项,完全反应与酸的强弱无关,不能证明该酸为弱电解质,错误;D项,温度相同时,相同浓度的某一元酸和硫酸溶液,硫酸是二元酸,而该酸为一元酸,不能根据某一元酸溶液的导电性比硫酸的弱而判断该酸为弱电解质,错误。3.答案:C解析:熔融状态下![]() 的电离方程式为
的电离方程式为![]() ,水溶液中
,水溶液中![]() 的电离方程式为
的电离方程式为![]() ,A、D项错误;
,A、D项错误;![]() 为二元弱酸,不能完全电离,且多元弱酸的电离分步进行,以第一步为主,B项错误;
为二元弱酸,不能完全电离,且多元弱酸的电离分步进行,以第一步为主,B项错误;![]() 是多元弱碱,电离方程式一步写成,C项正确。4.答案:A解析:醋酸的电离是吸热过程,升高温度能促进醋酸的电离,且
是多元弱碱,电离方程式一步写成,C项正确。4.答案:A解析:醋酸的电离是吸热过程,升高温度能促进醋酸的电离,且![]() 浓度增大,故A项正确;加水能促进醋酸的电离,但
浓度增大,故A项正确;加水能促进醋酸的电离,但![]() 减小,故B项错误;加入氢氧化钠溶液,
减小,故B项错误;加入氢氧化钠溶液,![]() 和
和![]() 反应生成水,能促进醋酸的电离,但
反应生成水,能促进醋酸的电离,但![]() 浓度减小,故C项错误;加入稀盐酸,
浓度减小,故C项错误;加入稀盐酸,![]() 浓度增大,但抑制醋酸的电离,故D项错误。5.答案:A解析:加入NaOH固体,
浓度增大,但抑制醋酸的电离,故D项错误。5.答案:A解析:加入NaOH固体,![]() 与HCN电离产生的
与HCN电离产生的![]() 反应,平衡正向移动,A项正确;加水,平衡正向移动,B项错误;滴加少量0.1
反应,平衡正向移动,A项正确;加水,平衡正向移动,B项错误;滴加少量0.1![]() 的HCl溶液,
的HCl溶液,![]() 增大,C项错误;加入少量 NaCN固体,
增大,C项错误;加入少量 NaCN固体,![]() 增大,平衡逆向移动,D项错误。6.答案:A解析:发生电离的HA的物质的量浓度为
增大,平衡逆向移动,D项错误。6.答案:A解析:发生电离的HA的物质的量浓度为![]() ,根据
,根据![]() ,则平衡时
,则平衡时![]() ,
, ![]() ,将有关数据代入电离平衡常数表达式得
,将有关数据代入电离平衡常数表达式得![]() 。7.答案:C解析:氨水加水稀释,
。7.答案:C解析:氨水加水稀释,![]() 的电离程度增大,则
的电离程度增大,则![]() 减小,
减小,![]() 的数目增多,①③正确,②错误;溶液中
的数目增多,①③正确,②错误;溶液中![]() 增大,但
增大,但![]() 减小,④错误;溶液稀释时
减小,④错误;溶液稀释时![]() 和
和![]() 均减小,溶液的导电性减弱,⑤错误;根据
均减小,溶液的导电性减弱,⑤错误;根据![]() ,得
,得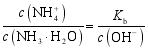 ,由于温度不变,
,由于温度不变,![]() 不变,而
不变,而![]() 减小,则
减小,则![]() 增大,⑥正确。
增大,⑥正确。
相关试卷
这是一份选择性必修1第一节 电离平衡精品第二课时练习题,共8页。试卷主要包含了下列关于电离常数的说法正确的是,已知下面三个数据,2×10-4,常温下,将冰醋酸加水稀释成0等内容,欢迎下载使用。
这是一份高中第三章 水溶液中的离子反应与平衡第一节 电离平衡优秀第一课时练习,共7页。试卷主要包含了下列叙述正确的是,下列电离方程式中,书写正确的是,1ml/L醋酸的pH约为3,把0,某浓度的氨水中存在下列平衡等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 电离平衡巩固练习,共7页。试卷主要包含了1 电离平衡同步练习题,2×10−4、4,01,3×10-3等内容,欢迎下载使用。









