

- 1.1 反应热(第2课时 热化学反应方程式 燃烧热)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
- 1.2 反应热的计算-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
- 2.1 化学反应速率(第1课时 化学反应速率及影响因素)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
- 2.1 化学反应速率(第2课时 活化能 催化剂)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
- 2.2 化学平衡(第1课时 化学平衡状态 化学平衡常数)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
1.1 反应热(第1课时 反应热 焓变)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1)
展开第一章 第一节 反应热
第1课时 反应热 焓变
【学习目标】
1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2.结合真实情境中的应用实例,能从多角度认识放热反应和吸热反应。认识化学反应中能量变化在生活、生产中的应用。
3.能运用反应焓变合理选择和利用化学反应。
【素养目标】
1.能从宏观和微观相结合的视角分析化学反应中的能量变化。培养学生“宏观辨识与微观探析”的学科素养。
2.知道化学变化需要一定的条件,并遵循一定规律;认识化学变化的本质是有新物质生成,并伴有能量的转化。培养学生“变化观念与平衡思想”的学科素养。
3.通过建立节约资源、保护环境的可持续发展意识。从自身做起,形成简约适度、绿色低碳的生活方式。培养学生“科学态度与社会责任”的学科素养。
必备知识与关键能力
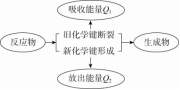
知识点一:反应热 焓变
1.化学反应的实质与特征
(1)实质:反应物中化学键的断裂和生成物中化学键的形成。
(2)特征:既有物质变化,又伴有能量变化,后者通常主要表现为热量的变化。
2.反应热与焓变
(1)反应热
①反应热是指在等温条件下,化学反应体系向环境释放或从环境吸收的能量,称为化学反应的热效应,简称反应热。
②反应热产生的原因是化学反应前后体系内能(U)发生变化。
③内能量是体系内物质的各种能量总和,受温度、压强和物质的聚集状态等影响。
(2)焓变
①焓:与物质内能有关的物理量,符号为H。
②焓变:在等压条件下进行的化学反应的反应热。符号为ΔH,单位:kJ/mol或kJ·mol-1。
③定义式:ΔH=H生成物-H反应物
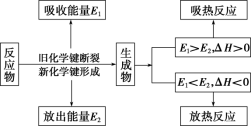
3.吸热反应与放热反应
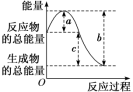
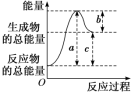
(1)从焓(或能量)的高低角度理解(宏观角度)

| 放热反应 | 吸热反应 |
图示 |
|
|
能量高低 | 反应物的总能量大于生成物的总能量,ΔH<0 | 反应物的总能量小于生成物的总能量,ΔH>0 |
说明 | ①a表示断裂旧化学键吸收的能量,也可以表示反应的活化能。 ②b表示形成新化学键放出的能量,也可以表示活化分子结合成生成物分子所释放的能量。 ③c表示反应的反应热。 | |
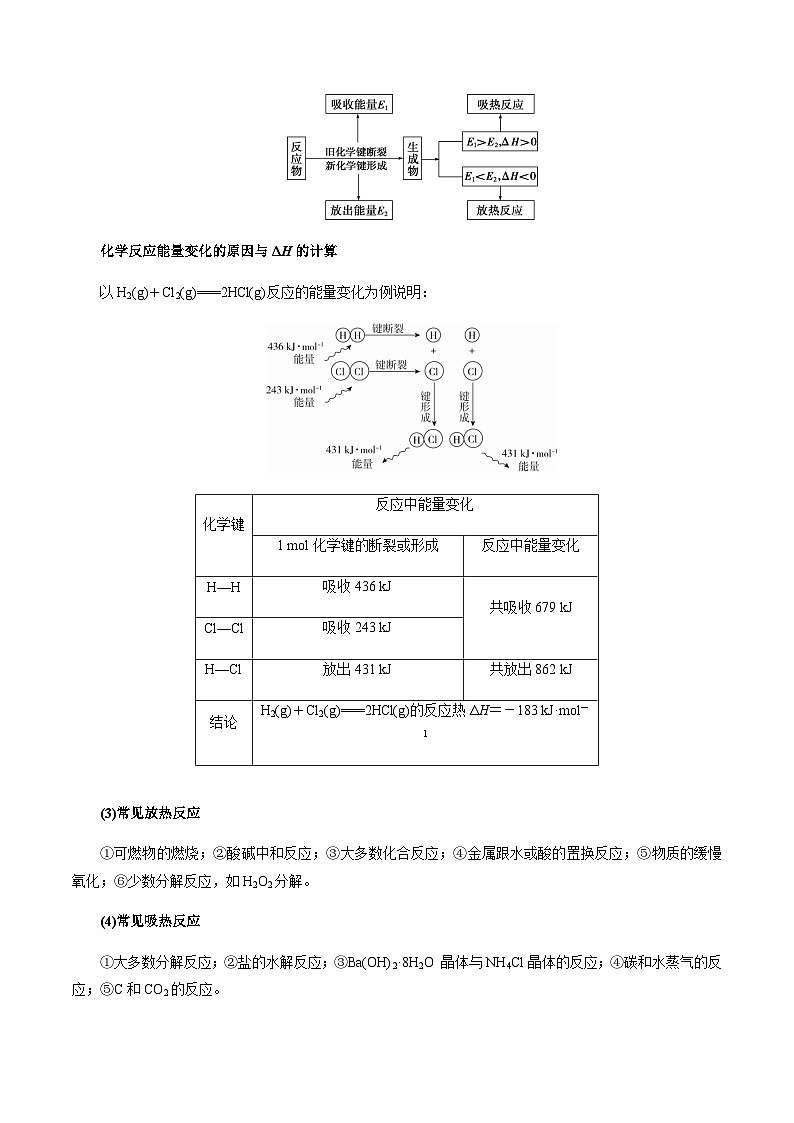
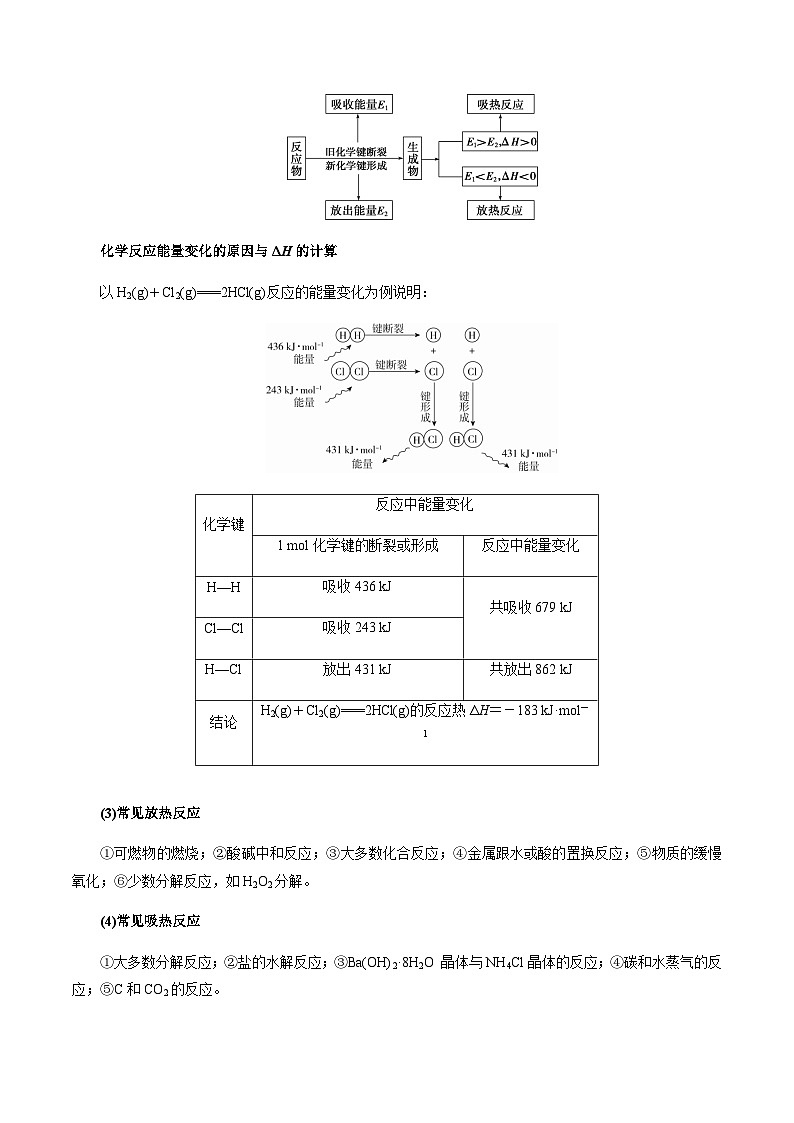
(2)从化学键角度理解(微观角度)
化学反应能量变化的原因与ΔH的计算
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明:
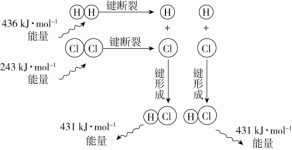
化学键 | 反应中能量变化 | |
1 mol化学键的断裂或形成 | 反应中能量变化 | |
H—H | 吸收436 kJ | 共吸收679 kJ |
Cl—Cl | 吸收243 kJ | |
H—Cl | 放出431 kJ | 共放出862 kJ |
结论 | H2(g)+Cl2(g)===2HCl(g)的反应热ΔH=-183 kJ·mol-1 | |
(3)常见放热反应
①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟水或酸的置换反应;⑤物质的缓慢氧化;⑥少数分解反应,如H2O2分解。
(4)常见吸热反应
①大多数分解反应;②盐的水解反应;③Ba(OH)2·8H2O 晶体与NH4Cl晶体的反应;④碳和水蒸气的反应;⑤C和CO2的反应。
【点拨】(1)物质发生化学反应一定伴随着能量变化,但伴随能量变化的物质变化不一定都是化学变化。如水蒸气变成液态水的过程放热,但该变化为物理变化。
(2)化学反应的能量变化主要表现为热量变化,但并不完全是热量变化,还有光能、电能等。
(3) 化学反应是放热还是吸热与反应发生的条件(如是否加热)没有必然的联系,如Ba(OH)2·8H2O晶体与NH4Cl晶体在常温常压下即可发生反应,该反应是吸热反应。 (4)破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高。
(5)形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低。
【思维建模】 ΔH的三种基本公式
(1)ΔH=反应物总键能之和-生成物总键能之和。
(2)ΔH=生成物总能量-反应物总能量=H(生成物)-H(反应物)。
(3)ΔH=正反应活化能-逆反应活化能。
【点拨】常见物质(1 mol)中化学键数目
物质 | CO2 (C==O) | CH4 (C—H) | P4 (P—P) | SiO2 (Si—O) | 石墨 | 金刚石 | S8 (S—S) | Si |
键数 | 2 | 4 | 6 | 4 | 1.5 | 2 | 8 | 2 |
典例1.焓是与物质内能有关的物理量。一定压强下,下列有关焓或焓变的说法错误的是( )
A.物质状态发生变化时,物质的焓也发生变化
B.等量的硫单质的焓:S(s)<S(l)<S(g)
C.吸热反应中产物的焓高于反应物的焓
D.化学键断裂时焓值一定增大,同时会伴随化学反应的发生
【答案】D
【解析】焓是与物质内能有关的物理量,与物质的状态有关,物质状态发生变化时,物质的焓也发生变化,A正确;等量的同种物质的能量按气、液、固的顺序依次减小,则等量的硫单质的焓:S(s)< S(l)<S(g),B正确;反应物的总能量小于生成物的总能量时,该反应为吸热反应,则吸热反应中产物的焓高于反应物的焓,C正确;化学反应的实质是旧键的断裂和新键的形成,化学键断裂时,物质的总能量增大,焓值一定增大,但只有旧化学键的断裂,没有新化学键的形成时,不会发生化学反应,D错误。
典例2.下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
【答案】C
【解析】焓变单位中的kJ·mol-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量,成键时放出能量,所以D错。
典例3.根据键能数据计算CH4(g)+4F2(g) ===CF4(g)+4HF(g)的反应热ΔH为( )
化学键 | C—H | C—F | H—F | F—F |
键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
A.-1 940 kJ·mol-1 B.+1 940 kJ·mol-1
C.-485 kJ·mol-1 D.+485 kJ·mol-1
【答案】A
【解析】由“ΔH=反应物键能之和-生成物键能之和”可知:ΔH=(414×4+155×4-489×4-565×4) kJ·mol-1=-1 940 kJ·mol-1。
知识点二:中和反应反应热的测定(以稀盐酸与稀NaOH溶液反应为例)
1.测定原理
通过一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得中和热。热量计算公式为Q=cmΔt(c为比热容,m为溶液质量,Δt为前后温度差)。
2.实验仪器装置
①简易量热计 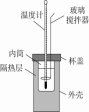
②实验过程中,还需要的其他仪器有50 mL量筒(2个)。
3.实验步骤与数据测量
①反应前体系的温度(t1)
测量方法是用一个量筒量取50 mL 0.50 mol·L-1盐酸,倒入量热计的内筒中并测量其温度;用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液并用已用蒸馏水洗净的温度计测量其温度,取两温度平均值为t1。
②反应后体系的温度(t2)
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为t2。
③重复上述步骤①至步骤②两次。
④实验数据处理
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm-3,反应后溶液的比热容c=4.18 J/(g·℃)。该实验中盐酸和NaOH溶液反应放出的热量是0.418(t2-t1) kJ,中和反应生成1 mol水时放出的热量为 kJ。
4.实验关键和注意事项实验
(1)实验关键
①迅速反应,防止热量散失。②在测量反应混合液的温度时要随时读取温度值,记录下最高温度值
(2) 注意事项
①实验中要用强酸、强碱的稀溶液(0.1~0.5 mol·L-1)。
②操作时动作要快,尽量减少热量的损失,使用绝热装置,避免热量散发到反应体系外。
③测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果。
④测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低。
⑤中和热的数值是57.3 kJ·mol-1,测定时与强酸、强碱的用量无关。
5.中和反应反应热测定实验中产生误差的原因
①装置方面:装置的隔热保温效果不好,造成实验过程中热量损失而引起误差。
②操作方面
③读数方面
典例4.关于中和反应反应热的测定实验,下列说法正确的是( )
A.为了使反应进行得更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和反应反应热测定的实验结果与所用酸、碱的用量和种类均无关
D.用铜丝代替玻璃搅拌棒,会使中和反应反应热的测定值偏大
【答案】A
【解析】为了使反应进行得更完全,可以使酸或碱适当过量,A正确;向酸(碱)中分次加入碱(酸),会导致热量损失较多,使实验误差过大,B不正确;中和反应反应热测定的实验结果与所用酸、碱的用量无关,但是与所用酸、碱的种类有关,C不正确;用铜丝代替玻璃搅拌棒,铜丝是热的良导体,造成热量散失过多,会使中和反应反应热的测定值偏小,D不正确。
典例5.下列有关中和热的说法正确的是( )
A.中和热的热化学方程式:H+(l)+OH-(l)===H2O(l) ΔH=-57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需测定温度4次
C.玻璃搅拌器材料若用铜代替,则测量出的中和热数值偏小
D.若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确
【答案】C
【解析】A项,H+和OH-不能用l符号,应该用aq,错误;B项,每次实验中需要测量NaOH溶液的温度,盐酸的温度,和反应后的温度,一般实验要重复操作,所以至少6次,错误;C项,铜容易导热,使热量损失,所以测量的中和热数值偏小,正确;D项,当酸和碱中的H+和OH-物质的量相等时,实验过程中稍有误差就不能确定产生水的量,一般都是有一种物质稍微过量,错误。
![]() 典例6.某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和反应反应热的测定。实验装置如图所示。
典例6.某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和反应反应热的测定。实验装置如图所示。
(1)仪器a的名称是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0 ℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,实验后所得溶液的比热容c=4.18 J/(g·℃)。 则计算得ΔH= (取小数点后一位)。
(3)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】(1)环形玻璃搅拌棒 (2) -53.5 kJ/mol (3)acd
【解析】(1)仪器a的名称是环形玻璃搅拌棒。(2)ΔH=-![]() kJ/mol≈-53.5 kJ/mol。
kJ/mol≈-53.5 kJ/mol。
(3) -57.3 kJ/mol<-53.5 kJ/mol,则ΔH偏大。a项,实验装置保温、隔热效果差,则温差偏小,ΔH偏大;b项,用量筒量取NaOH溶液的体积时仰视刻度线读数,NaOH溶液体积偏大,释放的热量偏多,ΔH偏小;c项,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,在加入过程中导致热量损失,ΔH偏大;d项,用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,因温度计上附着的NaOH溶液与硫酸反应放热,导致硫酸的起始温度偏高,最终温度差值偏小,ΔH偏大。
核心价值与学科素养
【知识结构化】
化学反应能量变化的原因:
(1)宏观角度认识 (2)微观角度认识
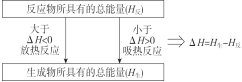
典例7.如图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )

A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
【答案】B
【解析】NH4NO3溶于水时,由于扩散过程中吸收的热量大于水合过程中放出的热量,表现为溶液温度降低。CaO溶于水时,与水反应放出大量的热,而导致杯内食物温度上升。MgCl2、NaCl溶于水时,由于扩散过程中吸收的热量约等于水合过程中放出的热量,表现为溶液温度基本不变。
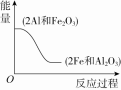
典例8.铝热反应是以铝粉和氧化铁为主要反应物的放热反应。当温度超过1 250 ℃时,铝粉剧烈氧化,燃烧而放出大量热。这种放热反应的温度可达3 000 ℃以上。铝热反应非常迅速,作用时间短。加入硅铁粉时,可使作用缓和,利于延长作用的时间。为用于浇注温度为1 000~1 100 ℃左右的铜合金铸件,可再加少量氧化剂,如硝酸钠、硝酸钾等;还可加入镁作为点火剂,使其在较低温度下发生化学反应。该反应经常用于焊接钢轨,冶炼金属。

(1)阅读材料思考,该反应是吸热反应还是放热反应?放热反应是否不需要加热就能发生呢?
。
(2)写出铝与氧化铁反应的方程式,并用图示表示反应物与生成物能量的相对大小。
。
【解析】(1)铝热反应为放热反应,但是该反应需要在高温下引发,因此放热反应有时也需要加热才能发生。
(2)2Al+Fe2O3Al2O3+2Fe。
图示:
【跟踪练习】 基础过关
1. 反应X+Y===M+N的能量变化关系如图所示。下列关于该反应的说法中,正确的是( )
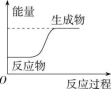
A.断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量
B.X、Y的总能量一定低于M、N的总能量
C.因为该反应为吸热反应,故一定要加热才可发生
D.X的能量一定低于M的,Y的能量一定低于N的
2. 下图表示H2和Br2反应的历程,其中虚线表示的是使用催化剂的反应历程,下列说法正确的是( )
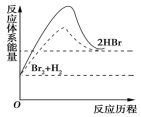
A.正反应为吸热反应
B.正反应为放热反应
C.加入催化剂,该化学反应的反应热增大
D.从图中可以看出,该反应的反应热与反应途径有关
3. 单斜硫和正交硫是硫的两种同素异形体,下列说法正确的是( )
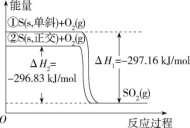
A.S(s,单斜) === S(s,正交) ΔH3=-0.33 kJ/mol
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含的能量高
D.由①可知断裂1 mol O2和1 mol单斜硫中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ
4. 化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
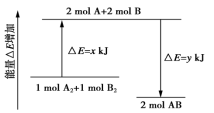
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
5. 用一定浓度的NaOH溶液与稀盐酸进行中和反应反应热的测定实验时,测得生成1 mol液态水时的ΔH>-57.3 kJ·mol-1,产生这种偏差的原因不可能是( )
A.实验用NaOH溶液的浓度过大
B.实验时搅拌速度慢
C.分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中
D.用量取完稀盐酸的量筒直接量取氢氧化钠溶液
能力达成
6. 下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是( )

A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)===SO2(g) ΔH1 S(s)+O2(g)===SO2(g) ΔH2 则ΔH1>ΔH2
D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
7. 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能;P—P键键能为198 kJ·mol-1、P—O键键能为360 kJ·mol-1、氧气分子内氧原子间的键能为498 kJ·mol-1,则P4(s)+3O2(g) === P4O6(s)的反应热ΔH为( )
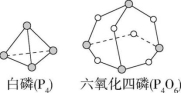
A.+1 638 kJ·mol-1 B.-1 638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
8.用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
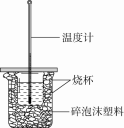
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(3)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”“偏小”或“无影响”)。