





所属成套资源:2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1)
- 2.2 化学平衡(第1课时 化学平衡状态 化学平衡常数)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
- 2.2 化学平衡(第2课时 影响化学平衡的因素)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
- 2.4 化学反应的调控-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
- 3.1 电离平衡(第1课时 弱电解质的电离平衡)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
- 3.1 电离平衡(第2课时 电离平衡常数)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
2.3 化学反应的方向-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1)
展开
第二章 第三节 化学反应的方向【学习目标】1.了解自发过程和化学反应的自发性。2.通过“有序”和“无序”的对比,了解熵和熵变的概念。3.初步了解焓变和熵变对化学反应进行方向的影响,能用焓变和熵变解释化学反应进行的方向。【素养目标】1.通过实例计算,加深对吉布斯自由能公式的灵活应用,注重归纳形成知识网络。培养学生“证据推理与模型认知”的学科素养。2.利用火柴的有序排列到散落时的无序排列联想到事物有趋向于最大混乱度的倾向。培养学生“变化观念与平衡思想”的学科素养。3.利用公式判断反应能否自发进行,对于研究化学反应有事半功倍的作用。培养学生“科学态度与社会责任”的学科素养。必备知识与关键能力知识点一:自发过程与自发反应1.自发过程与自发反应 自发过程自发反应含义在一定条件下,不需要借助外力就能自发进行的过程在给定的条件下,可以自发进行到显著程度的化学反应特征具有方向性,即某个方向在一定条件下是自发的,而其逆方向在该条件下肯定是不能自发进行的举例高山流水,自由落体运动钢铁生锈应用(1)可被用来完成有用功,如水力发电(2)可用来实现化学能转化为电能,如H2燃烧可设计成原电池(3)非自发过程要想发生,必须对它做功。如通电将水分解为H2和O2 2.自发过程的特点(1) 自发过程具有方向性,如果某个方向的反应在一定条件下是自发的,则其逆方向的反应在该条件下肯定不自发,如铁器暴露于潮湿的空气中会生锈是自发的,而铁锈变为铁在该条件下肯定不是自发的。(2) 想使非自发过程发生,则必须对它做功,如利用水泵可把水从低处升到高处,通电可将水分解生成氢气和氧气。3.自发过程和自发反应的应用自发过程和自发反应的应用可被用来做有用功。如向下流动的水可推动机器,锌与硫酸铜溶液的反应可被设计成原电池,可根据氢气的燃烧反应设计成燃料电池。【点拨】过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。如涂有防锈漆和未涂防锈漆的钢制容器,其发生腐蚀过程的自发性是相同的,但只有后者可以实现。典例1.下列过程均为自发过程的是( )①铵盐的溶解②烧碱与盐酸反应③Zn与稀硫酸反应④氢气在氧气中燃烧⑤Mg在空气中燃烧⑥铝热反应⑦墨水在水中扩散⑧电解熔融的氯化钠A.①②③④ B.⑤⑥⑦⑧C.②④⑥⑧ D.①②③④⑤⑥⑦【答案】D【解析】自发过程是不借助外力就能自动发生的过程,而电解熔融的氯化钠要在直流电作用下进行。典例2. 研究化学反应的方向具有重要意义,下列说法正确的是( )A.电解水的反应属于自发反应B.能自发进行的反应一定能迅速发生C.自发反应的熵一定增大,非自发反应的熵一定减小 D.2NO(g)+2CO(g) == N2(g)+2CO2(g) 在常温下能自发进行,则该反应的ΔH < 0【答案】D【解析】电解水的反应属于非自发反应,A错误;能自发进行的反应不一定能迅速发生,B错误;自发反应有熵减的,非自发反应有熵增的,C错误;2NO(g)+2CO(g)==N2(g)+2CO2(g)是一个熵减的反应,常温下要自发一定是放热反应,ΔH < 0,D正确。知识点二:熵和熵变(1)熵是量度体系混乱程度的物理量,符号为S。(2)影响熵大小的因素:①相同条件下,物质不同熵不同。②同一物质:S(g)S(l)S(s)。(3)熵变(ΔS)=生成物的总熵-反应物的总熵。【点拨】熵增(ΔS>0)的常见反应①固态反应物生成液态或气态生成物的反应:C(s)+H2O(g)CO(g)+H2(g)。②液态反应物生成气态生成物的反应:如:2Na+2H2O===2NaOH+H2↑。③化学计量数增大的反应:2N2O5(g)===4NO2(g)+O2(g)。典例3.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不能自发进行的是( )A.2O3(g)===3O2(g) ΔH<0B.2CO(g)===2C(s)+O2(g) ΔH>0C.N2(g)+3H2(g)![]() 2NH3(g) ΔH<0D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0【答案】B【解析】 A项,是一个ΔH<0,ΔS>0的反应,一定能自发进行;B项,是一个ΔH>0,ΔS<0的反应,一定不能自发进行;C项,是一个ΔH<0,ΔS<0的反应,低温条件下可自发进行;D项,是一个ΔH>0,ΔS>0的反应,高温条件下可自发进行。典例4.下列说法完全正确的是A.自发进行的反应均是放热反应 B.ΔS为正值的反应均能自发进行C.物质的量增加的反应,ΔS为正值D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0【答案】D【解析】有些吸热反应也可以自发进行,如(NH4)2CO3(s)===NH4HCO3(s)+NH3(g),故A错;熵变与反应的自发性有关,但不能独立地作为反应是否自发的判据,故B错;物质的量增加的反应,其混乱度不一定增加,即ΔS不一定为正值,如2H2S(g)+O2(g)===2H2O(l)+2S(s),故C错;CaCO3(s)的分解产生了气体,为熵增加反应,故D正确。知识点三 :如何判断化学反应能否自发进行1.焓判据化学反应能否自发进行与吸热、放热的关系(1)多数放热反应是自发进行的例如 燃烧: H2(g)+O2(g)===H2O(l) ΔH=-286 kJ/mol,中和反应:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol(2)有些吸热反应(ΔH>0)也是自发的。例如:(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ/mol综上所述,单独使用焓判据是不全面的。2.熵判据熵变与反应方向的关系(1)许多熵增的反应是自发的。例如:固+固气:2KClO32KCl+3O2↑;固+液―→气:CaCO3+2HCl===CaCl2+H2O+CO2↑等。(2)有些熵减的反应也可以自发进行。例如:Ca(OH)2(aq)+CO2(g)===CaCO3(s)+H2O(l)综上所述,单独使用熵判据也是不全面的。3.复合判据ΔG=ΔH-TΔS体系的自由能变化(符号为ΔG,单位为kJ/mol)综合考虑了焓变和熵变对体系的影响,可用作化学反应自身进行的判据,ΔG=ΔH-TΔS。(1)当ΔH<0,ΔS>0时,反应自发进行;(2)当ΔH>0,ΔS<0时,反应不能自发进行;(3)当ΔH>0,ΔS>0,或ΔH<0,ΔS<0时,反应是否自发进行与温度有关,一般低温时焓变影响为主,高温时熵变影响为主。
2NH3(g) ΔH<0D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0【答案】B【解析】 A项,是一个ΔH<0,ΔS>0的反应,一定能自发进行;B项,是一个ΔH>0,ΔS<0的反应,一定不能自发进行;C项,是一个ΔH<0,ΔS<0的反应,低温条件下可自发进行;D项,是一个ΔH>0,ΔS>0的反应,高温条件下可自发进行。典例4.下列说法完全正确的是A.自发进行的反应均是放热反应 B.ΔS为正值的反应均能自发进行C.物质的量增加的反应,ΔS为正值D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0【答案】D【解析】有些吸热反应也可以自发进行,如(NH4)2CO3(s)===NH4HCO3(s)+NH3(g),故A错;熵变与反应的自发性有关,但不能独立地作为反应是否自发的判据,故B错;物质的量增加的反应,其混乱度不一定增加,即ΔS不一定为正值,如2H2S(g)+O2(g)===2H2O(l)+2S(s),故C错;CaCO3(s)的分解产生了气体,为熵增加反应,故D正确。知识点三 :如何判断化学反应能否自发进行1.焓判据化学反应能否自发进行与吸热、放热的关系(1)多数放热反应是自发进行的例如 燃烧: H2(g)+O2(g)===H2O(l) ΔH=-286 kJ/mol,中和反应:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol(2)有些吸热反应(ΔH>0)也是自发的。例如:(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ/mol综上所述,单独使用焓判据是不全面的。2.熵判据熵变与反应方向的关系(1)许多熵增的反应是自发的。例如:固+固气:2KClO32KCl+3O2↑;固+液―→气:CaCO3+2HCl===CaCl2+H2O+CO2↑等。(2)有些熵减的反应也可以自发进行。例如:Ca(OH)2(aq)+CO2(g)===CaCO3(s)+H2O(l)综上所述,单独使用熵判据也是不全面的。3.复合判据ΔG=ΔH-TΔS体系的自由能变化(符号为ΔG,单位为kJ/mol)综合考虑了焓变和熵变对体系的影响,可用作化学反应自身进行的判据,ΔG=ΔH-TΔS。(1)当ΔH<0,ΔS>0时,反应自发进行;(2)当ΔH>0,ΔS<0时,反应不能自发进行;(3)当ΔH>0,ΔS>0,或ΔH<0,ΔS<0时,反应是否自发进行与温度有关,一般低温时焓变影响为主,高温时熵变影响为主。 【点拨】1.焓和熵的变化都只取决于体系的始态和终态,与变化的途径无关。2.复合判据只适用于判断恒温、恒压下的反应能否自发进行,不适用于判断其他条件下的反应能否自发进行。3.反应的自发性只能用于判断反应的方向性,反应能否实现,还要看具体条件。过程的自发性只是一种趋势,如高处的水有流下的趋势,但未必会流下。典例5.分析下列反应在任何温度下均能自发进行的是( )A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1B.Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1C.HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1D.H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1【答案】D【解析】对于A项,ΔH>0,ΔS<0,ΔH-TΔS>0,即任何温度下,反应都不能自发进行;对于B项,ΔH<0,ΔS<0,在较低温度下,ΔH-TΔS<0,即反应温度不能过高;对于C项,ΔH>0,ΔS>0,若使反应自发进行,即ΔH-TΔS<0,必须在较高温度时才能自发进行;对于D项,ΔH<0,ΔS>0,在任何温度下,ΔH-TΔS<0,即在任何温度下反应均能自发进行。典例6.在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是 ( )
【点拨】1.焓和熵的变化都只取决于体系的始态和终态,与变化的途径无关。2.复合判据只适用于判断恒温、恒压下的反应能否自发进行,不适用于判断其他条件下的反应能否自发进行。3.反应的自发性只能用于判断反应的方向性,反应能否实现,还要看具体条件。过程的自发性只是一种趋势,如高处的水有流下的趋势,但未必会流下。典例5.分析下列反应在任何温度下均能自发进行的是( )A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1B.Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1C.HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1D.H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1【答案】D【解析】对于A项,ΔH>0,ΔS<0,ΔH-TΔS>0,即任何温度下,反应都不能自发进行;对于B项,ΔH<0,ΔS<0,在较低温度下,ΔH-TΔS<0,即反应温度不能过高;对于C项,ΔH>0,ΔS>0,若使反应自发进行,即ΔH-TΔS<0,必须在较高温度时才能自发进行;对于D项,ΔH<0,ΔS>0,在任何温度下,ΔH-TΔS<0,即在任何温度下反应均能自发进行。典例6.在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是 ( )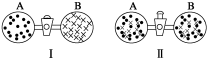 理想气体的自发混合A.此过程是从混乱程度小的状态向混乱程度大的状态变化过程,即熵增大的过程B.此过程为自发过程,而且没有热量的吸收或放出C.此过程从有序到无序,混乱度增大D.此过程是自发可逆的【答案】D【解析】根据题意ΔH=0,ΔS>0,由ΔH-TΔS推知该过程能自发进行,气体扩散为熵增过程,而其逆过程不能自发进行。核心价值与学科素养“吉布斯自由能减少原理(principle of Gibbs free energy reduce)”或“自由能判据”属于热力学的内容,而热力学的一切结论主要建立在两个经验定律(热力学第一定律和热力学第二定律)的基础上,其研究的对象为大量分子构成的宏观体系,所得的结论具有统计意义,特点是只考虑大量分子的集合体的宏观行为,不考虑物质的微观结构和反应机理,以及变化所需要的时间。宏观上的转化方向,才是我们说的“自发”,而不是微观上的分子同时在解离和分解,就可以说它们都是自发的。而实际上,对于可逆的化学反应来说,正反应方向与逆反应方向哪个反应速率更大,宏观上就是向哪个方向自发反应的。若在一定温度和压强下,有状态A、B和C,状态A:2 mol SO2与1 mol O2混合状态B:SO2、O2、SO3(各种原子数与状态A的相同)状态C:2 mol SO3(1)状态A、B和C之间的转化,哪个是自发的? 。(2)状态A、B和C的自由能有什么大小关系? 。 【答案】 (1)状态A到状态B是自发的,状态C到状态B也是自发的。(2)自发过程ΔG<0,则自由能G(A)>G(B)、G(C)>G(B)。 【跟踪练习】 基础过关1. 研究化学反应的方向具有重要意义,下列说法正确的是( )A.电解水的反应属于自发反应B.能自发进行的反应一定能迅速发生C.自发反应的熵一定增大,非自发反应的熵一定减小 D.2NO(g)+2CO(g) == N2(g)+2CO2(g) 在常温下能自发进行,则该反应的ΔH < 02. 在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是 ( )
理想气体的自发混合A.此过程是从混乱程度小的状态向混乱程度大的状态变化过程,即熵增大的过程B.此过程为自发过程,而且没有热量的吸收或放出C.此过程从有序到无序,混乱度增大D.此过程是自发可逆的【答案】D【解析】根据题意ΔH=0,ΔS>0,由ΔH-TΔS推知该过程能自发进行,气体扩散为熵增过程,而其逆过程不能自发进行。核心价值与学科素养“吉布斯自由能减少原理(principle of Gibbs free energy reduce)”或“自由能判据”属于热力学的内容,而热力学的一切结论主要建立在两个经验定律(热力学第一定律和热力学第二定律)的基础上,其研究的对象为大量分子构成的宏观体系,所得的结论具有统计意义,特点是只考虑大量分子的集合体的宏观行为,不考虑物质的微观结构和反应机理,以及变化所需要的时间。宏观上的转化方向,才是我们说的“自发”,而不是微观上的分子同时在解离和分解,就可以说它们都是自发的。而实际上,对于可逆的化学反应来说,正反应方向与逆反应方向哪个反应速率更大,宏观上就是向哪个方向自发反应的。若在一定温度和压强下,有状态A、B和C,状态A:2 mol SO2与1 mol O2混合状态B:SO2、O2、SO3(各种原子数与状态A的相同)状态C:2 mol SO3(1)状态A、B和C之间的转化,哪个是自发的? 。(2)状态A、B和C的自由能有什么大小关系? 。 【答案】 (1)状态A到状态B是自发的,状态C到状态B也是自发的。(2)自发过程ΔG<0,则自由能G(A)>G(B)、G(C)>G(B)。 【跟踪练习】 基础过关1. 研究化学反应的方向具有重要意义,下列说法正确的是( )A.电解水的反应属于自发反应B.能自发进行的反应一定能迅速发生C.自发反应的熵一定增大,非自发反应的熵一定减小 D.2NO(g)+2CO(g) == N2(g)+2CO2(g) 在常温下能自发进行,则该反应的ΔH < 02. 在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是 ( ) 理想气体的自发混合A.此过程是从混乱程度小的状态向混乱程度大的状态变化过程,即熵增大的过程B.此过程为自发过程,而且没有热量的吸收或放出C.此过程从有序到无序,混乱度增大D.此过程是自发可逆的3. 汽车尾气(含烃类、CO、NO与SO2等),是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1、 ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )A.该反应中反应物的总能量高于生成物的总能量B.该反应常温下不能自发进行,因此需要高温和催化剂C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒4.下列关于自发过程的叙述中,正确的是A.只有不需要任何条件就能够自动进行的过程才是自发过程B.需要加热才能够进行的过程肯定不是自发过程C.同一可逆反应的正、逆反应在不同条件下都有自发的可能D.非自发过程在任何条件下都不可能变为自发过程5. 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它能使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)===N2(g)+2CO2(g)。由此可知,下列说法中正确的是( )A.该反应是熵增大的反应B.该反应不能自发进行,因此需要合适的催化剂C.该反应常温下能自发进行,催化剂条件只是加快反应的速率D.该反应常温下能自发进行,因为正反应是吸热反应折 能力达成6. 下列内容与原因或结论不对应的是( )选项内容原因或结论AH2O(g)变成H2O(l)该过程ΔS>0B硝酸铵溶于水可自发进行因为ΔS>0C一个反应的ΔH>0、ΔS<0该反应不能自发进行DH2(g)+F2(g)2HF(g)的ΔH=-271 kJ·mol-1、ΔS=+8 J·mol-1·K-1该反应在任何温度下均可自发进行7. 回答下列问题:(1)催化剂在一定条件下可直接光催化分解CO2,发生反应:2CO2(g)===2CO(g)+O2(g),该反应的ΔH________(填“>”“<”,下同)0,ΔS________0,在低温下,该反应________(填“能”或“不能”)自发进行。(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO2CO2+N2。反应在常温下能够自发进行,则反应的ΔH______(填“>”“<”)0。(3)已知在100 kPa、298 K时石灰石分解反应CaCO3(s)===CaO(s)+CO2(g)的ΔH>0、ΔS>0。①常温下,该反应______(填“能”或“不能”)自发进行。②据本题反应数据分析,温度______(填“能”或“不能”)成为反应进行方向的决定因素。(4)已知CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是____________。(5)某吸热反应能自发进行,则该反应的ΔS________(填“>”“<”)0。
理想气体的自发混合A.此过程是从混乱程度小的状态向混乱程度大的状态变化过程,即熵增大的过程B.此过程为自发过程,而且没有热量的吸收或放出C.此过程从有序到无序,混乱度增大D.此过程是自发可逆的3. 汽车尾气(含烃类、CO、NO与SO2等),是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1、 ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )A.该反应中反应物的总能量高于生成物的总能量B.该反应常温下不能自发进行,因此需要高温和催化剂C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒4.下列关于自发过程的叙述中,正确的是A.只有不需要任何条件就能够自动进行的过程才是自发过程B.需要加热才能够进行的过程肯定不是自发过程C.同一可逆反应的正、逆反应在不同条件下都有自发的可能D.非自发过程在任何条件下都不可能变为自发过程5. 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它能使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)===N2(g)+2CO2(g)。由此可知,下列说法中正确的是( )A.该反应是熵增大的反应B.该反应不能自发进行,因此需要合适的催化剂C.该反应常温下能自发进行,催化剂条件只是加快反应的速率D.该反应常温下能自发进行,因为正反应是吸热反应折 能力达成6. 下列内容与原因或结论不对应的是( )选项内容原因或结论AH2O(g)变成H2O(l)该过程ΔS>0B硝酸铵溶于水可自发进行因为ΔS>0C一个反应的ΔH>0、ΔS<0该反应不能自发进行DH2(g)+F2(g)2HF(g)的ΔH=-271 kJ·mol-1、ΔS=+8 J·mol-1·K-1该反应在任何温度下均可自发进行7. 回答下列问题:(1)催化剂在一定条件下可直接光催化分解CO2,发生反应:2CO2(g)===2CO(g)+O2(g),该反应的ΔH________(填“>”“<”,下同)0,ΔS________0,在低温下,该反应________(填“能”或“不能”)自发进行。(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO2CO2+N2。反应在常温下能够自发进行,则反应的ΔH______(填“>”“<”)0。(3)已知在100 kPa、298 K时石灰石分解反应CaCO3(s)===CaO(s)+CO2(g)的ΔH>0、ΔS>0。①常温下,该反应______(填“能”或“不能”)自发进行。②据本题反应数据分析,温度______(填“能”或“不能”)成为反应进行方向的决定因素。(4)已知CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是____________。(5)某吸热反应能自发进行,则该反应的ΔS________(填“>”“<”)0。






