





所属成套资源:2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1)
- 3.4 沉淀溶解平衡(第2课时 沉淀溶解平衡的应用)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
- 4.1 原电池(第1课时 原电池的工作原理)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
- 4.1 原电池(第2课时 化学电源)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
- 4.2 电解池(第2课时 电解原理的应用)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 0 次下载
- 4.3 金属的腐蚀与防护-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1) 其他 1 次下载
4.2 电解池(第1课时 电解原理)-2023-2024学年高二化学同步素养目标精品讲义(人教版选择性必修1)
展开
第四章 第二节 电解池第1课时 电解原理【学习目标】1.认识化学能与电能相互转化的实际意义及其重要应用。2.了解电解池的工作原理,认识电解在实现物质转化和能量储存中的具体应用。【素养目标】1.通过从宏观和微观的角度理解电解池中电子的移动,阴阳离子的移动、阴阳两极上的反应及其变化,电流形成的过程和原理。培养学生“宏观辨识与微观探析”的学科素养。2.通过建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解的产物,会书写电解的电极反应式和总反应式。培养学生“证据推理与模型认知”的学科素养。必备知识与关键能力知识点一:电解原理1.电解使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。2.电解装置——电解池(1)概念:将电能转变为化学能的装置。(2)构成条件①两个电极:阳极——与电源正极连接;阴极——与电源负极连接。②电解质溶液或熔融电解质。③直流电源。④构成闭合回路。示例探究(电解CuCl2溶液)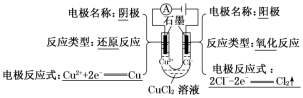 总反应方程式:CuCl2 Cu+Cl2↑。总反应离子方程式:Cu2++2Cl-Cu+Cl2↑。(3)电解池工作原理①电解:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。在此过程中,电能转化为化学能。②电解池:电能转化为化学能的装置,其构成条件:a.外接电源;b.电极插入电解质溶液或熔融电解质;c.闭合回路。③电解池工作原理示意图
总反应方程式:CuCl2 Cu+Cl2↑。总反应离子方程式:Cu2++2Cl-Cu+Cl2↑。(3)电解池工作原理①电解:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。在此过程中,电能转化为化学能。②电解池:电能转化为化学能的装置,其构成条件:a.外接电源;b.电极插入电解质溶液或熔融电解质;c.闭合回路。③电解池工作原理示意图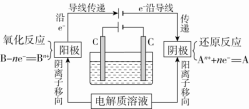 ④电解池的阴极、阳极的判断方法
④电解池的阴极、阳极的判断方法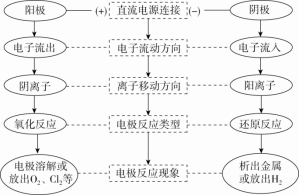 【点拨】①电子流向:电源负极→阴极,阳极→电源正极②离子移动方向:阳离子移向阴极,阴离子移向阳极③电流闭合:电源正极→阳极→溶液→阴极→电源负极3.电极上离子放电顺序(1)阴极:与电极材料无关。氧化性强的先放电,放电顺序:(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。若是惰性电极作阳极,放电顺序:①放电指的是电极上的得、失电子。②活性电极指的是除去Au、Pt以外的金属,惰性电极指的是Pt、Au、C电极,不参与电极反应。③阴极材料若为金属电极,一般是增强导电性但不参与反应。【点拨】(1)电解时必须使用直流电源,不能使用交流电源。(2)常见的惰性电极指石墨、铂(Pt)、金(Au),活性电极是指金属活动性顺序中Ag和Ag之前的金属。(3)电解过程是化学变化,而金属的导电是物理变化;书写电解总反应式要注明“电解”或“通电”这一反应条件。(4)原电池装置和电解池装置的最大区别是看有无外接直流电源,有外接直流电源的是电解池。(5)解答电解类题目时首先判断阳极材料,确定是活性电极还是惰性电极,若为活性电极,则电极材料本身失去电子生成金属阳离子,而溶液中所有阴离子不再放电;若为惰性电极,则按电解质溶液中阴离子的放电顺序放电。 典例1.下列关于电解池工作原理的说法中,错误的是( )A.一种将电能转变成化学能的装置 B.电解池中阳极与直流电源的正极相连C.电解池工作时,阳极发生氧化反应,阴极发生还原反应D.与原电池不同,电解池放电时,电极本身不会参加电极反应【答案】D 【解析】电解池一种将电能转变成化学能的装置,发生的反应是非自发的氧化还原反应,电解池工作时,阳极发生氧化反应,阴极发生还原反应。所以A、B、C都是正确的。电解池放电时,活性阳极会参加电极反应,D错误。典例2.如图,电解质溶液是NaCl的水溶液,经过一段时间发现d极附近有黄绿色气体产生,以下说法正确的是( )
【点拨】①电子流向:电源负极→阴极,阳极→电源正极②离子移动方向:阳离子移向阴极,阴离子移向阳极③电流闭合:电源正极→阳极→溶液→阴极→电源负极3.电极上离子放电顺序(1)阴极:与电极材料无关。氧化性强的先放电,放电顺序:(2)阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。若是惰性电极作阳极,放电顺序:①放电指的是电极上的得、失电子。②活性电极指的是除去Au、Pt以外的金属,惰性电极指的是Pt、Au、C电极,不参与电极反应。③阴极材料若为金属电极,一般是增强导电性但不参与反应。【点拨】(1)电解时必须使用直流电源,不能使用交流电源。(2)常见的惰性电极指石墨、铂(Pt)、金(Au),活性电极是指金属活动性顺序中Ag和Ag之前的金属。(3)电解过程是化学变化,而金属的导电是物理变化;书写电解总反应式要注明“电解”或“通电”这一反应条件。(4)原电池装置和电解池装置的最大区别是看有无外接直流电源,有外接直流电源的是电解池。(5)解答电解类题目时首先判断阳极材料,确定是活性电极还是惰性电极,若为活性电极,则电极材料本身失去电子生成金属阳离子,而溶液中所有阴离子不再放电;若为惰性电极,则按电解质溶液中阴离子的放电顺序放电。 典例1.下列关于电解池工作原理的说法中,错误的是( )A.一种将电能转变成化学能的装置 B.电解池中阳极与直流电源的正极相连C.电解池工作时,阳极发生氧化反应,阴极发生还原反应D.与原电池不同,电解池放电时,电极本身不会参加电极反应【答案】D 【解析】电解池一种将电能转变成化学能的装置,发生的反应是非自发的氧化还原反应,电解池工作时,阳极发生氧化反应,阴极发生还原反应。所以A、B、C都是正确的。电解池放电时,活性阳极会参加电极反应,D错误。典例2.如图,电解质溶液是NaCl的水溶液,经过一段时间发现d极附近有黄绿色气体产生,以下说法正确的是( )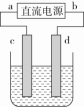 A.a是电源的正极B.电子流动的方向:d→bC.c极发生氧化反应D.如果将c、d两电极互换,则c上也一定会生成黄绿色气体【答案】B 【解析】d极附近有黄绿色气体产生,应该是Cl-放电,说明d极是阳极,所以b是正极,A错;电子流向是电源负极→阴极、阳极→电源正极,即a→c、d→b,B对;c极得电子,化合价降低,发生还原反应,C错;如果c是活性电极,则c上不产生黄绿色气体,D错。典例3.为使反应Cu+2H2O===Cu(OH)2↓+H2↑能够发生,下列设计方案正确的是( )A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池B.用铜片作电极,外接直流电源电解硫酸铜溶液C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液D.用铜片作阴、阳电极,电解稀硫酸【答案】C 【解析】该反应为不能自发进行的氧化还原反应,必须设计为电解池才能发生。阳极为Cu放电,阴极为H2O电离出的H+放电,即用Cu作阳极,电解质溶液中为H2O放电,选项C符合要求。知识点二:惰性电极电解电解质溶液规律(四种类型)
A.a是电源的正极B.电子流动的方向:d→bC.c极发生氧化反应D.如果将c、d两电极互换,则c上也一定会生成黄绿色气体【答案】B 【解析】d极附近有黄绿色气体产生,应该是Cl-放电,说明d极是阳极,所以b是正极,A错;电子流向是电源负极→阴极、阳极→电源正极,即a→c、d→b,B对;c极得电子,化合价降低,发生还原反应,C错;如果c是活性电极,则c上不产生黄绿色气体,D错。典例3.为使反应Cu+2H2O===Cu(OH)2↓+H2↑能够发生,下列设计方案正确的是( )A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池B.用铜片作电极,外接直流电源电解硫酸铜溶液C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液D.用铜片作阴、阳电极,电解稀硫酸【答案】C 【解析】该反应为不能自发进行的氧化还原反应,必须设计为电解池才能发生。阳极为Cu放电,阴极为H2O电离出的H+放电,即用Cu作阳极,电解质溶液中为H2O放电,选项C符合要求。知识点二:惰性电极电解电解质溶液规律(四种类型)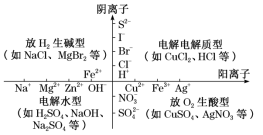 类型电极反应特点电解质特点实例pH变化电解质溶液复原的方法电解水型阴极反应式:2H++2e-===H2↑阳极反应式:4OH--4e-===2H2O+O2↑含氧酸H2SO4减小加H2O可溶性强碱NaOH增大加H2O活泼金属含氧酸盐Na2SO4不变加H2O电解电解质型电解质电离出来的阴、阳离子分别在两极放电无氧酸HCl增大通HCl不活泼金属无氧酸盐CuCl2—加CuCl2放H2生碱型阴极:H2O放H2生碱阳极:电解质阴离子放电活泼金属无氧酸盐NaCl增大通HCl放O2生酸型阴极:电解质阳离子放电阳极:H2O放O2生酸不活泼金属含氧酸盐CuSO4减小加CuO 放H2生碱型(以NaCl为例)阳极反应式:2Cl--2e-===Cl2↑阴极反应式:2H2O+2e-===H2↑+2OH-电解电解质型(以HCl为例)阳极反应式:2Cl--2e-===Cl2↑阴极反应式:2H++2e-===H2↑电解水型(以H2SO4为例)阳极反应式:2H2O-4e-===O2↑+4H+阴极反应式:4H++4e-===2H2↑放O2生酸型(以CuSO4为例)阳极反应式:2H2O-4e-===O2↑+4H+阴极反应式:2Cu2++4e-===2Cu总离子方程式:2Cu2++2H2O2Cu+4H++O2↑ 【点拨】电解质溶液的恢复解决电解质溶液恢复原状的问题,可以按照下面两个步骤进行:(1)首先确定电极产物,如果是活性电极(金属活动性顺序中Ag以前的金属),则电极材料失去电子,电极溶解,溶液中的阴离子不能失电子。如果是惰性电极,则应按照阴、阳离子在溶液中的放电顺序进行判断。(2)恢复电解质溶液,应遵循“缺什么加什么,缺多少加多少”的原则。一般加入阴极产物与阳极产物的化合物。如用惰性电极电解CuSO4溶液,要恢复电解质溶液,可向电解后的溶液中加入CuO,也可以加入CuCO3。但不能加入Cu(OH)2,因Cu(OH)2能与生成的H2SO4反应使水的量增加。加入物质的物质的量需根据电路中的电子守恒进行计算。典例4.用惰性电极实现下列电解实验,其说法正确的是( )A.电解稀硫酸,实质上是电解水,故溶液的pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1【答案】D 【解析】电解稀硫酸,实质上是电解水,溶液的体积减小,硫酸浓度增大,溶液酸性增强,pH减小,故A错误;电解稀氢氧化钠溶液,实质上是电解水,溶液的体积减小,NaOH浓度增大,溶液碱性增强,pH增大,故B错误;电解硫酸钠溶液,实质上是电解水,总反应为2H2O2H2↑+O2↑,则阴极上析出H2和阳极上析出O2的物质的量之比为2∶1,故C错误;电解氯化铜溶液,实质上是电解氯化铜,总反应为CuCl2Cl2↑+Cu,则阴极上析出Cu和阳极上析出Cl2的物质的量之比为1∶1,故D正确。典例5.用惰性电极进行电解,下列说法正确的是( )A.电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1B.电解CuSO4溶液一段时间后,加入一定质量的Cu(OH)2,溶液能与原溶液完全相同C.电解硫酸钠溶液时,Na+向阳极移动D.电解KOH溶液,实质是电解水,故溶液pH不变【答案】A 【解析】A项,电解NaNO3溶液,在阴极上析出H2,阳极上析出O2,其物质的量之比为2∶1;B项,若阴极只有Cu2+放电时,加入一定质量的Cu(OH)2,则比原溶液增加了水;若阴极Cu2+、H+都放电时,加入一定质量的Cu(OH)2,则溶液可能与原溶液完全相同;C项,电解硫酸钠溶液时,Na+应向阴极移动;D项,实质是电解水,KOH浓度增大,溶液pH增大。典例6.用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
类型电极反应特点电解质特点实例pH变化电解质溶液复原的方法电解水型阴极反应式:2H++2e-===H2↑阳极反应式:4OH--4e-===2H2O+O2↑含氧酸H2SO4减小加H2O可溶性强碱NaOH增大加H2O活泼金属含氧酸盐Na2SO4不变加H2O电解电解质型电解质电离出来的阴、阳离子分别在两极放电无氧酸HCl增大通HCl不活泼金属无氧酸盐CuCl2—加CuCl2放H2生碱型阴极:H2O放H2生碱阳极:电解质阴离子放电活泼金属无氧酸盐NaCl增大通HCl放O2生酸型阴极:电解质阳离子放电阳极:H2O放O2生酸不活泼金属含氧酸盐CuSO4减小加CuO 放H2生碱型(以NaCl为例)阳极反应式:2Cl--2e-===Cl2↑阴极反应式:2H2O+2e-===H2↑+2OH-电解电解质型(以HCl为例)阳极反应式:2Cl--2e-===Cl2↑阴极反应式:2H++2e-===H2↑电解水型(以H2SO4为例)阳极反应式:2H2O-4e-===O2↑+4H+阴极反应式:4H++4e-===2H2↑放O2生酸型(以CuSO4为例)阳极反应式:2H2O-4e-===O2↑+4H+阴极反应式:2Cu2++4e-===2Cu总离子方程式:2Cu2++2H2O2Cu+4H++O2↑ 【点拨】电解质溶液的恢复解决电解质溶液恢复原状的问题,可以按照下面两个步骤进行:(1)首先确定电极产物,如果是活性电极(金属活动性顺序中Ag以前的金属),则电极材料失去电子,电极溶解,溶液中的阴离子不能失电子。如果是惰性电极,则应按照阴、阳离子在溶液中的放电顺序进行判断。(2)恢复电解质溶液,应遵循“缺什么加什么,缺多少加多少”的原则。一般加入阴极产物与阳极产物的化合物。如用惰性电极电解CuSO4溶液,要恢复电解质溶液,可向电解后的溶液中加入CuO,也可以加入CuCO3。但不能加入Cu(OH)2,因Cu(OH)2能与生成的H2SO4反应使水的量增加。加入物质的物质的量需根据电路中的电子守恒进行计算。典例4.用惰性电极实现下列电解实验,其说法正确的是( )A.电解稀硫酸,实质上是电解水,故溶液的pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1【答案】D 【解析】电解稀硫酸,实质上是电解水,溶液的体积减小,硫酸浓度增大,溶液酸性增强,pH减小,故A错误;电解稀氢氧化钠溶液,实质上是电解水,溶液的体积减小,NaOH浓度增大,溶液碱性增强,pH增大,故B错误;电解硫酸钠溶液,实质上是电解水,总反应为2H2O2H2↑+O2↑,则阴极上析出H2和阳极上析出O2的物质的量之比为2∶1,故C错误;电解氯化铜溶液,实质上是电解氯化铜,总反应为CuCl2Cl2↑+Cu,则阴极上析出Cu和阳极上析出Cl2的物质的量之比为1∶1,故D正确。典例5.用惰性电极进行电解,下列说法正确的是( )A.电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1B.电解CuSO4溶液一段时间后,加入一定质量的Cu(OH)2,溶液能与原溶液完全相同C.电解硫酸钠溶液时,Na+向阳极移动D.电解KOH溶液,实质是电解水,故溶液pH不变【答案】A 【解析】A项,电解NaNO3溶液,在阴极上析出H2,阳极上析出O2,其物质的量之比为2∶1;B项,若阴极只有Cu2+放电时,加入一定质量的Cu(OH)2,则比原溶液增加了水;若阴极Cu2+、H+都放电时,加入一定质量的Cu(OH)2,则溶液可能与原溶液完全相同;C项,电解硫酸钠溶液时,Na+应向阴极移动;D项,实质是电解水,KOH浓度增大,溶液pH增大。典例6.用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )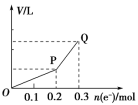 A.0.1 mol CuO B.0.1 mol CuCO3C.0.1 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3【答案】D 【解析】根据图像和电解原理,O~P段电解反应的化学方程式为:2CuSO4+2H2O
A.0.1 mol CuO B.0.1 mol CuCO3C.0.1 mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3【答案】D 【解析】根据图像和电解原理,O~P段电解反应的化学方程式为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,P~Q段电解反应的化学方程式为:2H2O
2Cu+O2↑+2H2SO4,P~Q段电解反应的化学方程式为:2H2O![]() 2H2↑+O2↑,所以溶液中应加入CuO:
2H2↑+O2↑,所以溶液中应加入CuO: ![]() =0.1 mol,H2O:
=0.1 mol,H2O:![]() =0.05 mol,分析四个选项,加入0.05 mol Cu2(OH)2CO3合适。知识点三:电极反应式和电解方程式的书写要点1.书写要点(1)做到“三看”,正确书写电极反应式①一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被电解(注:Fe生成Fe2+)。②二看电解质,电解质是否参与电极反应。③三看电解质状态,是熔融状态,还是水溶液。(2)规避“两个”失分点①书写电解池中电极反应式时,可以以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式,且注明“电解”条件。②电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。 2.电极反应式及总反应方程式的书写步骤[以惰性电极电解Cu(NO3)2溶液为例]
=0.05 mol,分析四个选项,加入0.05 mol Cu2(OH)2CO3合适。知识点三:电极反应式和电解方程式的书写要点1.书写要点(1)做到“三看”,正确书写电极反应式①一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被电解(注:Fe生成Fe2+)。②二看电解质,电解质是否参与电极反应。③三看电解质状态,是熔融状态,还是水溶液。(2)规避“两个”失分点①书写电解池中电极反应式时,可以以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式,且注明“电解”条件。②电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。 2.电极反应式及总反应方程式的书写步骤[以惰性电极电解Cu(NO3)2溶液为例]  核心价值与学科素养1807年,年轻的化学家H.戴维在获悉刚发明的伏打电池被用于电解水并获成功后,立即决定采用这一在当时十分先进的手段来进行新元素的发现工作。他集中了250对金属板制成了当时最大的伏打电池组,用它作电源来电解氢氧化钾饱和溶液。但令人遗憾的并没有得到金属。经思索,戴维认为水的存在是电解氢氧化钾的障碍,于是决定改变实验条件,用电解熔融态的氢氧化钾来进行实验。通电后,发现在阴极附近逐渐有一些微小的金光闪闪的圆珠出现。 典例7.含有氰化物的废水危害极大,能毒杀各种鱼类和水生物。c(CN-)在0.01~0.04 mg·L-1时,就有强烈的毒杀作用。用如图所示装置除去CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。
核心价值与学科素养1807年,年轻的化学家H.戴维在获悉刚发明的伏打电池被用于电解水并获成功后,立即决定采用这一在当时十分先进的手段来进行新元素的发现工作。他集中了250对金属板制成了当时最大的伏打电池组,用它作电源来电解氢氧化钾饱和溶液。但令人遗憾的并没有得到金属。经思索,戴维认为水的存在是电解氢氧化钾的障碍,于是决定改变实验条件,用电解熔融态的氢氧化钾来进行实验。通电后,发现在阴极附近逐渐有一些微小的金光闪闪的圆珠出现。 典例7.含有氰化物的废水危害极大,能毒杀各种鱼类和水生物。c(CN-)在0.01~0.04 mg·L-1时,就有强烈的毒杀作用。用如图所示装置除去CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。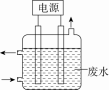 (1)若用石墨和铁作电极材料, 为阳极, 为阴极。 (2)阳极电极反应式 ,阴极的电极反应式 。 (3)写出除去CN-的离子反应方程式 。【答案】(1)石墨 铁。(2)Cl-+2OH--2e-===ClO-+H2O 2H2O+2e-===H2↑+2OH-。(3)2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-【解析】(1)若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极。(2)阳极Cl-放电生成ClO-,氯元素的化合价升高,故在阳极发生氧化反应,由已知该溶液呈碱性。阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+)。 (3)由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-。典例8.法国化学家莫瓦桑经过多次实验,在1886年通过电解法制得了F2。方法为在无水HF中电解KHF2制得单质氟。下列判断不正确的是( )A.阳极产物为F2B.阴极的电极反应:2HF+2e-===H2↑+4F-C.该电解操作应该在通风橱中进行D.电解一段时间后,在相同条件下,阳极产生的气体体积比阴极的多【答案】D【解析】阳极发生氧化反应,F元素的化合价升高,阳极的电极反应为2F--2e-===F2↑,故A正确;阴极上HF得电子生成H2,故B正确;F2有剧毒,必须在通风系统中进行电解,故C正确;电解时,总反应为2KHF22KF+H2↑+F2↑,因此电解一段时间后,在相同条件下,阴、阳极产生的气体体积相等,故D错误。典例9.2020年新型冠状病毒肺炎疫情在世界范围内暴发。病毒对消毒剂敏感,75%酒精、双氧水等均可灭活病毒。科学家报告了一种直接电化学合成H2O2的方法,装置如图。下列叙述不正确的是( )
(1)若用石墨和铁作电极材料, 为阳极, 为阴极。 (2)阳极电极反应式 ,阴极的电极反应式 。 (3)写出除去CN-的离子反应方程式 。【答案】(1)石墨 铁。(2)Cl-+2OH--2e-===ClO-+H2O 2H2O+2e-===H2↑+2OH-。(3)2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-【解析】(1)若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极。(2)阳极Cl-放电生成ClO-,氯元素的化合价升高,故在阳极发生氧化反应,由已知该溶液呈碱性。阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+)。 (3)由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-。典例8.法国化学家莫瓦桑经过多次实验,在1886年通过电解法制得了F2。方法为在无水HF中电解KHF2制得单质氟。下列判断不正确的是( )A.阳极产物为F2B.阴极的电极反应:2HF+2e-===H2↑+4F-C.该电解操作应该在通风橱中进行D.电解一段时间后,在相同条件下,阳极产生的气体体积比阴极的多【答案】D【解析】阳极发生氧化反应,F元素的化合价升高,阳极的电极反应为2F--2e-===F2↑,故A正确;阴极上HF得电子生成H2,故B正确;F2有剧毒,必须在通风系统中进行电解,故C正确;电解时,总反应为2KHF22KF+H2↑+F2↑,因此电解一段时间后,在相同条件下,阴、阳极产生的气体体积相等,故D错误。典例9.2020年新型冠状病毒肺炎疫情在世界范围内暴发。病毒对消毒剂敏感,75%酒精、双氧水等均可灭活病毒。科学家报告了一种直接电化学合成H2O2的方法,装置如图。下列叙述不正确的是( )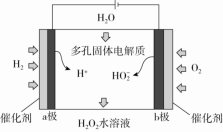 A.该装置的工作原理是将化学能转化成电能B.b极发生的电极反应为O2+H2O+2e-===HO+OH-C.电池工作时,内部发生反应:HO+OH-+2H+===H2O2+H2OD.电路中通过2 mol电子,消耗氧气22.4 L(标准状况)【答案】A【解析】该装置是电解池,将电能转化为化学能,A错误;b电极为阴极,O2得电子生成HO,电极反应式为O2+H2O+2e-===HO+OH-,B正确;装置中阴极生成HO、OH-,阳极生成H+,所以电池工作时,内部生成的HO、OH-与H+反应生成H2O2和H2O,C正确;b电极为阴极,电极反应式为O2+H2O+2e-===HO+OH-,电路中通过2 mol电子,消耗1 mol O2,标准状况下的体积为22.4 L,D正确。【跟踪练习】 基础过关1. 载人空间站的生态系统中,要求分离人呼出的二氧化碳,同时需要提供氧气。某电化学装置利用太阳能转化的电能可以实现上述要求,同时还有燃料一氧化碳生成,该电化学装置中得电子的电极发生的反应是2CO2+4e-+2H2O===2CO+4OH-。下列判断错误的是( )A.上述电化学装置相当于电解池B.上述装置进行的总反应式为2CO2===2CO+O2C.反应结束后该电化学装置中的电解质溶液碱性增强D.失电子的电极发生的反应是4OH--4e-===2H2O+O2↑2. 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )
A.该装置的工作原理是将化学能转化成电能B.b极发生的电极反应为O2+H2O+2e-===HO+OH-C.电池工作时,内部发生反应:HO+OH-+2H+===H2O2+H2OD.电路中通过2 mol电子,消耗氧气22.4 L(标准状况)【答案】A【解析】该装置是电解池,将电能转化为化学能,A错误;b电极为阴极,O2得电子生成HO,电极反应式为O2+H2O+2e-===HO+OH-,B正确;装置中阴极生成HO、OH-,阳极生成H+,所以电池工作时,内部生成的HO、OH-与H+反应生成H2O2和H2O,C正确;b电极为阴极,电极反应式为O2+H2O+2e-===HO+OH-,电路中通过2 mol电子,消耗1 mol O2,标准状况下的体积为22.4 L,D正确。【跟踪练习】 基础过关1. 载人空间站的生态系统中,要求分离人呼出的二氧化碳,同时需要提供氧气。某电化学装置利用太阳能转化的电能可以实现上述要求,同时还有燃料一氧化碳生成,该电化学装置中得电子的电极发生的反应是2CO2+4e-+2H2O===2CO+4OH-。下列判断错误的是( )A.上述电化学装置相当于电解池B.上述装置进行的总反应式为2CO2===2CO+O2C.反应结束后该电化学装置中的电解质溶液碱性增强D.失电子的电极发生的反应是4OH--4e-===2H2O+O2↑2. 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )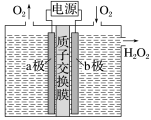 A.阳极反应为2H2O-4e-===4H++O2↑B.电解一段时间后,阳极室的pH未变C.电解过程中,H+由a极区向b极区迁移D.电解一段时间后,a极生成的O2与b极反应的O2等量3. 1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)O2↑+4Na↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH===Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )A.戴维法制钠,阳极的电极反应式为Na++e-===Na↑B.盖·吕萨克法制钠原理是利用铁的金属性比钠的强C.若用戴维法与盖·吕萨克法制得等量的钠,两方法转移的电子总数相等D.还可以用电解熔融氯化钠法制钠4. 在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )
A.阳极反应为2H2O-4e-===4H++O2↑B.电解一段时间后,阳极室的pH未变C.电解过程中,H+由a极区向b极区迁移D.电解一段时间后,a极生成的O2与b极反应的O2等量3. 1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)O2↑+4Na↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH===Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )A.戴维法制钠,阳极的电极反应式为Na++e-===Na↑B.盖·吕萨克法制钠原理是利用铁的金属性比钠的强C.若用戴维法与盖·吕萨克法制得等量的钠,两方法转移的电子总数相等D.还可以用电解熔融氯化钠法制钠4. 在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )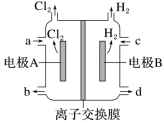 A.电极A为阳极,发生氧化反应生成氯气B.离子交换膜为阳离子交换膜C.饱和NaCl溶液从a处进,NaOH溶液从d处出D.OH-迁移的数量等于导线上通过电子的数量5. 用惰性电极电解法制备硼酸[H3BO3或B(OH)3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )
A.电极A为阳极,发生氧化反应生成氯气B.离子交换膜为阳离子交换膜C.饱和NaCl溶液从a处进,NaOH溶液从d处出D.OH-迁移的数量等于导线上通过电子的数量5. 用惰性电极电解法制备硼酸[H3BO3或B(OH)3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )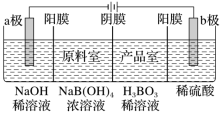 A.阴极与阳极产生的气体体积比为1∶2B.b极的电极反应式为2H2O-2e-===O2↑+4H+C.产品室中发生的反应是B(OH)3+OH-===B(OH)D.每增加1 mol H3BO3产品,NaOH溶液增重22 g 能力达成6. 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法错误的是( )
A.阴极与阳极产生的气体体积比为1∶2B.b极的电极反应式为2H2O-2e-===O2↑+4H+C.产品室中发生的反应是B(OH)3+OH-===B(OH)D.每增加1 mol H3BO3产品,NaOH溶液增重22 g 能力达成6. 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法错误的是( )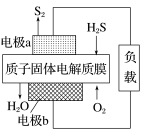 A.电极a为电池的负极B.电极b上发生的电极反应:O2+4H++4e-===2H2OC.电路中每通过4 mol电子,在正极消耗44.8 L H2SD.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区10.某污水处理厂利用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如图所示。下列说法不正确的是( )
A.电极a为电池的负极B.电极b上发生的电极反应:O2+4H++4e-===2H2OC.电路中每通过4 mol电子,在正极消耗44.8 L H2SD.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区10.某污水处理厂利用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如图所示。下列说法不正确的是( )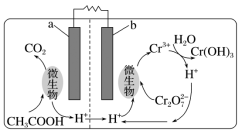 A.电池工作过程中电子由a极流向b极B.b极反应式:Cr2O72-+6e-+14H+===2Cr3++7H2OC.电池工作过程中a极区附近溶液的pH增大D.每处理1 mol Cr2O72-,可生成33.6 L(标况下)CO28. 知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
A.电池工作过程中电子由a极流向b极B.b极反应式:Cr2O72-+6e-+14H+===2Cr3++7H2OC.电池工作过程中a极区附近溶液的pH增大D.每处理1 mol Cr2O72-,可生成33.6 L(标况下)CO28. 知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。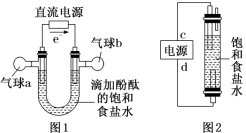 (1)图1中,电解一段时间后,气球b中的气体是__________(填化学式),U形管______(填“左”或“右”)边的溶液变红。(2)利用图2制作一种环保型消毒液发生器,可制备84消毒液的有效成分,则c为电源的________极;该发生器中反应的总离子反应式为_______________________________。(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
(1)图1中,电解一段时间后,气球b中的气体是__________(填化学式),U形管______(填“左”或“右”)边的溶液变红。(2)利用图2制作一种环保型消毒液发生器,可制备84消毒液的有效成分,则c为电源的________极;该发生器中反应的总离子反应式为_______________________________。(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。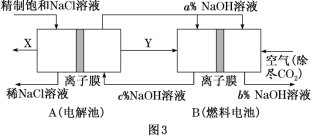 ①燃料电池B中的电极反应式分别为负极:__________________________________________________________________,正极:___________________________________________________________________。②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为________________。
①燃料电池B中的电极反应式分别为负极:__________________________________________________________________,正极:___________________________________________________________________。②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为________________。






