高考化学一轮复习考点规范练29物质的检验分离和提纯 人教版(含答案解析)
展开考点规范练29 物质的检验、分离和提纯
(时间:45分钟 满分:100分)
一、选择题(本题共10小题,每小题5分,共50分。每小题只有一个选项符合题目要求)
1.下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡 | B.加热煎制 | C.箅渣取液 | D.灌装保存 |
|
|
|
|
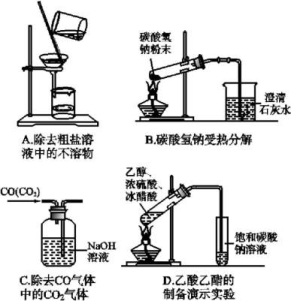
2.下列图示实验正确的是( )
3.下列各组混合物的分离和提纯方法正确的是( )
A.用萃取法分离汽油和水的混合液
B.用结晶法提纯NaCl和KNO3混合物中的KNO3
C.直接蒸馏酒精溶液得到无水乙醇
D.除去FeCl3溶液中少量的FeCl2,加入足量的铁屑,充分反应后,过滤
4.下列物质提纯的方法正确的是( )
A.除去混在NO2中的NO:将气体与过量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
5.下列离子在未知溶液中的检验方法正确的是( )
选项 | 离子 | 检验方法 |
A | C | 向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观察溶液是否变浑浊 |
B | S | 向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成 |
C | Fe2+ | 取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去 |
D | I- | 取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变蓝色 |
6.下列各组物质的溶液,不用外加试剂,就能实现鉴别的是 ( )
①CuSO4 K2SO4 KNO3 KOH
②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3
④NaAlO2 Na2SiO3 H2SO4 NaCl
A.①②③ B.①②③④
C.①③④ D.②③④
7.(2018广东江门高考模拟)实验室在500 ℃时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法中正确的是( )
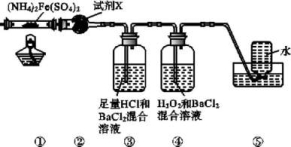
A.装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B.装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
C.取①中固体残留物与稀硫酸反应并滴加KSCN溶液,溶液变红色,则残留物一定为Fe2O3
D.装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
8.下列除杂试剂或方法有错误的是( )
选项 | 原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 |
A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
D | C2H5OH | CH3COOH | CaO | 蒸馏 |
9.X溶液中含有下表离子中的某5种,且浓度均为0.1 mol·L-1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+ Ca2+ Fe2+ Al3+ Fe3+ Mg2+ | OH- HC C N |
A.X溶液中不可能含有HC![]() 或C
或C![]()
B.生成无色气体的离子方程式为3Fe2++N![]() +4H+
+4H+![]() 3Fe3++NO↑+2H2O
3Fe3++NO↑+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
10.根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
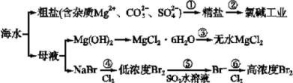
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2 种单质
B.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
C.在过程④⑥反应中每氧化0.2 mol Br-需消耗2.24 L Cl2
D.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
二、非选择题(本题共3个小题,共50分)
11.(14分)根据如图所示仪器(若有必要,装置可多次使用),回答下列问题。
(1)洗气:除去CO2中的水蒸气,装置内应盛的物质是 ,气体应从 端通入。若应用如图所示的装置,除去Cl2中混有的水蒸气和HCl气体,其操作方法是 。
(2)检验:证明CO中含有CO2,装置内应盛 ,要除去CO2并得到干燥CO的方法是 。
(3)贮气:排空气法收集H2时,气体从 端通入;排水法收集O2时,瓶内应先装满水,气体从 端通入;若要用水将装置中的O2排出,水应从 端通入。
(4)量气:要测量气体体积,除去乳胶管和玻璃导管外,还需要用到的一种仪器是 ,测量时瓶内先装满水,气体从 端通入,该法适用于测量 的气体的体积。
12.(18分)我国青海查尔汗盐湖蕴藏着丰富的食盐资源。经分析知道,该湖水中含有高浓度的Na+、K+、Mg2+及Cl-等。利用盐湖水可得到某些物质。其主要工业流程如下:
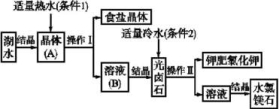
请根据上述流程,回答下列问题:
(1)利用湖水得到晶体(A)的方法是 (填“降温”或“蒸发”)结晶法。
(2)操作Ⅰ的名称为 ,此操作适用于分离 。
(3)本流程中分别采用条件1和条件2获得不同晶体,所依据的物理性质是 。
a.摩尔质量 b.溶解度
c.溶解性 d.熔、沸点
(4)检验钾肥中是否含有Na+的实验方法是 ,若含有Na+,能观察到的现象是 。若需得到高纯度的钾肥,可以采用的提纯方法为 。
13.(18分)中国中医科学院青蒿素专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35 ℃。从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
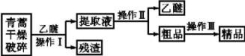
请回答下列问题:
(1)操作Ⅱ的名称是 。
(2)操作Ⅲ的主要过程可能是 (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用下列实验装置测定青蒿素分子式的方法如下:
将28.2 g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
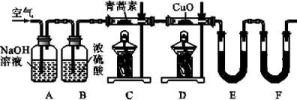
①装置D的作用是 ,
装置E中吸收的物质是 ,装置F中盛放的物质是 。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是 。
③用合理改进后的装置进行实验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的实验式是 。
考点规范练29 物质的检验、分离和提纯
1.C A项,冷水浸泡即为冷水溶解操作,错误;B项,加热煎制即为加热操作,错误;C项,将渣弃去取得滤液,属于过滤操作,正确;D项,灌装即为转移液体,便于保存,错误。
2.D A项,漏斗尖嘴处应紧贴烧杯内壁;B项,给固体加热时,试管口应向下倾斜;C项,除杂应“长进短出”,否则NaOH溶液将被挤压出去;D项,反应发生装置、试剂及收集装置均正确。
3.B 汽油和水互不相溶,应使用分液的方法进行分离,A项错误;NaCl的溶解度随温度变化较小,而KNO3的溶解度随温度变化较大,故可用结晶法提纯NaCl和KNO3混合物中的KNO3,B项正确;酒精和水都容易挥发,直接蒸馏酒精溶液得不到无水乙醇,应在酒精溶液中加入CaO再蒸馏,C项错误;除去FeCl3溶液中少量的FeCl2,应通入足量的Cl2,D项错误。
4.B 因为通入过量的氧气,NO2中混有O2,引入新的杂质气体,A项错误;SO2具有还原性,被高锰酸钾氧化成S![]() ,剩余气体通过浓硫酸干燥,得到纯净的CO2,B项正确;加BaCl2会引入过量的Ba2+,C项错误;乙酸显酸性,与生石灰反应,除去了乙酸,与题意不符,D项错误。
,剩余气体通过浓硫酸干燥,得到纯净的CO2,B项正确;加BaCl2会引入过量的Ba2+,C项错误;乙酸显酸性,与生石灰反应,除去了乙酸,与题意不符,D项错误。
5.D 如果该溶液中含有HC![]() ,HC
,HC![]() 和盐酸反应产生CO2,使澄清石灰水变浑浊,因此HC
和盐酸反应产生CO2,使澄清石灰水变浑浊,因此HC![]() 会造成干扰,A项错误;硝酸具有强氧化性,能把S
会造成干扰,A项错误;硝酸具有强氧化性,能把S![]() 氧化成S
氧化成S![]() ,因此含有S
,因此含有S![]() 时同样有白色沉淀生成,B项错误;能使酸性高锰酸钾溶液褪色的离子很多,如S
时同样有白色沉淀生成,B项错误;能使酸性高锰酸钾溶液褪色的离子很多,如S![]() 等,因此使酸性高锰酸钾溶液褪色的不一定是Fe2+,C项错误;Cl2能把I-氧化成I2,淀粉遇碘变蓝,因此可以检验I-的存在,D项正确。
等,因此使酸性高锰酸钾溶液褪色的不一定是Fe2+,C项错误;Cl2能把I-氧化成I2,淀粉遇碘变蓝,因此可以检验I-的存在,D项正确。
6.D ①根据溶液颜色可鉴别出CuSO4溶液,用CuSO4溶液可进一步鉴别出KOH溶液,但K2SO4和KNO3溶液无法鉴别;②两两混合,有一种物质与其他两种物质生成沉淀中,该物质是BaCl2溶液,产生沉淀的两种物质是Na2CO3和Na2SO4溶液,将HCl溶液加入两种沉淀中,沉淀消失的原物质是Na2CO3溶液,不消失的原物质是Na2SO4溶液,本组能鉴别;③两两互滴,利用滴加顺序不同现象不同可鉴别出Ba(OH)2和AlCl3溶液,再利用Ba(OH)2溶液鉴别出Na2SO4和NH4NO3溶液,本组能鉴别;④两两互滴,利用滴加顺序不同现象不同可鉴别出NaAlO2和H2SO4溶液,再用H2SO4溶液鉴别出Na2SiO3溶液,最后一种物质就是NaCl溶液,本组也能鉴别,故正确答案是D。
7.B 装置②的作用是检验产物中是否有水蒸气生成,故试剂X应为无水硫酸铜,A项错误;装置③用于检验产物中是否有SO3气体生成,若存在,则装置③中会产生白色沉淀,并可用盐酸除去NH3,B项正确;取①中固体残留物与稀硫酸反应并滴加KSCN溶液,溶液变红色,则①中固体残留物中也可能含有Fe3O4,不一定有Fe2O3,C项错误;氨气极易溶于水,若分解产物中有NH3,则氨气被装置③吸收,装置⑤不可能收集到氨气,D项错误。
8.A A项中引入了新杂质,故错误;B项,SO2能够与酸性KMnO4溶液反应,CO2不能,再通过浓硫酸干燥可以得到纯净的CO2;C项,SiO2不溶于盐酸,Al2O3能溶于盐酸,反应后过滤可以得到纯净的SiO2;D项,乙酸与CaO反应生成沸点较高的乙酸钙,通过蒸馏可以得到纯净的乙醇。
9.D 加入足量稀盐酸后,阴离子种类没有变化,说明X溶液中不含OH-、HC![]() 、C
、C![]() ,含有Cl-,有无色气体生成,应是N
,含有Cl-,有无色气体生成,应是N![]() 与Fe2+在酸性条件下发生氧化还原反应生成NO气体:3Fe2++N
与Fe2+在酸性条件下发生氧化还原反应生成NO气体:3Fe2++N![]() +4H+
+4H+![]() 3Fe3++NO↑+2H2O,因此X溶液中肯定还有N
3Fe3++NO↑+2H2O,因此X溶液中肯定还有N![]() 和Fe2+。由于Cl-、N
和Fe2+。由于Cl-、N![]() 、Fe2+的浓度均为0.1mol·L-1,此时电荷已守恒,但已知X溶液中含有5种离子,则还应含有阴、阳离子各一种,阴离子只能是S
、Fe2+的浓度均为0.1mol·L-1,此时电荷已守恒,但已知X溶液中含有5种离子,则还应含有阴、阳离子各一种,阴离子只能是S![]() ,则由电荷守恒可知,阳离子可能是Ca2+或Mg2+,由于Ca2+与S
,则由电荷守恒可知,阳离子可能是Ca2+或Mg2+,由于Ca2+与S![]() 不能大量共存,所以只能是Mg2+。综上所述,溶液中含有两种阳离子:Fe2+、Mg2+,三种阴离子:Cl-、N
不能大量共存,所以只能是Mg2+。综上所述,溶液中含有两种阳离子:Fe2+、Mg2+,三种阴离子:Cl-、N![]() 、S
、S![]() ,故D项不正确。
,故D项不正确。
10.B 过程①的提纯是通过化学反应除去杂质,A项错误;过程⑤反应生成硫酸和氢溴酸,溶液呈强酸性,生产中需解决其对设备的腐蚀问题,B项正确;在过程④⑥反应中每氧化0.2molBr-需消耗标准状况下的2.24LCl2,C项错误;MgCl2·6H2O在灼烧时会发生水解,D项错误。
11.答案(1)浓硫酸 A 用两个如题图所示的装置,以A—B—A—B的顺序连接,在第一个装置中盛饱和食盐水,第二个装置中盛浓硫酸,气体从第一个装置的A端进入,从第二个装置的B端排出
(2)澄清石灰水 用两个如题图所示的装置,以A—B—A—B的顺序连接,让气体连续通过分别盛有浓NaOH溶液和浓硫酸的洗气瓶
(3)B B A
(4)量筒 B 难溶于水且不与水反应
解析题图所示装置用于净化气体时,应先除杂后干燥,气体应“长进短出”;用于收集气体时,密度比空气大的气体应“长进短出”,密度比空气小的气体应“短进长出”,排液集气法应短管进气,长管排液;用于测量气体的体积时,应短管进气将液体从长管排入量筒内。
12.答案(1)蒸发 (2)过滤 固体和液体混合物
(3)b (4)焰色反应 火焰呈黄色 重结晶法
解析(1)应采用蒸发天然湖水的方法使溶质结晶。(2)固体和液体混合物的分离,应用过滤的方法。(3)由流程图可知,条件1和条件2温度不同,利用物质在不同温度下的溶解度不同进行分离。(4)检验Na+、K+等应用焰色反应。
13.答案(1)蒸馏 (2)B (3)①将可能生成的CO氧化为CO2 H2O(水蒸气) 碱石灰 ②在装置F后连接一个防止空气中的CO2和水蒸气进入F的装置 ③C15H22O5
解析(2)青蒿素在水中几乎不溶,A项错误;获得的精品应是固体,C项错误。
(3)青蒿素分子式的测定原理是:燃烧一定质量的青蒿素样品,使其完全转化为CO2和H2O,然后测量CO2和H2O的质量,据此求出样品中C、H、O三种元素的质量,进而可确定青蒿素的实验式(最简式),若已知青蒿素的相对分子质量,则可确定其分子式。
②测定的含氧量偏低是由于外界空气中的CO2和水蒸气进入装置F中引起测定的含碳量偏高造成的,因此,改进方法是在装置F后再连接一个防止空气中CO2和水蒸气进入F的装置(如盛有碱石灰的干燥管)。
③由实验数据可知,m(H2O)=42.4g-22.6g=19.8g,m(CO2)=146.2g-80.2g=66g,则n(H2O)=1.1mol,n(CO2)=1.5mol,n(H)=2.2mol,n(C)=1.5mol,m(H)=2.2g,m(C)=18.0g,m(O)=m(样品)-m(C)-m(H)=28.2g-18.0g-2.2g=8.0g,n(O)=0.5mol,所以n(C)∶n(H)∶n(O)=1.5∶2.2∶0.5=15∶22∶5,即青蒿素的实验式是C15H22O5。
人教版高考化学一轮复习课时练28物质的检验分离和提纯含答案: 这是一份人教版高考化学一轮复习课时练28物质的检验分离和提纯含答案
全国通用高考化学一轮复习专练49物质的检验分离提纯含答案: 这是一份全国通用高考化学一轮复习专练49物质的检验分离提纯含答案
2023年高考化学一轮复习课时练35《物质的检验、分离和提纯》(含答案): 这是一份2023年高考化学一轮复习课时练35《物质的检验、分离和提纯》(含答案),共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。