


所属成套资源:高考化学一轮复习检测 含解析
高考化学一轮复习检测:第3章 金属及其化合物3-2a Word版含解析
展开
这是一份高考化学一轮复习检测:第3章 金属及其化合物3-2a Word版含解析,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
![]() 板块三 限时规范特训
板块三 限时规范特训![]() 时间:45分钟
时间:45分钟 ![]() 满分:100分一、选择题(每题6分,共72分)1.下列关于铝及其化合物的叙述正确的是( )A.氧化铝坩埚可用于熔融NaOH实验B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.氧化铝熔点很高,可作耐火材料D.明矾用作净水剂,可以除去废水中的铜离子答案 C解析 氧化铝能与NaOH反应,氧化铝坩埚不能用于熔融NaOH实验,A错误;根据质量守恒定律,反应后固体物质的质量不变,B错误;氧化铝熔点很高,可用于制耐火砖、耐火坩埚、耐火高温实验仪器等,C正确;明矾净水时,Al3+水解生成Al(OH)3胶体,可吸附水中不溶于水的杂质形成沉淀,从而起到净水作用,铜离子无法除去,D错误。2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的( )
满分:100分一、选择题(每题6分,共72分)1.下列关于铝及其化合物的叙述正确的是( )A.氧化铝坩埚可用于熔融NaOH实验B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.氧化铝熔点很高,可作耐火材料D.明矾用作净水剂,可以除去废水中的铜离子答案 C解析 氧化铝能与NaOH反应,氧化铝坩埚不能用于熔融NaOH实验,A错误;根据质量守恒定律,反应后固体物质的质量不变,B错误;氧化铝熔点很高,可用于制耐火砖、耐火坩埚、耐火高温实验仪器等,C正确;明矾净水时,Al3+水解生成Al(OH)3胶体,可吸附水中不溶于水的杂质形成沉淀,从而起到净水作用,铜离子无法除去,D错误。2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的( )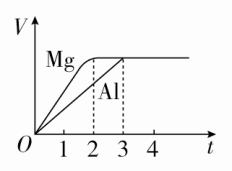 A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3答案 A解析 由关系式:Mg~H2,2Al~3H2,可知产生等量H2时,消耗Mg、Al的物质的量之比为3∶2,质量之比为4∶3,摩尔质量之比为24∶27=8∶9,反应速率之比为3∶2,故A正确。3.下列各组物质能相互反应得到Al(OH)3的是( )A.Al跟NaOH溶液共热B.Al(NO3)3跟过量的NaOH溶液反应C.Al2O3和水共热D.Al2(SO4)3和过量的氨水反应答案 D解析 Al跟NaOH溶液共热生成NaAlO2,得不到氢氧化铝,故A错误;氢氧化铝是两性氢氧化物,溶于强酸或强碱,Al(NO3)3跟过量的NaOH溶液反应生成NaAlO2,得不到氢氧化铝,故B错误;氧化铝不溶于水,不能与水反应生成氢氧化铝,故C错误;Al2(SO4)3和过量的氨水反应可以得到氢氧化铝,氢氧化铝不溶于弱碱,故D正确。4.下列有关金属镁的说法不正确的是( )A.Mg在CO2中燃烧生成MgO和C,是放热反应B.工业上通过电解MgCl2溶液制取金属镁C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率D.镁可以用来制造信号弹和焰火,MgO可以作耐高温材料答案 B解析 金属Mg可以在CO2中燃烧生成MgO和C,同时放出大量的热,A正确;工业上通过电解熔融MgCl2来制取金属镁,B错误;Mg和稀硫酸反应时,滴加少量硫酸铜溶液,Mg置换出Cu,形成原电池,化学反应速率加快,C正确;Mg在空气中燃烧发出耀眼的白光,常用来制造信号弹和焰火,MgO的熔点很高,常用作耐高温材料,D正确。5.[2017·山东重点中学联考]下列物质组合中,既能和酸反应又能和碱反应的化合物共有( )①(NH4)2CO3 ②Al2O3 ③Al2(SO4)3 ④Al ⑤NaHSO3 ⑥Al(OH)3A.3种 B.4种 C.5种 D.6种答案 B解析 Al为单质,排除④;(NH4)2CO3与酸反应生成CO2,与碱反应生成NH3;Al2O3、Al(OH)3为两性物质,均能与强酸、强碱反应;NaHSO3与酸反应生成SO2,与碱反应生成Na2SO3;Al2(SO4)3只能与碱反应,不能与酸反应。故既能与酸反应也能与碱反应的化合物是①②⑤⑥,B正确。6.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )选项陈述Ⅰ陈述Ⅱ判断A铝制炊具最好不要盛放酸性或碱性较强的液体食物Al和Al2O3既可以与酸反应又可以与碱反应Ⅰ对,Ⅱ对,有B铝箔在酒精灯火焰上加热熔化但不滴落铝箔对熔化的铝有较强的吸附作用Ⅰ对,Ⅱ对,有C海啸使水源发生污染可用明矾进行消毒和净化明矾水解生成Al(OH)3胶体,具有吸附性Ⅰ对,Ⅱ错,无D铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸铁和铝不能与浓硫酸或浓硝酸反应Ⅰ错,Ⅱ对,无 答案 A解析 铝箔在酒精灯火焰上加热熔化但不滴落是因为Al2O3的熔点高于金属Al,故B错;明矾水解产生Al(OH)3胶体,可净化水,但不能进行消毒,故C错;铁、铝遇浓硫酸、浓硝酸钝化,并不是不反应,故D错。7.镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是( )
A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3答案 A解析 由关系式:Mg~H2,2Al~3H2,可知产生等量H2时,消耗Mg、Al的物质的量之比为3∶2,质量之比为4∶3,摩尔质量之比为24∶27=8∶9,反应速率之比为3∶2,故A正确。3.下列各组物质能相互反应得到Al(OH)3的是( )A.Al跟NaOH溶液共热B.Al(NO3)3跟过量的NaOH溶液反应C.Al2O3和水共热D.Al2(SO4)3和过量的氨水反应答案 D解析 Al跟NaOH溶液共热生成NaAlO2,得不到氢氧化铝,故A错误;氢氧化铝是两性氢氧化物,溶于强酸或强碱,Al(NO3)3跟过量的NaOH溶液反应生成NaAlO2,得不到氢氧化铝,故B错误;氧化铝不溶于水,不能与水反应生成氢氧化铝,故C错误;Al2(SO4)3和过量的氨水反应可以得到氢氧化铝,氢氧化铝不溶于弱碱,故D正确。4.下列有关金属镁的说法不正确的是( )A.Mg在CO2中燃烧生成MgO和C,是放热反应B.工业上通过电解MgCl2溶液制取金属镁C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率D.镁可以用来制造信号弹和焰火,MgO可以作耐高温材料答案 B解析 金属Mg可以在CO2中燃烧生成MgO和C,同时放出大量的热,A正确;工业上通过电解熔融MgCl2来制取金属镁,B错误;Mg和稀硫酸反应时,滴加少量硫酸铜溶液,Mg置换出Cu,形成原电池,化学反应速率加快,C正确;Mg在空气中燃烧发出耀眼的白光,常用来制造信号弹和焰火,MgO的熔点很高,常用作耐高温材料,D正确。5.[2017·山东重点中学联考]下列物质组合中,既能和酸反应又能和碱反应的化合物共有( )①(NH4)2CO3 ②Al2O3 ③Al2(SO4)3 ④Al ⑤NaHSO3 ⑥Al(OH)3A.3种 B.4种 C.5种 D.6种答案 B解析 Al为单质,排除④;(NH4)2CO3与酸反应生成CO2,与碱反应生成NH3;Al2O3、Al(OH)3为两性物质,均能与强酸、强碱反应;NaHSO3与酸反应生成SO2,与碱反应生成Na2SO3;Al2(SO4)3只能与碱反应,不能与酸反应。故既能与酸反应也能与碱反应的化合物是①②⑤⑥,B正确。6.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )选项陈述Ⅰ陈述Ⅱ判断A铝制炊具最好不要盛放酸性或碱性较强的液体食物Al和Al2O3既可以与酸反应又可以与碱反应Ⅰ对,Ⅱ对,有B铝箔在酒精灯火焰上加热熔化但不滴落铝箔对熔化的铝有较强的吸附作用Ⅰ对,Ⅱ对,有C海啸使水源发生污染可用明矾进行消毒和净化明矾水解生成Al(OH)3胶体,具有吸附性Ⅰ对,Ⅱ错,无D铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸铁和铝不能与浓硫酸或浓硝酸反应Ⅰ错,Ⅱ对,无 答案 A解析 铝箔在酒精灯火焰上加热熔化但不滴落是因为Al2O3的熔点高于金属Al,故B错;明矾水解产生Al(OH)3胶体,可净化水,但不能进行消毒,故C错;铁、铝遇浓硫酸、浓硝酸钝化,并不是不反应,故D错。7.镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是( )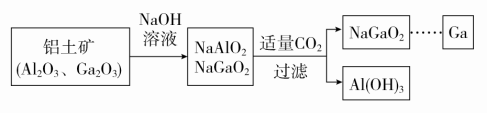 A.Al、Ga均处于第ⅢA族B.Ga2O3可与盐酸反应生成GaCl3C.Ga(OH)3可与NaOH溶液反应生成NaGaO2D.由流程图可知酸性:Al(OH)3>Ga(OH)3答案 D解析 镓(Ga)与铝同主族,均位于第ⅢA族,A正确;Ga2O3与Al2O3的性质具有相似性,可与盐酸反应生成GaCl3,B正确;Ga(OH)3与Al(OH)3的性质相似,属于两性氢氧化物,能与NaOH溶液反应生成NaGaO2,C正确;化学反应遵循强酸制弱酸原理,在NaAlO2和NaGaO2的混合溶液中通入CO2,有Al(OH)3生成,而无Ga(OH)3生成,可能是Ga(OH)3酸性强于碳酸,则酸性:Al(OH)3<Ga(OH)3,D错误。8.[2017·山西大学附中模拟]工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如图所示。
A.Al、Ga均处于第ⅢA族B.Ga2O3可与盐酸反应生成GaCl3C.Ga(OH)3可与NaOH溶液反应生成NaGaO2D.由流程图可知酸性:Al(OH)3>Ga(OH)3答案 D解析 镓(Ga)与铝同主族,均位于第ⅢA族,A正确;Ga2O3与Al2O3的性质具有相似性,可与盐酸反应生成GaCl3,B正确;Ga(OH)3与Al(OH)3的性质相似,属于两性氢氧化物,能与NaOH溶液反应生成NaGaO2,C正确;化学反应遵循强酸制弱酸原理,在NaAlO2和NaGaO2的混合溶液中通入CO2,有Al(OH)3生成,而无Ga(OH)3生成,可能是Ga(OH)3酸性强于碳酸,则酸性:Al(OH)3<Ga(OH)3,D错误。8.[2017·山西大学附中模拟]工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如图所示。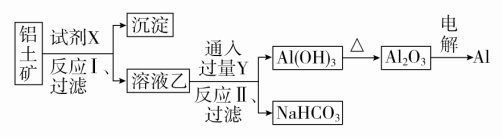 对上述流程中的判断正确的是( )①试剂X为稀硫酸,沉淀中含有硅的化合物②反应Ⅱ中生成Al(OH)3的反应为CO2+AlO+2H2O===Al(OH)3↓+HCO③结合质子(H+)的能力由强到弱的顺序是OH->AlO>CO④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼AlA.①② B.②③ C.①④ D.③④答案 B解析 由溶液乙通入过量的Y生成氢氧化铝沉淀和碳酸氢钠可知,溶液乙中含有AlO,气体Y为二氧化碳,故试剂X为氢氧化钠溶液,不可能为硫酸,故①错误;过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为CO2+AlO+2H2O===Al(OH)3↓+HCO,故②正确;结合质子的能力就是指碱性强弱,碱性:OH->AlO>CO,所以结合质子的能力:OH->AlO>CO,故③正确;AlCl3是共价化合物,熔融时不能电离出Al3+,电解熔融的AlCl3不能获得金属铝,故④错误。9.a g镁铝合金投入x mL 2 mol·L-1的盐酸中,金属完全溶解,再加入y mL 1 mol·L-1 NaOH溶液,沉淀达到最大值,质量为(a+1.7) g,则下列说法不正确的是( )A.镁铝合金与盐酸反应转移电子数为0.1NAB.沉淀为Mg(OH)2和Al(OH)3的混合物C.x=2yD.a的取值范围为0.9<a<1.2答案 C解析 Mg、Al失去电子变为离子,离子再结合OH-生成沉淀,则镁铝合金与盐酸反应转移电子的物质的量等于其生成沉淀时结合的OH-的物质的量,沉淀量最大时得到Mg(OH)2和Al(OH)3的混合物,则m(OH-)=(a+1.7) g-a g=1.7 g,n(OH-)=0.1 mol,电子转移总数是0.1NA,A、B正确;沉淀量最大时,溶液中n(Na+)=n(Cl-),此时HCl和氢氧化钠的物质的量相等,即2x=y,C错误;电子转移总数是0.1NA,若金属全部是镁,则镁的质量是1.2 g,若金属全部是铝,则铝的质量是0.9 g,D正确。10.向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的物质的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
对上述流程中的判断正确的是( )①试剂X为稀硫酸,沉淀中含有硅的化合物②反应Ⅱ中生成Al(OH)3的反应为CO2+AlO+2H2O===Al(OH)3↓+HCO③结合质子(H+)的能力由强到弱的顺序是OH->AlO>CO④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼AlA.①② B.②③ C.①④ D.③④答案 B解析 由溶液乙通入过量的Y生成氢氧化铝沉淀和碳酸氢钠可知,溶液乙中含有AlO,气体Y为二氧化碳,故试剂X为氢氧化钠溶液,不可能为硫酸,故①错误;过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为CO2+AlO+2H2O===Al(OH)3↓+HCO,故②正确;结合质子的能力就是指碱性强弱,碱性:OH->AlO>CO,所以结合质子的能力:OH->AlO>CO,故③正确;AlCl3是共价化合物,熔融时不能电离出Al3+,电解熔融的AlCl3不能获得金属铝,故④错误。9.a g镁铝合金投入x mL 2 mol·L-1的盐酸中,金属完全溶解,再加入y mL 1 mol·L-1 NaOH溶液,沉淀达到最大值,质量为(a+1.7) g,则下列说法不正确的是( )A.镁铝合金与盐酸反应转移电子数为0.1NAB.沉淀为Mg(OH)2和Al(OH)3的混合物C.x=2yD.a的取值范围为0.9<a<1.2答案 C解析 Mg、Al失去电子变为离子,离子再结合OH-生成沉淀,则镁铝合金与盐酸反应转移电子的物质的量等于其生成沉淀时结合的OH-的物质的量,沉淀量最大时得到Mg(OH)2和Al(OH)3的混合物,则m(OH-)=(a+1.7) g-a g=1.7 g,n(OH-)=0.1 mol,电子转移总数是0.1NA,A、B正确;沉淀量最大时,溶液中n(Na+)=n(Cl-),此时HCl和氢氧化钠的物质的量相等,即2x=y,C错误;电子转移总数是0.1NA,若金属全部是镁,则镁的质量是1.2 g,若金属全部是铝,则铝的质量是0.9 g,D正确。10.向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的物质的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )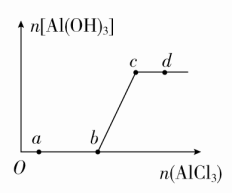 A.a点对应的溶液中:Na+、Mg2+、SO、HCOB.b点对应的溶液中:Na+、NH、SO、Cl-C.c点对应的溶液中:Ag+、Ca2+、NO、Cl-D.d点对应的溶液中:K+、NH、I-、SO答案 D解析 向NaOH溶液中逐滴加入AlCl3溶液,依次发生反应:Al3++4OH-===AlO+2H2O、3AlO+6H2O+Al3+===4Al(OH)3↓。a点时溶液中有大量OH-,与Mg2+、HCO不能大量共存,A错误;b点时溶质为NaCl和NaAlO2,AlO与NH不能大量共存,B错误;c点时溶质为NaCl,Cl-与Ag+不能大量共存,C错误;d点时溶质为NaCl和AlCl3,所有离子可以大量共存,D正确。11.某无色溶液含有下列离子中的若干种:H+、NH、Cu2+、Ba2+、Al3+、CO、Cl-、OH-、NO。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )A.3种 B.4种 C.5种 D.6种答案 C解析 Cu2+在溶液中为蓝色,则溶液中一定不含有Cu2+。能与铝粉反应放出H2,则溶液中含有H+或OH-。若溶液中含有H+,则不含CO、OH-、NO,一定含有Cl-,可能含有NH、Ba2+、Al3+。若溶液中含有OH-,则不含H+、NH、Al3+,结合溶液呈电中性知,一定含有Ba2+,一定不含CO,可能含有Cl-、NO。综上所述,溶液中能大量存在的离子最多有5种。12.有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )
A.a点对应的溶液中:Na+、Mg2+、SO、HCOB.b点对应的溶液中:Na+、NH、SO、Cl-C.c点对应的溶液中:Ag+、Ca2+、NO、Cl-D.d点对应的溶液中:K+、NH、I-、SO答案 D解析 向NaOH溶液中逐滴加入AlCl3溶液,依次发生反应:Al3++4OH-===AlO+2H2O、3AlO+6H2O+Al3+===4Al(OH)3↓。a点时溶液中有大量OH-,与Mg2+、HCO不能大量共存,A错误;b点时溶质为NaCl和NaAlO2,AlO与NH不能大量共存,B错误;c点时溶质为NaCl,Cl-与Ag+不能大量共存,C错误;d点时溶质为NaCl和AlCl3,所有离子可以大量共存,D正确。11.某无色溶液含有下列离子中的若干种:H+、NH、Cu2+、Ba2+、Al3+、CO、Cl-、OH-、NO。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )A.3种 B.4种 C.5种 D.6种答案 C解析 Cu2+在溶液中为蓝色,则溶液中一定不含有Cu2+。能与铝粉反应放出H2,则溶液中含有H+或OH-。若溶液中含有H+,则不含CO、OH-、NO,一定含有Cl-,可能含有NH、Ba2+、Al3+。若溶液中含有OH-,则不含H+、NH、Al3+,结合溶液呈电中性知,一定含有Ba2+,一定不含CO,可能含有Cl-、NO。综上所述,溶液中能大量存在的离子最多有5种。12.有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )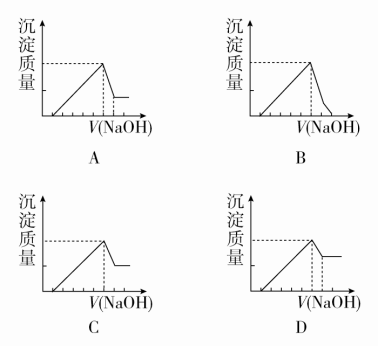 答案 A解析 镁与铝的质量比是8∶9,则物质的量之比是1∶1,NaOH溶液过量后Al(OH)3完全溶解,只有Mg(OH)2,B错误;等物质的量的Mg(OH)2与Al(OH)3的质量之比是58∶78,即剩余的Mg(OH)2的质量小于沉淀最大质量的,排除C、D,故选A。二、非选择题(共28分)13.[2017·云南高中统一检测](14分)铝(熔点660 ℃)是一种应用广泛的金属,工业上用Al2O3(熔点2045 ℃)和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰,铝与V2O5在高温下反应的化学方程式为_________________________________________________________________________________________。(2)将打磨过的铝片在酒精灯火焰上加热,可观察到铝熔化而不滴落,原因是____________________________________________;铝是活泼金属,但打磨过的铝片投入沸水中不易观察到有气泡产生。若将铝片用饱和Hg(NO3)2溶液浸泡数分钟,取出后迅速洗净,可制得俗称“铝汞齐”的铝汞合金。铝汞齐露置在空气中,表面会快速生长出蓬松的白毛(Al2O3)。若将新制的铝汞齐放入水中,可迅速反应产生气泡,该反应的化学方程式为________________________________;铝汞齐的化学性质变得“活泼”的原因可能是____________________________________________________。(3)饮用水中的NO对人体健康会产生危害。为了降低饮用水中NO的浓度,有研究人员建议在碱性条件下用铝粉将NO还原为N2,该反应的离子方程式为________________________________________________________。(4)将0.1 mol·L-1 AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为______________________________________________。答案 (1)10Al+3V2O55Al2O3+6V(2)铝表面很快形成致密氧化膜,其熔点高于铝 2Al+6H2O===2Al(OH)3+3H2↑ 其表面不易形成致密的氧化膜(合理即可)(3)10Al+6NO+4OH-===3N2↑+10AlO+2H2O(4)AlCl3+6NH4F===(NH4)3AlF6+3NH4Cl解析 (1)金属铝作还原剂化合价升高生成Al2O3,V2O5作氧化剂化合价降低生成V。(2)Al2O3的熔点高于金属铝,所以铝熔化而不滴落;金属铝与水发生置换反应:2Al+6H2O===2Al(OH)3+3H2↑;单质铝的化学性质活泼,会与O2迅速反应生成Al2O3致密氧化膜,阻碍Al与H2O发生反应,当制成铝汞齐后,Al与O2反应生成蓬松的Al2O3,此时将其放入水中,Al与H2O接触发生反应生成H2。(3)金属铝作还原剂在碱性条件下生成AlO,硝酸根离子作氧化剂被还原为N2,再根据氧化还原方程式配平原则配平离子方程式。(4)加入氨水后,无沉淀生成,说明溶液中不存在Al3+,依据元素守恒和冰晶石的化学式,可写出反应的化学方程式。14.[2017·湖南百所重点中学段考](14分)某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案验证产物并探究反应原理。实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变为红色。(1)该小组对反应中产生的白色不溶物作出如下假设:假设1:可能为_______________________________________。假设2:可能为MgCO3。假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。(2)设计定性实验确定产物并验证假设:实验序号实验预期现象和结论实验Ⅱ将实验Ⅰ中收集到的气体点燃______①______实验Ⅲ取实验Ⅰ中的白色不溶物,洗涤,加入足量__②__产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3实验Ⅳ取实验Ⅰ中的澄清液,向其中加入少量CaCl2溶液产生白色沉淀;说明溶液中存在的离子有__③__ (3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物6.20 g,充分加热灼烧至不再产生气体为止,并使分解产生的气体全部进入装置A(盛足量浓硫酸)和B(盛足量碱石灰)中,装置A增重0.36 g,装置B增重2.64 g,则白色不溶物的化学式为________。答案 (1)Mg(OH)2(2)①能安静燃烧、产生淡蓝色火焰,证明该气体为氢气 ②稀盐酸(或稀硫酸) ③CO(3)3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3]解析 (1)根据假设2和3,推出假设1:白色不溶物可能为Mg(OH)2。(2)①HCO在水中存在水解平衡和电离平衡:HCO+H2OH2CO3+OH-、HCOH++CO,Mg和OH-不反应,Mg和H+反应产生氢气,因此气体可能为氢气,若气体点燃后能安静燃烧、产生淡蓝色火焰,则该气体为氢气。②根据假设,应加入足量的稀盐酸或稀硫酸,沉淀全部消失,且产生气体,说明沉淀中含有碳酸镁。③加入CaCl2溶液,出现沉淀,说明溶液中含有CO。(3)浓硫酸的作用是吸收水蒸气,根据H元素守恒,可得n[Mg(OH)2]=n(H2O)==0.02 mol,碱石灰的作用是吸收CO2,根据C元素守恒,可得n(MgCO3)=n(CO2)==0.06 mol,因此MgCO3∶Mg(OH)2=0.06∶0.02=3∶1,化学式为3MgCO3·Mg(OH)2或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3。
答案 A解析 镁与铝的质量比是8∶9,则物质的量之比是1∶1,NaOH溶液过量后Al(OH)3完全溶解,只有Mg(OH)2,B错误;等物质的量的Mg(OH)2与Al(OH)3的质量之比是58∶78,即剩余的Mg(OH)2的质量小于沉淀最大质量的,排除C、D,故选A。二、非选择题(共28分)13.[2017·云南高中统一检测](14分)铝(熔点660 ℃)是一种应用广泛的金属,工业上用Al2O3(熔点2045 ℃)和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰,铝与V2O5在高温下反应的化学方程式为_________________________________________________________________________________________。(2)将打磨过的铝片在酒精灯火焰上加热,可观察到铝熔化而不滴落,原因是____________________________________________;铝是活泼金属,但打磨过的铝片投入沸水中不易观察到有气泡产生。若将铝片用饱和Hg(NO3)2溶液浸泡数分钟,取出后迅速洗净,可制得俗称“铝汞齐”的铝汞合金。铝汞齐露置在空气中,表面会快速生长出蓬松的白毛(Al2O3)。若将新制的铝汞齐放入水中,可迅速反应产生气泡,该反应的化学方程式为________________________________;铝汞齐的化学性质变得“活泼”的原因可能是____________________________________________________。(3)饮用水中的NO对人体健康会产生危害。为了降低饮用水中NO的浓度,有研究人员建议在碱性条件下用铝粉将NO还原为N2,该反应的离子方程式为________________________________________________________。(4)将0.1 mol·L-1 AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为______________________________________________。答案 (1)10Al+3V2O55Al2O3+6V(2)铝表面很快形成致密氧化膜,其熔点高于铝 2Al+6H2O===2Al(OH)3+3H2↑ 其表面不易形成致密的氧化膜(合理即可)(3)10Al+6NO+4OH-===3N2↑+10AlO+2H2O(4)AlCl3+6NH4F===(NH4)3AlF6+3NH4Cl解析 (1)金属铝作还原剂化合价升高生成Al2O3,V2O5作氧化剂化合价降低生成V。(2)Al2O3的熔点高于金属铝,所以铝熔化而不滴落;金属铝与水发生置换反应:2Al+6H2O===2Al(OH)3+3H2↑;单质铝的化学性质活泼,会与O2迅速反应生成Al2O3致密氧化膜,阻碍Al与H2O发生反应,当制成铝汞齐后,Al与O2反应生成蓬松的Al2O3,此时将其放入水中,Al与H2O接触发生反应生成H2。(3)金属铝作还原剂在碱性条件下生成AlO,硝酸根离子作氧化剂被还原为N2,再根据氧化还原方程式配平原则配平离子方程式。(4)加入氨水后,无沉淀生成,说明溶液中不存在Al3+,依据元素守恒和冰晶石的化学式,可写出反应的化学方程式。14.[2017·湖南百所重点中学段考](14分)某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案验证产物并探究反应原理。实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变为红色。(1)该小组对反应中产生的白色不溶物作出如下假设:假设1:可能为_______________________________________。假设2:可能为MgCO3。假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。(2)设计定性实验确定产物并验证假设:实验序号实验预期现象和结论实验Ⅱ将实验Ⅰ中收集到的气体点燃______①______实验Ⅲ取实验Ⅰ中的白色不溶物,洗涤,加入足量__②__产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3实验Ⅳ取实验Ⅰ中的澄清液,向其中加入少量CaCl2溶液产生白色沉淀;说明溶液中存在的离子有__③__ (3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物6.20 g,充分加热灼烧至不再产生气体为止,并使分解产生的气体全部进入装置A(盛足量浓硫酸)和B(盛足量碱石灰)中,装置A增重0.36 g,装置B增重2.64 g,则白色不溶物的化学式为________。答案 (1)Mg(OH)2(2)①能安静燃烧、产生淡蓝色火焰,证明该气体为氢气 ②稀盐酸(或稀硫酸) ③CO(3)3MgCO3·Mg(OH)2[或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3]解析 (1)根据假设2和3,推出假设1:白色不溶物可能为Mg(OH)2。(2)①HCO在水中存在水解平衡和电离平衡:HCO+H2OH2CO3+OH-、HCOH++CO,Mg和OH-不反应,Mg和H+反应产生氢气,因此气体可能为氢气,若气体点燃后能安静燃烧、产生淡蓝色火焰,则该气体为氢气。②根据假设,应加入足量的稀盐酸或稀硫酸,沉淀全部消失,且产生气体,说明沉淀中含有碳酸镁。③加入CaCl2溶液,出现沉淀,说明溶液中含有CO。(3)浓硫酸的作用是吸收水蒸气,根据H元素守恒,可得n[Mg(OH)2]=n(H2O)==0.02 mol,碱石灰的作用是吸收CO2,根据C元素守恒,可得n(MgCO3)=n(CO2)==0.06 mol,因此MgCO3∶Mg(OH)2=0.06∶0.02=3∶1,化学式为3MgCO3·Mg(OH)2或Mg(OH)2·3MgCO3或Mg4(OH)2(CO3)3。
相关试卷
这是一份高考化学一轮复习检测:第4章 非金属及其化合物4-4a Word版含解析,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份高考化学一轮复习检测:第4章 非金属及其化合物4-3a Word版含解析,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份高考化学一轮复习检测:第4章 非金属及其化合物4-2a Word版含解析,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









