


所属成套资源:高考化学一轮复习检测 含解析
高考化学一轮复习检测:第5章 物质结构 元素周期律5-3a Word版含解析
展开
这是一份高考化学一轮复习检测:第5章 物质结构 元素周期律5-3a Word版含解析,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
![]() 板块三 限时规范特训
板块三 限时规范特训![]() 时间:45分钟
时间:45分钟 ![]() 满分:100分一、选择题(每题6分,共72分)1.[2017·兰州一中高三月考]下列关于化学键的说法正确的是( )A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键B.不同元素的原子构成的分子不一定只含极性共价键C.含极性键的共价化合物一定是电解质D.HF的分子间作用力大于HCl,故HF比HCl更稳定答案 B解析 (NH2)2CO(尿素)中只含共价键,A项错误;H2O2中含有O—O非极性键,B项正确;CO中的化学键为极性键,但CO是非电解质,C项错误;分子间作用力与分子稳定性无关,HF的键能大于HCl,所以HF比HCl更稳定,D项错误。2.[2017·长春高三质检]下列物质的电子式书写正确的是( )
满分:100分一、选择题(每题6分,共72分)1.[2017·兰州一中高三月考]下列关于化学键的说法正确的是( )A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键B.不同元素的原子构成的分子不一定只含极性共价键C.含极性键的共价化合物一定是电解质D.HF的分子间作用力大于HCl,故HF比HCl更稳定答案 B解析 (NH2)2CO(尿素)中只含共价键,A项错误;H2O2中含有O—O非极性键,B项正确;CO中的化学键为极性键,但CO是非电解质,C项错误;分子间作用力与分子稳定性无关,HF的键能大于HCl,所以HF比HCl更稳定,D项错误。2.[2017·长春高三质检]下列物质的电子式书写正确的是( ) 答案 A解析 B项,NH的电子式为
答案 A解析 B项,NH的电子式为 ,错误;C项,氯化氢为共价化合物,应为
,错误;C项,氯化氢为共价化合物,应为 ,错误;D项,二氧化碳分子中每个O与C之间形成两对共用电子对,应为
,错误;D项,二氧化碳分子中每个O与C之间形成两对共用电子对,应为![]() ,错误。3.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )A.2种 B.3种 C.4种 D.5种答案 C解析 Na熔化时破坏金属键,Na2O、Na2S是只含离子键的离子化合物,NaOH、Na2SO4是既含离子键又含极性键的离子化合物,离子化合物熔化时只破坏离子键,所以分别加热熔化上述五种物质,需克服相同类型作用力的物质有4种。4.[2018·湖北宜城一中月考]下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )A.10与19 B.6与16C.11与17 D.14与8答案 C解析 A项,10号元素是Ne,是惰性气体,不能形成化合物,错误;B项,形成的化合物是CS2,是以共价键结合形成的共价化合物,错误;C项,形成的化合物是NaCl,是以离子键相互结合的离子化合物,正确;D项,形成的化合物是SiO2,属于共价化合物,错误。5.固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的值)B.NH5中既有共价键又有离子键C.NH5的电子式为
,错误。3.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )A.2种 B.3种 C.4种 D.5种答案 C解析 Na熔化时破坏金属键,Na2O、Na2S是只含离子键的离子化合物,NaOH、Na2SO4是既含离子键又含极性键的离子化合物,离子化合物熔化时只破坏离子键,所以分别加热熔化上述五种物质,需克服相同类型作用力的物质有4种。4.[2018·湖北宜城一中月考]下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )A.10与19 B.6与16C.11与17 D.14与8答案 C解析 A项,10号元素是Ne,是惰性气体,不能形成化合物,错误;B项,形成的化合物是CS2,是以共价键结合形成的共价化合物,错误;C项,形成的化合物是NaCl,是以离子键相互结合的离子化合物,正确;D项,形成的化合物是SiO2,属于共价化合物,错误。5.固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的值)B.NH5中既有共价键又有离子键C.NH5的电子式为 D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑答案 A解析 由“NH5”的结构知其为离子化合物(NH4H),既含有共价键,又含有离子键,1 mol NH5中含有4NA个N—H 键,A错误,B、C正确;NH4H中-1价的氢离子与H2O中+1价的氢发生归中反应生成H2,D正确。6.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑答案 A解析 由“NH5”的结构知其为离子化合物(NH4H),既含有共价键,又含有离子键,1 mol NH5中含有4NA个N—H 键,A错误,B、C正确;NH4H中-1价的氢离子与H2O中+1价的氢发生归中反应生成H2,D正确。6.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )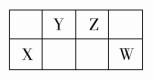 A.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W答案 C解析 设Z的原子序数为a,则Y、W的原子序数分别为a-1和a+9,由题意可知(a-1)+(a+9)=3a,解得a=8,则Y、Z、X、W分别为N、O、Si、Cl。原子半径:X(Si)>Y(N)>Z(O),A项错误;同周期主族元素的非金属性从左向右依次增强,同主族元素的非金属性从上到下依次减弱,非金属性越强,气态氢化物的稳定性越强,故气态氢化物的稳定性:Z>X(即H2O>SiH4),B项错误;MgO和MgCl2均为离子化合物,C项正确;Cl元素对应最高价氧化物的水化物HClO4为最强酸,D项错误。7.下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
A.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W答案 C解析 设Z的原子序数为a,则Y、W的原子序数分别为a-1和a+9,由题意可知(a-1)+(a+9)=3a,解得a=8,则Y、Z、X、W分别为N、O、Si、Cl。原子半径:X(Si)>Y(N)>Z(O),A项错误;同周期主族元素的非金属性从左向右依次增强,同主族元素的非金属性从上到下依次减弱,非金属性越强,气态氢化物的稳定性越强,故气态氢化物的稳定性:Z>X(即H2O>SiH4),B项错误;MgO和MgCl2均为离子化合物,C项正确;Cl元素对应最高价氧化物的水化物HClO4为最强酸,D项错误。7.下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )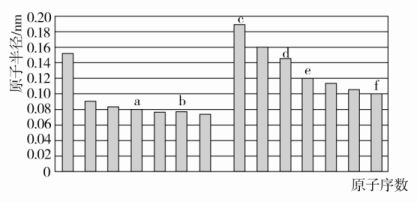 A.a的单质在高温条件下能置换出e的单质,说明非金属性a<eB.b、d两种元素的离子半径相比,前者较大C.由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应D.c、d分别与f组成的化合物中的化学键类型相同答案 B解析 根据同周期主族元素从左到右原子半径依次减小的规律,结合关系图可知a、b、c、d、e、f分别为C、O、Na、Al、Si、Cl。非金属性:C>Si,碳在高温下能与二氧化硅发生反应:2C+SiO2Si+2CO↑,是因为该反应体系中只有CO是气体,CO能从反应体系中逸出,促使反应进行,不能说明碳的非金属性强于硅的非金属性,A项错误;O2-与Al3+核外电子层结构相同,核电荷数小的离子半径大,B项正确;b、e组成的化合物为SiO2,SiO2能与HF溶液反应,C项错误;NaCl为离子化合物,而AlCl3为共价化合物,D项错误。8.[2017·浙江温州模拟]下列说法正确的是( )A.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力B.硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电C.N2、CO2和SiO2中都存在共价键,它们都是由分子构成D.H2和Cl2在光照条件下反应生成HCl,反应中一定有共价键的断裂和形成答案 D解析 A项,碘晶体受热转变为碘蒸气,吸收的热量用于克服分子间作用力,碘原子间是共价键,错误;B项,硫酸是共价化合物,在熔融状态下不能导电,错误;C项,N2、CO2和SiO2中都存在共价键,N2、CO2都是由分子构成,SiO2是由原子构成,错误;D项,氢气、氯气和氯化氢中均含有共价键,因此反应中一定有共价键的断裂和形成,正确。9.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是 ( )A.四种元素中,d元素的非金属性最强B.它们均存在两种或两种以上的氧化物C.只有a与其他三种元素生成的化合物都是离子化合物D.b、c、d分别与氢形成的化合物中化学键均为极性共价键答案 D解析 a的M层有1个电子,即a为Na;b最外层电子数为内层电子数的2倍,最外层只能为4个电子,即b为C;c的最高化合价是最低化合价绝对值的3倍,即c的最高化合价和最低化合价分别为+6和-2,c为S;第三周期中原子半径比S小的只能是Cl,即d为Cl。A项,四种元素中,Cl的非金属性最强,正确;B项,存在Na2O和Na2O2、CO和CO2、SO2和SO3、ClO2和Cl2O7等氧化物,正确;C项,Na与C、S、Cl形成的化合物均为离子化合物,正确;D项,C与H形成的烃中一定含有极性键,但也可能含有非极性键,错误。10.[2017·广东深圳一模]短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
A.a的单质在高温条件下能置换出e的单质,说明非金属性a<eB.b、d两种元素的离子半径相比,前者较大C.由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应D.c、d分别与f组成的化合物中的化学键类型相同答案 B解析 根据同周期主族元素从左到右原子半径依次减小的规律,结合关系图可知a、b、c、d、e、f分别为C、O、Na、Al、Si、Cl。非金属性:C>Si,碳在高温下能与二氧化硅发生反应:2C+SiO2Si+2CO↑,是因为该反应体系中只有CO是气体,CO能从反应体系中逸出,促使反应进行,不能说明碳的非金属性强于硅的非金属性,A项错误;O2-与Al3+核外电子层结构相同,核电荷数小的离子半径大,B项正确;b、e组成的化合物为SiO2,SiO2能与HF溶液反应,C项错误;NaCl为离子化合物,而AlCl3为共价化合物,D项错误。8.[2017·浙江温州模拟]下列说法正确的是( )A.碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力B.硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电C.N2、CO2和SiO2中都存在共价键,它们都是由分子构成D.H2和Cl2在光照条件下反应生成HCl,反应中一定有共价键的断裂和形成答案 D解析 A项,碘晶体受热转变为碘蒸气,吸收的热量用于克服分子间作用力,碘原子间是共价键,错误;B项,硫酸是共价化合物,在熔融状态下不能导电,错误;C项,N2、CO2和SiO2中都存在共价键,N2、CO2都是由分子构成,SiO2是由原子构成,错误;D项,氢气、氯气和氯化氢中均含有共价键,因此反应中一定有共价键的断裂和形成,正确。9.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是 ( )A.四种元素中,d元素的非金属性最强B.它们均存在两种或两种以上的氧化物C.只有a与其他三种元素生成的化合物都是离子化合物D.b、c、d分别与氢形成的化合物中化学键均为极性共价键答案 D解析 a的M层有1个电子,即a为Na;b最外层电子数为内层电子数的2倍,最外层只能为4个电子,即b为C;c的最高化合价是最低化合价绝对值的3倍,即c的最高化合价和最低化合价分别为+6和-2,c为S;第三周期中原子半径比S小的只能是Cl,即d为Cl。A项,四种元素中,Cl的非金属性最强,正确;B项,存在Na2O和Na2O2、CO和CO2、SO2和SO3、ClO2和Cl2O7等氧化物,正确;C项,Na与C、S、Cl形成的化合物均为离子化合物,正确;D项,C与H形成的烃中一定含有极性键,但也可能含有非极性键,错误。10.[2017·广东深圳一模]短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )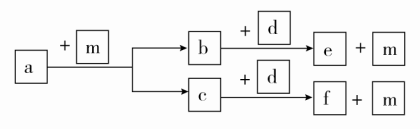 A.简单离子半径:Z<YB.阴离子的还原性:Y>WC.简单气态氢化物的热稳定性:Y>XD.W2Y2中含有非极性键答案 B解析 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,则d为Na2O2,结合图中转化关系可知,元素Y的单质气体m为O2,则Y为O,a为烃,b、c分别为CO2、H2O,e、f分别为Na2CO3、NaOH,结合原子序数可知,W为H,X为C,Y为O,Z为Na。O2-、Na+具有相同电子层结构,原子序数大的离子半径小,则简单离子半径:Na+<O2-,故A正确;由NaH+H2O===NaOH+H2↑,可知H-易失去电子,阴离子的还原性:O2-<H-,故B错误;元素的非金属性越强,对应简单气态氢化物越稳定,则简单气态氢化物的热稳定性:H2O>CH4,故C正确;H2O2中含有O—O非极性键,故D正确。11.X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L,W的质子数是X、Y、Z、M四种元素质子数之和的。下列说法正确的是 ( )A.原子半径:W>Z>Y>X>MB.XZ2、X2M2、W2Z2均为共价化合物C.由X元素形成的单质不一定能导电D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键答案 C解析 由X、Y、Z三种元素是原子序数依次增大的同周期元素,且X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2型分子,可推出X、Y、Z分别为C、N、O;根据Y与M形成的气态化合物在标准状况下的密度为0.76 g/L,可计算出该气态化合物的摩尔质量为22.4 L/mol×0.76 g/L=17 g/mol,从而确定M为H;根据W的质子数是X、Y、Z、M四种元素质子数之和的,可推出W的质子数为(6+7+8+1)÷2=11,所以W为Na。原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),A项错误;CO2、C2H2均为共价化合物,而Na2O2是离子化合物,B项错误;碳的同素异形体很多,石墨可以导电,而金刚石不导电,C项正确;C、N、O、H四种元素可形成化合物(NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,CO(NH2)2为共价化合物,其中不含离子键,D项错误。12.[2017·湖北重点中学联考]A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质,已知:甲+乙===丁+辛,甲+丙===戊+辛;常温下0.1 mol/L丁溶液的pH为13,则下列说法正确的是( )A.元素C形成的单质可以在点燃条件下分别与元素A、B、D形成的单质化合,所得化合物均存在共价键B.元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B)C.1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 molD.1 mol甲与足量的乙完全反应共转移约1.204×1024个电子答案 A解析 常温下0.1 mol/L丁溶液的pH为13,则丁是一元强碱,其所含金属元素在短周期中,则丁为NaOH;根据反应甲+乙===丁+辛及元素守恒可知,甲、乙两种物质中至少共含有Na、O、H三种元素;辛是C元素形成的单质,由反应甲+丙===戊+辛可知,辛不可能是Na,结合原子序数的关系推知,A为氢元素,C为氧元素,D为钠元素,故辛为O2,甲为Na2O2,乙是H2O。再结合反应甲+丙===戊+辛可知,丙是CO2,戊是Na2CO3,则B为碳元素。O2与H2、C反应生成的化合物中只含有共价键,O2与Na在点燃条件下反应生成Na2O2,含有离子键和共价键,A正确;同周期主族元素的原子半径从左到右逐渐减小,同主族元素的原子半径自上而下逐渐增大,故原子半径大小关系为r(Na)>r(C)>r(O),B错误;戊是Na2CO3,CO发生水解反应:CO+H2OHCO+OH-,所含阴离子数目增多,故1.0 L 0.1 mol/L Na2CO3溶液中阴离子总物质的量大于0.1 mol,C错误;甲与足量乙发生的反应为2Na2O2+2H2O===4NaOH+O2↑,其中Na2O2既是氧化剂又是还原剂,故1 mol Na2O2与足量水反应时,转移1 mol电子(即6.02×1023个),D错误。二、非选择题(共28分)13.(16分)(1)请用以下物质的序号填空:①NaCl ②Na2O2 ③NaOH ④AlCl3 ⑤H2O2 ⑥N2 ⑦NH4Cl ⑧CO2 ⑨He ⑩P4其中只含有共价键的化合物有________,含有非极性共价键的离子化合物有________,含有极性共价键的离子化合物有________,不含共价键的化合物有________。(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为________;若XY2为共价化合物时,其结构式为________。(3)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
A.简单离子半径:Z<YB.阴离子的还原性:Y>WC.简单气态氢化物的热稳定性:Y>XD.W2Y2中含有非极性键答案 B解析 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,则d为Na2O2,结合图中转化关系可知,元素Y的单质气体m为O2,则Y为O,a为烃,b、c分别为CO2、H2O,e、f分别为Na2CO3、NaOH,结合原子序数可知,W为H,X为C,Y为O,Z为Na。O2-、Na+具有相同电子层结构,原子序数大的离子半径小,则简单离子半径:Na+<O2-,故A正确;由NaH+H2O===NaOH+H2↑,可知H-易失去电子,阴离子的还原性:O2-<H-,故B错误;元素的非金属性越强,对应简单气态氢化物越稳定,则简单气态氢化物的热稳定性:H2O>CH4,故C正确;H2O2中含有O—O非极性键,故D正确。11.X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L,W的质子数是X、Y、Z、M四种元素质子数之和的。下列说法正确的是 ( )A.原子半径:W>Z>Y>X>MB.XZ2、X2M2、W2Z2均为共价化合物C.由X元素形成的单质不一定能导电D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键答案 C解析 由X、Y、Z三种元素是原子序数依次增大的同周期元素,且X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2型分子,可推出X、Y、Z分别为C、N、O;根据Y与M形成的气态化合物在标准状况下的密度为0.76 g/L,可计算出该气态化合物的摩尔质量为22.4 L/mol×0.76 g/L=17 g/mol,从而确定M为H;根据W的质子数是X、Y、Z、M四种元素质子数之和的,可推出W的质子数为(6+7+8+1)÷2=11,所以W为Na。原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),A项错误;CO2、C2H2均为共价化合物,而Na2O2是离子化合物,B项错误;碳的同素异形体很多,石墨可以导电,而金刚石不导电,C项正确;C、N、O、H四种元素可形成化合物(NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,CO(NH2)2为共价化合物,其中不含离子键,D项错误。12.[2017·湖北重点中学联考]A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质,已知:甲+乙===丁+辛,甲+丙===戊+辛;常温下0.1 mol/L丁溶液的pH为13,则下列说法正确的是( )A.元素C形成的单质可以在点燃条件下分别与元素A、B、D形成的单质化合,所得化合物均存在共价键B.元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B)C.1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 molD.1 mol甲与足量的乙完全反应共转移约1.204×1024个电子答案 A解析 常温下0.1 mol/L丁溶液的pH为13,则丁是一元强碱,其所含金属元素在短周期中,则丁为NaOH;根据反应甲+乙===丁+辛及元素守恒可知,甲、乙两种物质中至少共含有Na、O、H三种元素;辛是C元素形成的单质,由反应甲+丙===戊+辛可知,辛不可能是Na,结合原子序数的关系推知,A为氢元素,C为氧元素,D为钠元素,故辛为O2,甲为Na2O2,乙是H2O。再结合反应甲+丙===戊+辛可知,丙是CO2,戊是Na2CO3,则B为碳元素。O2与H2、C反应生成的化合物中只含有共价键,O2与Na在点燃条件下反应生成Na2O2,含有离子键和共价键,A正确;同周期主族元素的原子半径从左到右逐渐减小,同主族元素的原子半径自上而下逐渐增大,故原子半径大小关系为r(Na)>r(C)>r(O),B错误;戊是Na2CO3,CO发生水解反应:CO+H2OHCO+OH-,所含阴离子数目增多,故1.0 L 0.1 mol/L Na2CO3溶液中阴离子总物质的量大于0.1 mol,C错误;甲与足量乙发生的反应为2Na2O2+2H2O===4NaOH+O2↑,其中Na2O2既是氧化剂又是还原剂,故1 mol Na2O2与足量水反应时,转移1 mol电子(即6.02×1023个),D错误。二、非选择题(共28分)13.(16分)(1)请用以下物质的序号填空:①NaCl ②Na2O2 ③NaOH ④AlCl3 ⑤H2O2 ⑥N2 ⑦NH4Cl ⑧CO2 ⑨He ⑩P4其中只含有共价键的化合物有________,含有非极性共价键的离子化合物有________,含有极性共价键的离子化合物有________,不含共价键的化合物有________。(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为________;若XY2为共价化合物时,其结构式为________。(3)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题: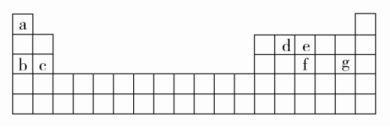 ①元素的原子间反应最容易形成离子键的是________(填选项,下同),容易形成共价键的是________。A.c和f B.b和g C.d和g D.b和e②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式________。③a与e能形成化合物ea5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,其电子式为________,其中所含化学键类型为________,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是________。答案 (1)④⑤⑧ ② ③⑦ ①(2)
①元素的原子间反应最容易形成离子键的是________(填选项,下同),容易形成共价键的是________。A.c和f B.b和g C.d和g D.b和e②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式________。③a与e能形成化合物ea5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,其电子式为________,其中所含化学键类型为________,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是________。答案 (1)④⑤⑧ ② ③⑦ ①(2) 
![]() (3)①B C ②CCl4(或PCl3)③
(3)①B C ②CCl4(或PCl3)③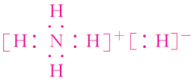 极性共价键、离子键 NH3、H2解析 (2)1∶2型离子化合物,通常X为+2价,Y为-1价,故X可能是Mg2+或Ca2+,Y可能是F-或Cl-,结合XY2中含有38个电子可推出XY2为CaF2。1∶2型共价化合物一般是碳族元素与氧族元素化合形成的,如CO2、CS2等,想到这一点就不难推出XY2为CS2。14.[2017·天津一中月考](12分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(1)B在周期表中的位置为第____周期第____族。(2)E元素形成的氧化物对应的水化物的化学式为_________。(3)元素B、C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。(4)用电子式表示化合物D2C的形成过程:____________________________________________________________________________________________________________________。(5)由A、B、C三种元素形成的离子化合物的化学式为____________,它与强碱溶液共热,发生反应的离子方程式是______________________________________。(6)D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为__________________________________________________________(化学式用具体的元素符号表示)。答案 (1)二 ⅤA(2)H2SO3、H2SO4(3)S2->N3->O2->Na+(4)
极性共价键、离子键 NH3、H2解析 (2)1∶2型离子化合物,通常X为+2价,Y为-1价,故X可能是Mg2+或Ca2+,Y可能是F-或Cl-,结合XY2中含有38个电子可推出XY2为CaF2。1∶2型共价化合物一般是碳族元素与氧族元素化合形成的,如CO2、CS2等,想到这一点就不难推出XY2为CS2。14.[2017·天津一中月考](12分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(1)B在周期表中的位置为第____周期第____族。(2)E元素形成的氧化物对应的水化物的化学式为_________。(3)元素B、C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。(4)用电子式表示化合物D2C的形成过程:____________________________________________________________________________________________________________________。(5)由A、B、C三种元素形成的离子化合物的化学式为____________,它与强碱溶液共热,发生反应的离子方程式是______________________________________。(6)D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为__________________________________________________________(化学式用具体的元素符号表示)。答案 (1)二 ⅤA(2)H2SO3、H2SO4(3)S2->N3->O2->Na+(4) ![]() (5)NH4NO3 NH+OH-NH3↑+H2O(6)4Na2SO3Na2S+3Na2SO4解析 A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E同主族,则E为S元素。(1)B是氮元素,在周期表中的位置为第二周期第ⅤA族。(2)E是硫元素,形成的氧化物SO2、SO3对应的水化物的化学式分别为H2SO3、H2SO4。(3)元素B、C、D、E形成的简单离子中,S2-有三个电子层,N3-、O2-、Na+只有两个电子层,且电子层结构相同的离子,核电荷数大的半径反而小,故离子半径大小关系是S2->N3->O2->Na+。(4)Na最外层的一个电子易失去,氧最外层有6个电子,易得到2个电子形成8电子稳定结构,故Na2O的形成过程可表示为Na
(5)NH4NO3 NH+OH-NH3↑+H2O(6)4Na2SO3Na2S+3Na2SO4解析 A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E同主族,则E为S元素。(1)B是氮元素,在周期表中的位置为第二周期第ⅤA族。(2)E是硫元素,形成的氧化物SO2、SO3对应的水化物的化学式分别为H2SO3、H2SO4。(3)元素B、C、D、E形成的简单离子中,S2-有三个电子层,N3-、O2-、Na+只有两个电子层,且电子层结构相同的离子,核电荷数大的半径反而小,故离子半径大小关系是S2->N3->O2->Na+。(4)Na最外层的一个电子易失去,氧最外层有6个电子,易得到2个电子形成8电子稳定结构,故Na2O的形成过程可表示为Na![]()
![]() Na―→Na+[]2-Na+。(5)由H、N、O形成的离子化合物的化学式为NH4NO3,它是铵盐,与强碱溶液共热,发生反应生成NH3,离子方程式是NH+OH-NH3↑+H2O。(6)Na2SO3一定条件下可以发生分解反应生成两种盐,其中一种是无氧酸盐,则为Na2S,反应的化学方程式为4Na2SO3Na2S+3Na2SO4。
Na―→Na+[]2-Na+。(5)由H、N、O形成的离子化合物的化学式为NH4NO3,它是铵盐,与强碱溶液共热,发生反应生成NH3,离子方程式是NH+OH-NH3↑+H2O。(6)Na2SO3一定条件下可以发生分解反应生成两种盐,其中一种是无氧酸盐,则为Na2S,反应的化学方程式为4Na2SO3Na2S+3Na2SO4。
相关试卷
这是一份2020高考化学一轮复习第五章物质结构元素周期律第3节检测(含解析),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020高考化学一轮复习第五章物质结构元素周期律第2节检测(含解析),共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020高考化学一轮复习第五章物质结构元素周期律第1节检测(含解析),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








