


所属成套资源:高考化学一轮复习检测 含解析
高考化学一轮复习检测:第7章 化学反应速率和化学平衡7-1a Word版含解析
展开
这是一份高考化学一轮复习检测:第7章 化学反应速率和化学平衡7-1a Word版含解析,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
![]() 板块三 限时规范特训
板块三 限时规范特训![]() 时间:45分钟
时间:45分钟 ![]() 满分:100分 一、选择题(每题7分,共70分)1.一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,发生反应N2+3H22NH3,2 min时测得剩余N2为1 mol,下列化学反应速率表示不正确的是( )A.v(N2)=0.25 mol/(L·min)B.v(H2)=0.75 mol/(L·min)C.v(NH3)=1 mol/(L·min)D.v(NH3)=0.5 mol/(L·min)答案 C解析 一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,2 min时测得剩余N2为1 mol,故2 min 内,以N2表示的反应速率v(N2)==0.25 mol/(L·min),A项正确;由于反应速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.25 mol/(L·min)=0.75 mol/(L·min),B正确;v(NH3)=2v(N2)=2×0.25 mol/(L·min)=0.5 mol/(L·min),C错误,D正确。2.[2018·安徽淮北质检]下列有关化学反应速率的说法中,正确的是( )A.实验室制氢气时,加入少量NaNO3固体,不影响反应速率B.锌片分别与等pH的醋酸、硫酸溶液反应,平均反应速率相等C.升高温度后,吸热反应的速率加快,放热反应的速率减慢D.纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大答案 D解析 实验室制取H2时,加入少量NaNO3固体,使得溶液中存在NO,NO在酸性条件下与金属反应产生NO,得不到H2,A项错误;锌片分别与等pH的醋酸、硫酸反应,开始时c(H+)相等,反应速率相等,随着反应的进行,CH3COOH进一步电离出H+,使得醋酸溶液的c(H+)的变化比硫酸溶液中的小,故Zn与醋酸的平均反应速率大于Zn与硫酸的平均反应速率,B项错误;升高温度,无论是吸热反应还是放热反应,反应速率均加快,C项错误;纳米铁粉的表面积大,与空气接触充分,在空气中能自燃,D项正确。3. 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
满分:100分 一、选择题(每题7分,共70分)1.一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,发生反应N2+3H22NH3,2 min时测得剩余N2为1 mol,下列化学反应速率表示不正确的是( )A.v(N2)=0.25 mol/(L·min)B.v(H2)=0.75 mol/(L·min)C.v(NH3)=1 mol/(L·min)D.v(NH3)=0.5 mol/(L·min)答案 C解析 一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,2 min时测得剩余N2为1 mol,故2 min 内,以N2表示的反应速率v(N2)==0.25 mol/(L·min),A项正确;由于反应速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.25 mol/(L·min)=0.75 mol/(L·min),B正确;v(NH3)=2v(N2)=2×0.25 mol/(L·min)=0.5 mol/(L·min),C错误,D正确。2.[2018·安徽淮北质检]下列有关化学反应速率的说法中,正确的是( )A.实验室制氢气时,加入少量NaNO3固体,不影响反应速率B.锌片分别与等pH的醋酸、硫酸溶液反应,平均反应速率相等C.升高温度后,吸热反应的速率加快,放热反应的速率减慢D.纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大答案 D解析 实验室制取H2时,加入少量NaNO3固体,使得溶液中存在NO,NO在酸性条件下与金属反应产生NO,得不到H2,A项错误;锌片分别与等pH的醋酸、硫酸反应,开始时c(H+)相等,反应速率相等,随着反应的进行,CH3COOH进一步电离出H+,使得醋酸溶液的c(H+)的变化比硫酸溶液中的小,故Zn与醋酸的平均反应速率大于Zn与硫酸的平均反应速率,B项错误;升高温度,无论是吸热反应还是放热反应,反应速率均加快,C项错误;纳米铁粉的表面积大,与空气接触充分,在空气中能自燃,D项正确。3. 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )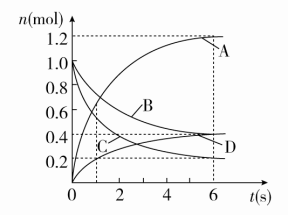 A.该反应的化学方程式为3B+4D6A+2CB.反应进行到1 s时,v(A)=v(D)C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1D.反应进行到6 s时,各物质的反应速率相等答案 C解析 由图可知,B、C为反应物,A、D为生成物,由于各物质的物质的量变化之比等于化学方程式中化学计量数之比,Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=6∶3∶4∶2,所以化学方程式为3B+4C6A+2D,A项错误;不论在什么时刻,用各物质表示的速率之比都等于化学计量数之比,故B、D选项错误。4.[2017·河北沧州一中月考]对反应A+BAB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0.01 mol;②50 mL溶液中含A、B各0.05 mol;③0.1 mol·L-1的A、B溶液各10 mL;④0.5 mol·L-1的A、B溶液各50 mL,四者反应速率的大小关系是( )A.②>①>④>③ B.④>③>②>①C.①>②>④>③ D.①>②>③>④答案 A解析 对于溶液中进行的反应,反应物A、B的浓度越大,化学反应速率越快。溶液①中c(A)=c(B)==0.5 mol·L-1,溶液②中c(A)=c(B)==1.0 mol·L-1,溶液③中c(A)=c(B)=×0.1 mol·L-1=0.05 mol·L-1,溶液④中c(A)=c(B)=×0.5 mol·L-1=0.25 mol·L-1,据此推知反应速率的大小关系为②>①>④>③。5.[2017·贵阳高三期末]在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是 ( )A.保持容器容积不变,向其中加入1 mol H2(g),反应速率一定加快B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率一定加快答案 A解析 增大氢气的物质的量且保持容器容积不变,氢气的浓度增大,反应速率加快,A正确;保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应混合物各组分的浓度不变,反应速率不变,B错误;保持容器气体压强不变,向其中充入1 mol N2(N2不参加反应),容器体积增大,各组分浓度减小,反应速率减小,C错误;保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),因体积增大为2倍,物质的量增大为2倍,则浓度不变,反应速率不变,D错误。6.下列各组反应(表内物质均为反应物)在刚开始时,产生H2速率最快的是( )
A.该反应的化学方程式为3B+4D6A+2CB.反应进行到1 s时,v(A)=v(D)C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1D.反应进行到6 s时,各物质的反应速率相等答案 C解析 由图可知,B、C为反应物,A、D为生成物,由于各物质的物质的量变化之比等于化学方程式中化学计量数之比,Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=6∶3∶4∶2,所以化学方程式为3B+4C6A+2D,A项错误;不论在什么时刻,用各物质表示的速率之比都等于化学计量数之比,故B、D选项错误。4.[2017·河北沧州一中月考]对反应A+BAB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0.01 mol;②50 mL溶液中含A、B各0.05 mol;③0.1 mol·L-1的A、B溶液各10 mL;④0.5 mol·L-1的A、B溶液各50 mL,四者反应速率的大小关系是( )A.②>①>④>③ B.④>③>②>①C.①>②>④>③ D.①>②>③>④答案 A解析 对于溶液中进行的反应,反应物A、B的浓度越大,化学反应速率越快。溶液①中c(A)=c(B)==0.5 mol·L-1,溶液②中c(A)=c(B)==1.0 mol·L-1,溶液③中c(A)=c(B)=×0.1 mol·L-1=0.05 mol·L-1,溶液④中c(A)=c(B)=×0.5 mol·L-1=0.25 mol·L-1,据此推知反应速率的大小关系为②>①>④>③。5.[2017·贵阳高三期末]在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是 ( )A.保持容器容积不变,向其中加入1 mol H2(g),反应速率一定加快B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率一定加快答案 A解析 增大氢气的物质的量且保持容器容积不变,氢气的浓度增大,反应速率加快,A正确;保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应混合物各组分的浓度不变,反应速率不变,B错误;保持容器气体压强不变,向其中充入1 mol N2(N2不参加反应),容器体积增大,各组分浓度减小,反应速率减小,C错误;保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),因体积增大为2倍,物质的量增大为2倍,则浓度不变,反应速率不变,D错误。6.下列各组反应(表内物质均为反应物)在刚开始时,产生H2速率最快的是( ) 答案 D解析 Al与18.4 mol·L-1 H2SO4溶液(浓硫酸)在加热条件下发生反应生成SO2,不能产生氢气;Mg的活泼性比Fe强,相同温度下,与3 mol·L-1 H2SO4溶液反应时,Mg产生H2的速率更快;升高温度,反应速率加快,故产生H2速率最快的是D项。7.[2017·河南洛阳期中]将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)3C(g)+4D(s),若经2 s后测得C的浓度为0.9 mol·L-1,则下列说法中正确的是( )①用物质A表示的平均反应速率为0.3 mol·L-1·s-1②用物质D表示的平均反应速率为0.6 mol·L-1·s-1③2 s时,物质A的转化率为30%④用A、B、C来表示反应速率,其速率之比为2∶1∶3A.①③④ B.①②③④ C.①②③ D.③④答案 A解析 ①经2 s后测得C的浓度为0.9 mol·L-1,则有v(C)==0.45 mol·L-1·s-1,根据物质的反应速率之比等于化学计量数之比可得v(A)=v(C)=×0.45 mol·L-1·s-1=0.3 mol·L-1·s-1,正确;②D为固体,不能用其浓度变化来表示反应速率,错误;③2 s时,消耗A的物质的量为0.3 mol·L-1·s-1×2 s×2 L=1.2 mol,故物质A的转化率为×100%=30%,正确;④用A、B、C来表示反应速率,反应速率之比等于其化学计量数之比,即A、B、C的反应速率之比为 2∶1∶3,正确。8. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
答案 D解析 Al与18.4 mol·L-1 H2SO4溶液(浓硫酸)在加热条件下发生反应生成SO2,不能产生氢气;Mg的活泼性比Fe强,相同温度下,与3 mol·L-1 H2SO4溶液反应时,Mg产生H2的速率更快;升高温度,反应速率加快,故产生H2速率最快的是D项。7.[2017·河南洛阳期中]将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)3C(g)+4D(s),若经2 s后测得C的浓度为0.9 mol·L-1,则下列说法中正确的是( )①用物质A表示的平均反应速率为0.3 mol·L-1·s-1②用物质D表示的平均反应速率为0.6 mol·L-1·s-1③2 s时,物质A的转化率为30%④用A、B、C来表示反应速率,其速率之比为2∶1∶3A.①③④ B.①②③④ C.①②③ D.③④答案 A解析 ①经2 s后测得C的浓度为0.9 mol·L-1,则有v(C)==0.45 mol·L-1·s-1,根据物质的反应速率之比等于化学计量数之比可得v(A)=v(C)=×0.45 mol·L-1·s-1=0.3 mol·L-1·s-1,正确;②D为固体,不能用其浓度变化来表示反应速率,错误;③2 s时,消耗A的物质的量为0.3 mol·L-1·s-1×2 s×2 L=1.2 mol,故物质A的转化率为×100%=30%,正确;④用A、B、C来表示反应速率,反应速率之比等于其化学计量数之比,即A、B、C的反应速率之比为 2∶1∶3,正确。8. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )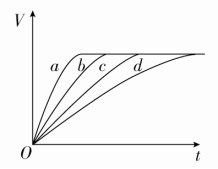 组别曲线c(HCl)/mol·L-1温度/℃铁的状态1a 30粉末状2b 30粉末状3c2.5 块状4d2.530块状 A.第4组实验的反应速率最慢B.第1组实验中盐酸的浓度大于2.5 mol·L-1C.第2组实验中盐酸的浓度等于2.5 mol·L-1D.第3组实验的反应温度低于30 ℃答案 D解析 由图像可知,1、2、3、4组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验,反应所用的时间最长,故反应速率最慢,A正确;第1组实验,反应所用的时间最短,故反应速率最快,根据控制变量法原则知盐酸的浓度应大于2.5 mol·L-1,B正确;第2组实验,铁是粉末状,与3、4组中的块状铁相区别,根据控制变量法原则知盐酸的浓度应等于2.5 mol·L-1,C正确;由3、4组实验的条件对比可知第3组实验的反应温度应高于30 ℃,D错误。9.反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 ( )①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大A.①④ B.②③ C.①③ D.②④答案 C解析 ①固体用量的改变对速率没有影响,正确;②容器的体积缩小一半,压强增大,速率增大,错误;③保持体积不变,充入N2使体系压强增大,但各物质的浓度保持不变,速率不变,正确;④保持压强不变,充入N2使容器体积变大,各物质的浓度减小,速率减小,错误,C正确。10.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
组别曲线c(HCl)/mol·L-1温度/℃铁的状态1a 30粉末状2b 30粉末状3c2.5 块状4d2.530块状 A.第4组实验的反应速率最慢B.第1组实验中盐酸的浓度大于2.5 mol·L-1C.第2组实验中盐酸的浓度等于2.5 mol·L-1D.第3组实验的反应温度低于30 ℃答案 D解析 由图像可知,1、2、3、4组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验,反应所用的时间最长,故反应速率最慢,A正确;第1组实验,反应所用的时间最短,故反应速率最快,根据控制变量法原则知盐酸的浓度应大于2.5 mol·L-1,B正确;第2组实验,铁是粉末状,与3、4组中的块状铁相区别,根据控制变量法原则知盐酸的浓度应等于2.5 mol·L-1,C正确;由3、4组实验的条件对比可知第3组实验的反应温度应高于30 ℃,D错误。9.反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 ( )①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大A.①④ B.②③ C.①③ D.②④答案 C解析 ①固体用量的改变对速率没有影响,正确;②容器的体积缩小一半,压强增大,速率增大,错误;③保持体积不变,充入N2使体系压强增大,但各物质的浓度保持不变,速率不变,正确;④保持压强不变,充入N2使容器体积变大,各物质的浓度减小,速率减小,错误,C正确。10.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( ) 答案 D解析 混合液的体积都为20 mL,但选项D中反应温度最高、反应物Na2S2O3的浓度最大,其反应速率最大,故最先看到浑浊(有硫单质生成),D正确。二、非选择题(共30分)11.(14分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
答案 D解析 混合液的体积都为20 mL,但选项D中反应温度最高、反应物Na2S2O3的浓度最大,其反应速率最大,故最先看到浑浊(有硫单质生成),D正确。二、非选择题(共30分)11.(14分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。 (1)催化剂能加快化学反应速率的原因是___________________。(2)实验①和②的目的是_______________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是________________________________。(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析图示能够得出的实验结论是_______________________。
(1)催化剂能加快化学反应速率的原因是___________________。(2)实验①和②的目的是_______________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是________________________________。(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析图示能够得出的实验结论是_______________________。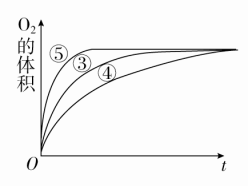 答案 (1)降低了反应的活化能(2)探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(3)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,但酸碱性环境对平衡移动无影响解析 加入催化剂可降低反应的活化能,反应速率增大。实验①和②过氧化氢的浓度不同,实验目的是探究浓度对反应速率的影响,但可能因过氧化氢性质稳定,反应速率太慢,现象不明显,可以给不同浓度的过氧化氢提供相同的温度或催化剂,进行探究浓度对反应速率的影响。分析实验③、④、⑤表中的反应物和催化剂结合图像知道,酸碱性环境影响反应速率,对平衡移动没有影响。12.[2017·山东临沂期中](16分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
答案 (1)降低了反应的活化能(2)探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(3)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,但酸碱性环境对平衡移动无影响解析 加入催化剂可降低反应的活化能,反应速率增大。实验①和②过氧化氢的浓度不同,实验目的是探究浓度对反应速率的影响,但可能因过氧化氢性质稳定,反应速率太慢,现象不明显,可以给不同浓度的过氧化氢提供相同的温度或催化剂,进行探究浓度对反应速率的影响。分析实验③、④、⑤表中的反应物和催化剂结合图像知道,酸碱性环境影响反应速率,对平衡移动没有影响。12.[2017·山东临沂期中](16分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示: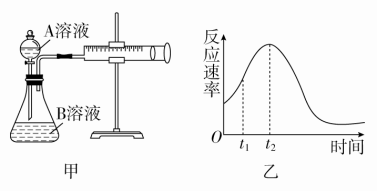
 (1)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________>________(填实验序号)。(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO)=________mol·L-1(假设混合溶液的体积为50 mL)。(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定__________________________来比较化学反应速率。(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②_________________________________________________。答案 (1)浓度 ② ①(2)0.0052(3)KMnO4溶液完全褪色所需时间(或产生相同体积气体所需时间)(4)反应放热解析 (1)对比①②实验中A溶液、B溶液的数据可知,除c(H2C2O4)不同外,其余各量均相同,显然该实验是探究浓度对化学反应速率的影响。实验②中A溶液的c(H2C2O4)比实验①中大,则实验②的化学反应速率快,所得CO2的体积大。(2)收集到CO2的物质的量为n(CO2)==2×10-4 mol,则有2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 2 10 n(MnO) 2×10-4 mol列式:=,解得n(MnO)=4×10-5 mol。在2 min末,n(MnO)=30×10-3 L×0.01 mol·L-1-4×10-5 mol=2.6×10-4 mol,从而可得c(MnO)==0.0052 mol·L-1。(3)可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需时间来比较化学反应速率。(4)t1~t2时间内反应速率变快,其可能原因主要有:①产物Mn2+(或MnSO4)是反应的催化剂;②反应放热,使混合溶液的温度升高。
(1)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________>________(填实验序号)。(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO)=________mol·L-1(假设混合溶液的体积为50 mL)。(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定__________________________来比较化学反应速率。(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②_________________________________________________。答案 (1)浓度 ② ①(2)0.0052(3)KMnO4溶液完全褪色所需时间(或产生相同体积气体所需时间)(4)反应放热解析 (1)对比①②实验中A溶液、B溶液的数据可知,除c(H2C2O4)不同外,其余各量均相同,显然该实验是探究浓度对化学反应速率的影响。实验②中A溶液的c(H2C2O4)比实验①中大,则实验②的化学反应速率快,所得CO2的体积大。(2)收集到CO2的物质的量为n(CO2)==2×10-4 mol,则有2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 2 10 n(MnO) 2×10-4 mol列式:=,解得n(MnO)=4×10-5 mol。在2 min末,n(MnO)=30×10-3 L×0.01 mol·L-1-4×10-5 mol=2.6×10-4 mol,从而可得c(MnO)==0.0052 mol·L-1。(3)可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需时间来比较化学反应速率。(4)t1~t2时间内反应速率变快,其可能原因主要有:①产物Mn2+(或MnSO4)是反应的催化剂;②反应放热,使混合溶液的温度升高。
相关试卷
这是一份高考化学一轮复习检测:第7章 化学反应速率和化学平衡7-3a Word版含解析,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份高考化学一轮复习检测:第7章 化学反应速率和化学平衡7-2a Word版含解析,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020高考化学一轮复习第七章化学反应速率和化学平衡第3节真题检测(含解析),共6页。








