


所属成套资源:高考化学一轮复习检测 含解析
高考化学一轮复习检测:第8章 水溶液中的离子平衡8-1a Word版含解析
展开
这是一份高考化学一轮复习检测:第8章 水溶液中的离子平衡8-1a Word版含解析,共13页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
![]() 板块三 限时规范特训
板块三 限时规范特训![]() 时间:45分钟
时间:45分钟 ![]() 满分:100分一、选择题(每题6分,共72分)1.室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓B.加水稀释后,溶液中c(NH)·c(OH-)变大C.用HNO3溶液完全中和后,溶液不显中性D.其溶液的pH=13答案 C解析 一水合氨是弱碱,书写离子方程式时不能拆写,应为Al3++3NH3·H2O===Al(OH)3↓+3NH,A错误;加水稀释虽然能促进氨水的电离,但c(NH)和c(OH-)都减小,即c(NH)·c(OH-)减小,B错误;用硝酸完全中和后,生成硝酸铵,硝酸铵为强酸弱碱盐,其水溶液显酸性,C正确;因为一水合氨为弱碱,部分电离,所以0.10 mol·L-1的氨水中c(OH-)远远小于0.10 mol·L-1,D错误。2.[2017·上海六校联考]在室温下,100 mL 0.1 mol·L-1的醋酸溶液中,欲使其溶液的pH减小,同时又要使醋酸的电离程度减小,可采取的措施为( )A.加入少量CH3COONa固体B.通入少量HCl气体C.升高温度D.加入少量NaOH固体答案 B解析 醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加入少量CH3COONa固体,溶液中c(CH3COO-)增大,平衡逆向移动,醋酸的电离程度减小,则溶液中c(H+)减小,酸性减弱,pH增大,A错误;通入少量HCl气体,溶液中c(H+)增大,平衡逆向移动,醋酸的电离程度减小,但溶液的酸性增强,pH减小,B正确;升高温度,电离平衡正向移动,醋酸的电离程度增大,溶液中c(H+)增大,pH减小,C错误;加入少量NaOH固体,OH-与H+结合生成H2O,溶液中c(H+)减小,溶液的pH增大,电离平衡正向移动,醋酸的电离程度增大,D错误。3.[2017·西安模拟]在0.1 mol·L-1 NH3·H2O溶液中存在如下平衡:NH3+H2ONH3·H2ONH+OH-。下列叙述中正确的是( )A.加入少量浓盐酸,盐酸与NH3反应生成NH4Cl,使NH3浓度减小,NH浓度增大,平衡逆向移动B.加入少量NaOH固体,OH-与NH结合生成NH3·H2O,使NH浓度减小,平衡正向移动C.加入少量0.1 mol·L-1 NH4Cl溶液,电离平衡常数不变,溶液中c(OH-)减小D.加入少量MgSO4固体,溶液pH增大答案 C解析 A项,加入少量浓盐酸,首先发生H++OH-===H2O,使OH-浓度降低,平衡正向移动;B项,加入少量NaOH固体,使OH-浓度升高,平衡逆向移动;C项,加入少量NH4Cl溶液,使NH浓度升高,平衡逆向移动,溶液中c(OH-)减小;D项,Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小,溶液pH减小。4.[2017·山西五校联考]下列关于醋酸性质的描述,不能证明它是弱电解质的是( )A.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1B.醋酸溶液中存在CH3COOH分子C.10 mL pH=1的醋酸溶液与足量锌粉反应生成H2 112 mL(标准状况)D.10 mL 0.1 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的NaOH溶液恰好完全中和答案 D解析 1 mol·L-1的醋酸溶液中c(H+)约为10-3 mol·L-1,说明CH3COOH部分发生电离,则CH3COOH是弱电解质,A正确;醋酸溶液中存在CH3COOH分子,说明CH3COOH未完全发生电离,则CH3COOH是弱电解质,B正确;Zn与醋酸溶液发生的反应为Zn+2CH3COOH===(CH3COO)2Zn+H2↑,标准状况下112 mL H2的物质的量为0.005 mol,则参与反应的n(CH3COOH)=0.01 mol;10 mL pH=1的醋酸溶液中,CH3COOH电离产生的n(H+)=0.01 L×0.1 mol·L-1=0.001 mol,则有n(H+)<n(CH3COOH),说明CH3COOH部分发生电离,则CH3COOH是弱电解质,C正确;10 mL 0.1 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的NaOH溶液中,n(CH3COOH)=n(NaOH)=0.01 L×0.1 mol·L-1=0.001 mol,二者能恰好完全反应,只能说明CH3COOH为一元酸,不能证明CH3COOH是弱电解质,D错误。5.pH=12的X、Y两种碱溶液各10 mL,分别稀释至1000 mL,其pH与溶液体积(V)的关系图所示,下列说法正确的是( )
满分:100分一、选择题(每题6分,共72分)1.室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓B.加水稀释后,溶液中c(NH)·c(OH-)变大C.用HNO3溶液完全中和后,溶液不显中性D.其溶液的pH=13答案 C解析 一水合氨是弱碱,书写离子方程式时不能拆写,应为Al3++3NH3·H2O===Al(OH)3↓+3NH,A错误;加水稀释虽然能促进氨水的电离,但c(NH)和c(OH-)都减小,即c(NH)·c(OH-)减小,B错误;用硝酸完全中和后,生成硝酸铵,硝酸铵为强酸弱碱盐,其水溶液显酸性,C正确;因为一水合氨为弱碱,部分电离,所以0.10 mol·L-1的氨水中c(OH-)远远小于0.10 mol·L-1,D错误。2.[2017·上海六校联考]在室温下,100 mL 0.1 mol·L-1的醋酸溶液中,欲使其溶液的pH减小,同时又要使醋酸的电离程度减小,可采取的措施为( )A.加入少量CH3COONa固体B.通入少量HCl气体C.升高温度D.加入少量NaOH固体答案 B解析 醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加入少量CH3COONa固体,溶液中c(CH3COO-)增大,平衡逆向移动,醋酸的电离程度减小,则溶液中c(H+)减小,酸性减弱,pH增大,A错误;通入少量HCl气体,溶液中c(H+)增大,平衡逆向移动,醋酸的电离程度减小,但溶液的酸性增强,pH减小,B正确;升高温度,电离平衡正向移动,醋酸的电离程度增大,溶液中c(H+)增大,pH减小,C错误;加入少量NaOH固体,OH-与H+结合生成H2O,溶液中c(H+)减小,溶液的pH增大,电离平衡正向移动,醋酸的电离程度增大,D错误。3.[2017·西安模拟]在0.1 mol·L-1 NH3·H2O溶液中存在如下平衡:NH3+H2ONH3·H2ONH+OH-。下列叙述中正确的是( )A.加入少量浓盐酸,盐酸与NH3反应生成NH4Cl,使NH3浓度减小,NH浓度增大,平衡逆向移动B.加入少量NaOH固体,OH-与NH结合生成NH3·H2O,使NH浓度减小,平衡正向移动C.加入少量0.1 mol·L-1 NH4Cl溶液,电离平衡常数不变,溶液中c(OH-)减小D.加入少量MgSO4固体,溶液pH增大答案 C解析 A项,加入少量浓盐酸,首先发生H++OH-===H2O,使OH-浓度降低,平衡正向移动;B项,加入少量NaOH固体,使OH-浓度升高,平衡逆向移动;C项,加入少量NH4Cl溶液,使NH浓度升高,平衡逆向移动,溶液中c(OH-)减小;D项,Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小,溶液pH减小。4.[2017·山西五校联考]下列关于醋酸性质的描述,不能证明它是弱电解质的是( )A.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1B.醋酸溶液中存在CH3COOH分子C.10 mL pH=1的醋酸溶液与足量锌粉反应生成H2 112 mL(标准状况)D.10 mL 0.1 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的NaOH溶液恰好完全中和答案 D解析 1 mol·L-1的醋酸溶液中c(H+)约为10-3 mol·L-1,说明CH3COOH部分发生电离,则CH3COOH是弱电解质,A正确;醋酸溶液中存在CH3COOH分子,说明CH3COOH未完全发生电离,则CH3COOH是弱电解质,B正确;Zn与醋酸溶液发生的反应为Zn+2CH3COOH===(CH3COO)2Zn+H2↑,标准状况下112 mL H2的物质的量为0.005 mol,则参与反应的n(CH3COOH)=0.01 mol;10 mL pH=1的醋酸溶液中,CH3COOH电离产生的n(H+)=0.01 L×0.1 mol·L-1=0.001 mol,则有n(H+)<n(CH3COOH),说明CH3COOH部分发生电离,则CH3COOH是弱电解质,C正确;10 mL 0.1 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的NaOH溶液中,n(CH3COOH)=n(NaOH)=0.01 L×0.1 mol·L-1=0.001 mol,二者能恰好完全反应,只能说明CH3COOH为一元酸,不能证明CH3COOH是弱电解质,D错误。5.pH=12的X、Y两种碱溶液各10 mL,分别稀释至1000 mL,其pH与溶液体积(V)的关系图所示,下列说法正确的是( )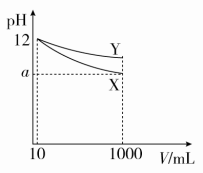 A.若10<a<12,则X、Y都是弱碱B.X、Y两种碱的物质的量浓度一定相等C.完全中和pH相同的X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y)D.稀释后,X溶液的碱性比Y溶液的碱性强答案 A解析 若X为强碱,则10 mL pH=12的X溶液稀释至1000 mL,pH应该为10,故若10<a<12,则X、Y均为弱碱,A正确;两种碱稀释相同倍数,pH变化不同,说明两种碱的强弱不同,则pH相同时,二者的物质的量浓度一定不同,B错误;当pH相同时,c(X)<c(Y),所以完全中和这两种碱时,消耗相同浓度的盐酸的体积:V(X)<V(Y),C错误;由图像数据可知,稀释后Y溶液的pH比X溶液的pH大,故Y溶液的碱性强,D错误。6.[2017·天津五区县期末]根据下列实验现象或结果不能证明一元酸HR为弱酸的是( )A.HR溶液中滴加紫色石蕊试液,溶液变红色B.室温时,NaR溶液的pH大于7C.HR溶液加入少量NaR固体,溶解后溶液的pH变大D.室温时,0.01 mol·L-1的HR溶液pH=4答案 A解析 HR溶液中滴加紫色石蕊试液,溶液变红色,说明HR是酸,但不能证明一元酸HR为弱酸,A符合题意;室温时,NaR溶液的pH大于7,说明NaR为强碱弱酸盐,R-发生了水解反应,故一元酸HR为弱酸,B不符合题意;HR溶液加入少量NaR固体,溶解后溶液的pH变大,说明溶液中c(H+)减小,HR的电离平衡逆向移动,从而证明一元酸HR为弱酸,C不符合题意;室温时,0.01 mol·L-1的HR溶液pH=4,说明HR部分电离,则HR为一元弱酸,D不符合题意。7.25 ℃时,向0.2 mol·L-1的氨水中加水稀释,则图中的y轴可以表示( )
A.若10<a<12,则X、Y都是弱碱B.X、Y两种碱的物质的量浓度一定相等C.完全中和pH相同的X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y)D.稀释后,X溶液的碱性比Y溶液的碱性强答案 A解析 若X为强碱,则10 mL pH=12的X溶液稀释至1000 mL,pH应该为10,故若10<a<12,则X、Y均为弱碱,A正确;两种碱稀释相同倍数,pH变化不同,说明两种碱的强弱不同,则pH相同时,二者的物质的量浓度一定不同,B错误;当pH相同时,c(X)<c(Y),所以完全中和这两种碱时,消耗相同浓度的盐酸的体积:V(X)<V(Y),C错误;由图像数据可知,稀释后Y溶液的pH比X溶液的pH大,故Y溶液的碱性强,D错误。6.[2017·天津五区县期末]根据下列实验现象或结果不能证明一元酸HR为弱酸的是( )A.HR溶液中滴加紫色石蕊试液,溶液变红色B.室温时,NaR溶液的pH大于7C.HR溶液加入少量NaR固体,溶解后溶液的pH变大D.室温时,0.01 mol·L-1的HR溶液pH=4答案 A解析 HR溶液中滴加紫色石蕊试液,溶液变红色,说明HR是酸,但不能证明一元酸HR为弱酸,A符合题意;室温时,NaR溶液的pH大于7,说明NaR为强碱弱酸盐,R-发生了水解反应,故一元酸HR为弱酸,B不符合题意;HR溶液加入少量NaR固体,溶解后溶液的pH变大,说明溶液中c(H+)减小,HR的电离平衡逆向移动,从而证明一元酸HR为弱酸,C不符合题意;室温时,0.01 mol·L-1的HR溶液pH=4,说明HR部分电离,则HR为一元弱酸,D不符合题意。7.25 ℃时,向0.2 mol·L-1的氨水中加水稀释,则图中的y轴可以表示( )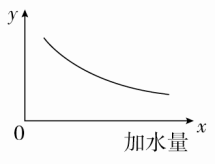 ①电离程度 ②c(NH3·H2O)③c(NH) ④c(H+) ⑤溶液的导电能力 ⑥pH ⑦ ⑧c(H+)·c(OH-)A.①②③⑤ B.②③⑤⑥C.②③⑥⑦ D.①②⑤⑥答案 B解析 加水稀释,NH3·H2O的电离程度增大,①错误;加水稀释虽然促进了NH3·H2O的电离,但由于溶液体积增大得更多,故c(NH3·H2O)、c(NH)、c(OH-)均减小,c(H+)增大,②、③正确,④错误;溶液中离子浓度减小,导电性减弱,⑤正确;c(OH-)减小,pH减小,⑥正确;NH3·H2O的电离常数Kb=只与温度有关,温度不变,Kb不变,⑦错误;c(H+)·c(OH-)=Kw,只受温度影响,温度不变,c(H+)·c(OH-)保持不变,⑧错误;综上分析,B正确。8.[2017·河南郑州质检]将浓度为0.1 mol·L-1 HF溶液加水稀释,下列各量保持增大的是( )①c(H+) ②c(F-) ③c(OH-) ④Ka(HF)⑤ ⑥A.①⑤ B.②③ C.③⑥ D.④⑥答案 C解析 HF溶液存在电离平衡:HFF-+H+,加水稀释时,平衡正向移动,由于溶液体积的增大程度大于n(F-)、n(H+)的增大程度,则溶液中c(F-)、c(H+)均减小,①②错误;由于溶液的温度不变,则Ka(HF)不变,④错误;由于Kw=c(H+)·c(OH-),c(H+)减小,且Kw不变,则c(OH-)增大,③正确;HF电离产生的n(F-)、n(H+)相等,因此加水稀释过程中几乎不变,⑤错误;HF的电离常数Ka(HF)=,则有=,Ka(HF)不变,c(F-)减小,故的值增大,⑥正确。9.[2017·衡水模拟]25 ℃时,对于pH=2的CH3COOH溶液,下列判断正确的是( )A.加水稀释,电离平衡正向移动,溶液中c(H+)增大,也增大B.通入少量HCl气体,电离平衡逆向移动,c(CH3COO-)减小,Ka减小C.加入少量CH3COONa固体,电离平衡逆向移动,c(H+)减小,Ka不变D.升高温度,电离平衡正向移动,c(H+)增大,pH增大答案 C解析 CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,加水稀释,促进CH3COOH的电离,但由于溶液体积增大,c(H+)减小,=Ka,温度不变,Ka不变,A错误;通入少量HCl气体时,平衡逆向移动,c(CH3COO-)减小,但Ka不变,B错误;加入少量CH3COONa固体,c(CH3COO-)增大,平衡逆向移动,c(H+)减小,Ka不变,C正确;升高温度,电离平衡正向移动,c(H+)增大,pH减小,D错误。10.[2017·北京东城区期末]25 ℃时,pH=2的盐酸和醋酸各1 mL分别加水稀释,pH随溶液体积变化的曲线如图所示。下列说法不正确的是( )
①电离程度 ②c(NH3·H2O)③c(NH) ④c(H+) ⑤溶液的导电能力 ⑥pH ⑦ ⑧c(H+)·c(OH-)A.①②③⑤ B.②③⑤⑥C.②③⑥⑦ D.①②⑤⑥答案 B解析 加水稀释,NH3·H2O的电离程度增大,①错误;加水稀释虽然促进了NH3·H2O的电离,但由于溶液体积增大得更多,故c(NH3·H2O)、c(NH)、c(OH-)均减小,c(H+)增大,②、③正确,④错误;溶液中离子浓度减小,导电性减弱,⑤正确;c(OH-)减小,pH减小,⑥正确;NH3·H2O的电离常数Kb=只与温度有关,温度不变,Kb不变,⑦错误;c(H+)·c(OH-)=Kw,只受温度影响,温度不变,c(H+)·c(OH-)保持不变,⑧错误;综上分析,B正确。8.[2017·河南郑州质检]将浓度为0.1 mol·L-1 HF溶液加水稀释,下列各量保持增大的是( )①c(H+) ②c(F-) ③c(OH-) ④Ka(HF)⑤ ⑥A.①⑤ B.②③ C.③⑥ D.④⑥答案 C解析 HF溶液存在电离平衡:HFF-+H+,加水稀释时,平衡正向移动,由于溶液体积的增大程度大于n(F-)、n(H+)的增大程度,则溶液中c(F-)、c(H+)均减小,①②错误;由于溶液的温度不变,则Ka(HF)不变,④错误;由于Kw=c(H+)·c(OH-),c(H+)减小,且Kw不变,则c(OH-)增大,③正确;HF电离产生的n(F-)、n(H+)相等,因此加水稀释过程中几乎不变,⑤错误;HF的电离常数Ka(HF)=,则有=,Ka(HF)不变,c(F-)减小,故的值增大,⑥正确。9.[2017·衡水模拟]25 ℃时,对于pH=2的CH3COOH溶液,下列判断正确的是( )A.加水稀释,电离平衡正向移动,溶液中c(H+)增大,也增大B.通入少量HCl气体,电离平衡逆向移动,c(CH3COO-)减小,Ka减小C.加入少量CH3COONa固体,电离平衡逆向移动,c(H+)减小,Ka不变D.升高温度,电离平衡正向移动,c(H+)增大,pH增大答案 C解析 CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,加水稀释,促进CH3COOH的电离,但由于溶液体积增大,c(H+)减小,=Ka,温度不变,Ka不变,A错误;通入少量HCl气体时,平衡逆向移动,c(CH3COO-)减小,但Ka不变,B错误;加入少量CH3COONa固体,c(CH3COO-)增大,平衡逆向移动,c(H+)减小,Ka不变,C正确;升高温度,电离平衡正向移动,c(H+)增大,pH减小,D错误。10.[2017·北京东城区期末]25 ℃时,pH=2的盐酸和醋酸各1 mL分别加水稀释,pH随溶液体积变化的曲线如图所示。下列说法不正确的是( ) A.曲线Ⅰ代表盐酸的稀释过程B.a点溶液的导电性比c点溶液的导电性强C.Ⅰ溶液中和NaOH的能力强于Ⅱ溶液D.将a、b两点溶液加热至30 ℃,变小答案 C解析 1 mL pH=2的盐酸加水稀释至1000 mL,溶液的pH=5;1 mL pH=2的醋酸加水稀释至1000 mL,CH3COOH的电离平衡正向移动,溶液的pH<5,故曲线Ⅰ代表盐酸的稀释过程,曲线Ⅱ代表醋酸的稀释过程,A正确;盐酸加水稀释时,溶液中c(Cl-)、c(H+)减小,溶液的导电能力减弱,故a点溶液的导电性比c点溶液的导电性强,B正确;pH=2的盐酸和醋酸相比,则有c(CH3COOH)>c(HCl),体积相等的两种溶液中n(CH3COOH)>n(HCl),与NaOH溶液发生中和反应时,CH3COOH消耗NaOH多,故Ⅱ溶液中和NaOH的能力强于Ⅰ溶液,C错误;升高温度,CH3COOH的电离平衡正向移动,c(CH3COO-)增大,而c(Cl-)基本不变,故变小,D正确。11.[2017·河南百校联考]25 ℃时,有pH=2的HX溶液和HY溶液各1 mL,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
A.曲线Ⅰ代表盐酸的稀释过程B.a点溶液的导电性比c点溶液的导电性强C.Ⅰ溶液中和NaOH的能力强于Ⅱ溶液D.将a、b两点溶液加热至30 ℃,变小答案 C解析 1 mL pH=2的盐酸加水稀释至1000 mL,溶液的pH=5;1 mL pH=2的醋酸加水稀释至1000 mL,CH3COOH的电离平衡正向移动,溶液的pH<5,故曲线Ⅰ代表盐酸的稀释过程,曲线Ⅱ代表醋酸的稀释过程,A正确;盐酸加水稀释时,溶液中c(Cl-)、c(H+)减小,溶液的导电能力减弱,故a点溶液的导电性比c点溶液的导电性强,B正确;pH=2的盐酸和醋酸相比,则有c(CH3COOH)>c(HCl),体积相等的两种溶液中n(CH3COOH)>n(HCl),与NaOH溶液发生中和反应时,CH3COOH消耗NaOH多,故Ⅱ溶液中和NaOH的能力强于Ⅰ溶液,C错误;升高温度,CH3COOH的电离平衡正向移动,c(CH3COO-)增大,而c(Cl-)基本不变,故变小,D正确。11.[2017·河南百校联考]25 ℃时,有pH=2的HX溶液和HY溶液各1 mL,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )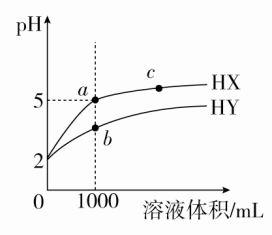 A.a、c两点对应HX的电离平衡常数:K(c)>K(a)B.a、b两点对应的溶液中:c(X-)>c(Y-)C.等物质的量浓度的HX和HY的混合溶液中:c(Y-)<c(X-)D.分别向10 mL 0.1 mol·L-1 HX溶液和10 mL 0.1 mol·L-1 HY溶液中滴加相同浓度的氢氧化钠溶液,恰好完全中和时,消耗氢氧化钠溶液的体积较大的是HX答案 C解析 分析图像可知,HX是强酸,不存在电离平衡,A错误;由题图可知,1 mL溶液稀释至1000 mL时,pH(HX)=5,pH(HY)<5,即ca(H+)<cb(H+),由电荷守恒得溶液中酸根离子浓度等于c(H+)-c(OH-),故a、b两点对应溶液中c(X-)<c(Y-),B错误;分析题图可知,HX是强酸,完全电离,HY是弱酸,部分电离,则等物质的量浓度的HX、HY混合液中:c(Y-)<c(X-),C正确;由于c(HY)=c(HX),等体积、等浓度的HX和HY溶液,n(HY)=n(HX),故与等浓度NaOH溶液发生中和反应时,消耗NaOH溶液的体积相等,D错误。12.常温下,浓度均为0.10 mol·L-1、体积均为V0 L的MOH和ROH溶液,分别加水稀释至V L,溶液pH随lg 的变化如图所示。下列叙述正确的是( )
A.a、c两点对应HX的电离平衡常数:K(c)>K(a)B.a、b两点对应的溶液中:c(X-)>c(Y-)C.等物质的量浓度的HX和HY的混合溶液中:c(Y-)<c(X-)D.分别向10 mL 0.1 mol·L-1 HX溶液和10 mL 0.1 mol·L-1 HY溶液中滴加相同浓度的氢氧化钠溶液,恰好完全中和时,消耗氢氧化钠溶液的体积较大的是HX答案 C解析 分析图像可知,HX是强酸,不存在电离平衡,A错误;由题图可知,1 mL溶液稀释至1000 mL时,pH(HX)=5,pH(HY)<5,即ca(H+)<cb(H+),由电荷守恒得溶液中酸根离子浓度等于c(H+)-c(OH-),故a、b两点对应溶液中c(X-)<c(Y-),B错误;分析题图可知,HX是强酸,完全电离,HY是弱酸,部分电离,则等物质的量浓度的HX、HY混合液中:c(Y-)<c(X-),C正确;由于c(HY)=c(HX),等体积、等浓度的HX和HY溶液,n(HY)=n(HX),故与等浓度NaOH溶液发生中和反应时,消耗NaOH溶液的体积相等,D错误。12.常温下,浓度均为0.10 mol·L-1、体积均为V0 L的MOH和ROH溶液,分别加水稀释至V L,溶液pH随lg 的变化如图所示。下列叙述正确的是( )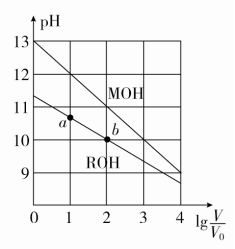 A.与等浓度的HCl溶液中和时,消耗HCl溶液的体积:a点>b点B.溶液中a点和b点导电离子的数目相等C.两溶液在稀释过程中,溶液中某种离子浓度可能增加D.lg =2时,若两溶液同时升高温度,则减小答案 C解析 a、b两点都在ROH溶液加水稀释曲线上,加水稀释过程中n(ROH)不变,则与等浓度的HCl溶液中和时,消耗HCl溶液的体积相等,A错误。相同浓度的一元碱,其pH越大,则对应碱的碱性越强;由题图可知,未加水稀释时,MOH溶液的pH大于ROH溶液的pH,则MOH的碱性强于ROH,故ROH为一元弱碱;加水稀释时,ROH的电离平衡正向移动,电离产生R+和OH-的数目增加,故b点溶液中导电离子的数目大于a点,B错误。MOH和ROH溶液分别加水稀释,溶液中c(OH-)减小,由于温度不变,则Kw不变,故两溶液中c(H+)逐渐增大,C正确。常温下,浓度为0.10 mol·L-1 MOH溶液的pH=13,说明MOH完全电离,则MOH是一元强碱;升高温度时,MOH溶液中c(M+)不变,而ROH溶液中ROH的电离平衡正向移动,溶液中c(R+)增大,故增大,D错误。二、非选择题(共28分)13.(14分)(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。A.c(H+) B.c(H+)/c(CH3COOH)C.c(H+)·c(OH-) D.c(OH-)/c(H+)E.若该溶液升高温度,上述5种表达式的数据增大的是________。(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。答案 (1)A ABCE (2)小于解析 (1)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH、CH3COO-、H+的浓度却都减小,c(OH-)是增大的,且CH3COOH的浓度减小的程度最大,由于温度不变,Kw、Ka均不变。升温促进电离,Kw、Ka均增大,c(H+)增大,c(H+)/c(CH3COOH)增大,c(OH-)/c(H+)减小。(2)对于相同的弱电解质溶液,浓度越大,电离程度越小,0.1 mol·L-1的醋酸溶液中电离程度比0.01 mol·L-1的醋酸溶液电离程度小,则二者c(H+)之比小于10。14.(14分)25 ℃时,部分物质的电离平衡常数如表所示:
A.与等浓度的HCl溶液中和时,消耗HCl溶液的体积:a点>b点B.溶液中a点和b点导电离子的数目相等C.两溶液在稀释过程中,溶液中某种离子浓度可能增加D.lg =2时,若两溶液同时升高温度,则减小答案 C解析 a、b两点都在ROH溶液加水稀释曲线上,加水稀释过程中n(ROH)不变,则与等浓度的HCl溶液中和时,消耗HCl溶液的体积相等,A错误。相同浓度的一元碱,其pH越大,则对应碱的碱性越强;由题图可知,未加水稀释时,MOH溶液的pH大于ROH溶液的pH,则MOH的碱性强于ROH,故ROH为一元弱碱;加水稀释时,ROH的电离平衡正向移动,电离产生R+和OH-的数目增加,故b点溶液中导电离子的数目大于a点,B错误。MOH和ROH溶液分别加水稀释,溶液中c(OH-)减小,由于温度不变,则Kw不变,故两溶液中c(H+)逐渐增大,C正确。常温下,浓度为0.10 mol·L-1 MOH溶液的pH=13,说明MOH完全电离,则MOH是一元强碱;升高温度时,MOH溶液中c(M+)不变,而ROH溶液中ROH的电离平衡正向移动,溶液中c(R+)增大,故增大,D错误。二、非选择题(共28分)13.(14分)(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。A.c(H+) B.c(H+)/c(CH3COOH)C.c(H+)·c(OH-) D.c(OH-)/c(H+)E.若该溶液升高温度,上述5种表达式的数据增大的是________。(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。答案 (1)A ABCE (2)小于解析 (1)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH、CH3COO-、H+的浓度却都减小,c(OH-)是增大的,且CH3COOH的浓度减小的程度最大,由于温度不变,Kw、Ka均不变。升温促进电离,Kw、Ka均增大,c(H+)增大,c(H+)/c(CH3COOH)增大,c(OH-)/c(H+)减小。(2)对于相同的弱电解质溶液,浓度越大,电离程度越小,0.1 mol·L-1的醋酸溶液中电离程度比0.01 mol·L-1的醋酸溶液电离程度小,则二者c(H+)之比小于10。14.(14分)25 ℃时,部分物质的电离平衡常数如表所示: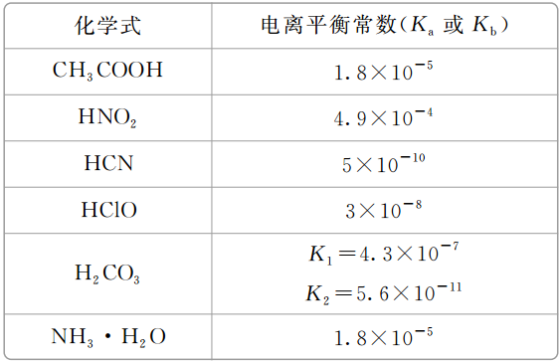 (1)上述五种酸的酸性由强到弱的顺序是__________________________________________。(2)该温度下,0.10 mol·L-1 HNO2溶液中的c(H+)=________ mol·L-1。(3)25 ℃时,向NaClO溶液中通入少量的CO2,发生反应的离子方程式为____________________________。(4)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是________(填序号)。A.升高温度 B.加水稀释C.加少量CH3COONa固体 D.加入少量冰醋酸E.加入少量NaOH固体(温度不变)答案 (1)HNO2>CH3COOH>H2CO3>HClO>HCN(2)7×10-3(3)CO2+H2O+ClO-===HClO+HCO(4)BE解析 (1)电离平衡常数的大小反应了酸的强弱,数值越大,酸性越强。(2)由HNO2H++NO,K=≈==4.9×10-4,c(H+)==7×10-3 mol·L-1。(3)碳酸酸性强于次氯酸,向NaClO溶液中通入少量的二氧化碳,可以制取次氯酸,但是次氯酸的电离平衡常数大于碳酸二级电离的电离平衡常数,故酸性HClO>HCO,离子方程式为CO2+ClO-+H2O===HClO+HCO。(4)电离平衡常数只与温度有关,温度不变,电离平衡常数就不变。醋酸的电离是吸热的,升高温度,电离平衡常数增大,A项不符合题意;加水稀释,电离程度增大,电离常数不变,B项符合题意;加少量CH3COONa固体,其电离出的CH3COO-抑制CH3COOH的电离,C项不符合题意;加入少量冰醋酸,醋酸浓度增大,电离程度减小,D项不符合题意;加入NaOH固体,c(H+)减小,醋酸电离平衡正向移动,电离程度增大,E项符合题意。
(1)上述五种酸的酸性由强到弱的顺序是__________________________________________。(2)该温度下,0.10 mol·L-1 HNO2溶液中的c(H+)=________ mol·L-1。(3)25 ℃时,向NaClO溶液中通入少量的CO2,发生反应的离子方程式为____________________________。(4)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是________(填序号)。A.升高温度 B.加水稀释C.加少量CH3COONa固体 D.加入少量冰醋酸E.加入少量NaOH固体(温度不变)答案 (1)HNO2>CH3COOH>H2CO3>HClO>HCN(2)7×10-3(3)CO2+H2O+ClO-===HClO+HCO(4)BE解析 (1)电离平衡常数的大小反应了酸的强弱,数值越大,酸性越强。(2)由HNO2H++NO,K=≈==4.9×10-4,c(H+)==7×10-3 mol·L-1。(3)碳酸酸性强于次氯酸,向NaClO溶液中通入少量的二氧化碳,可以制取次氯酸,但是次氯酸的电离平衡常数大于碳酸二级电离的电离平衡常数,故酸性HClO>HCO,离子方程式为CO2+ClO-+H2O===HClO+HCO。(4)电离平衡常数只与温度有关,温度不变,电离平衡常数就不变。醋酸的电离是吸热的,升高温度,电离平衡常数增大,A项不符合题意;加水稀释,电离程度增大,电离常数不变,B项符合题意;加少量CH3COONa固体,其电离出的CH3COO-抑制CH3COOH的电离,C项不符合题意;加入少量冰醋酸,醋酸浓度增大,电离程度减小,D项不符合题意;加入NaOH固体,c(H+)减小,醋酸电离平衡正向移动,电离程度增大,E项符合题意。
相关试卷
这是一份2020高考化学一轮复习第八章水溶液中的离子平衡第4节检测(含解析),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020高考化学一轮复习第八章水溶液中的离子平衡第3节检测(含解析),共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020高考化学一轮复习第八章水溶液中的离子平衡第2节检测(含解析),共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








