


- 高考化学一轮复习高考热考题型攻关04 含解析 试卷 0 次下载
- 高考化学一轮复习高考热考题型攻关05 含解析 试卷 0 次下载
- 高考化学一轮复习高考热考题型攻关07 含解析 试卷 0 次下载
- 高考化学一轮复习高考热考题型攻关08 含解析 试卷 0 次下载
- 高考化学一轮复习高考热考题型攻关09 含解析 试卷 0 次下载
高考化学一轮复习高考热考题型攻关06 含解析
展开![]() 化学工艺流程—考查非金属及其化合物的性质和转化
化学工艺流程—考查非金属及其化合物的性质和转化
![]()
工艺流程题的结构分题头、题干和题尾三部分。题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括副产品);题干部分主要用框图形式将原料到产品的主要生产工艺流程表示出来;题尾主要是根据生产过程中涉及的化学知识设置成一系列问题,构成一道完整的化学试题。该类试题能够以真实的工业生产过程为背景,体现能力立意的命题指导思想,能够综合考查学生各方面的基础知识及将已有知识灵活应用在生产实际中解决问题的能力。其特点如下:
(1)呈现形式:流程图、表格、图象等。
(2)设问方式:措施、成分、物质、原因等。
(3)能力考查:获取信息的能力、分析问题的能力、迁移推理能力、表达能力等。
(4)知识落点:基本理论、元素化合物、实验等。
![]()
1.(2018·全国卷Ⅰ)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_________________________________
_____________________________________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
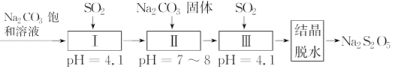
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是
_____________________________________________________。
(3)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为___________
_____________________________________________________,
该样品中Na2S2O5的残留量为____g·L-1(以SO2计)。
解析:(1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。
(2)①酸性条件下,SO2与Na2CO3溶液生成NaHSO3。②工艺中加入Na2CO3固体并再次通入SO2,其目的是得到NaHSO3过饱和溶液。
(3)根据电子、电荷及质量守恒,可写出反应的离子方程式为S2O+2I2+3H2O===2SO+4I-+6H+。n(S2O)=×n(I2)=×0.010 00 mol·L-1×10.00×10-3L=5×10-5mol,该样品中S2O的残留量(以SO2计)为5×10-5mol×2×64 g·mol-1×=0.128 g·L-1。
答案:(1)2NaHSO3===Na2S2O5+H2O
(2)①NaHSO3 ②得到NaHSO3过饱和溶液
(3)S2O+2I2+3H2O===2SO+4I-+6H+ 0.128
2.(2018·全国卷Ⅲ)KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是___________________________________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
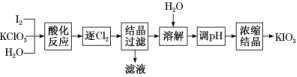
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是___________________________________。
“滤液”中的溶质主要是____________。“调pH”中发生反应的化学方程式为___________________________________________。
解析:(1)KIO3的化学名称为碘酸钾。
(2)Cl2的溶解度随温度的升高而降低,所以可以用加热的方法来达到“逐Cl2”的目的;KH(IO3)2和KCl的分离可以根据溶解度的不同,采用结晶法分离,滤液中的溶质主要是KCl,要使KH(IO3)2转化为KIO3,可以加入KOH调节pH。发生反应:KH(IO3)2+KOH===2KIO3+H2O或HIO3+KOH===KIO3+H2O,从而避免引入新的杂质离子。
答案:(1)碘酸钾 (2)加热 KCl KH(IO3)2+KOH===2KIO3+H2O(或HIO3+KOH===KIO3+H2O)
![]()
1.无机化工流程题的命题设计
(1)流程规律:主线主产品、分支副产品、回头为循环。
(2)核心考点:典型单质及其化合物知识、物质的分离操作、除杂试剂的选择、生产条件的控制。
2.无机化工流程题的解法思路
(1)从题干中获取有用信息,了解生产的产品。
(2)然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。
(3)分析流程中的每一步骤,从以下几个方面了解流程:a.反应物是什么;b.发生了什么反应;c.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。
![]()
1.(2019·厦门月考)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如何利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。下列有关该方法的叙述中正确的是( )
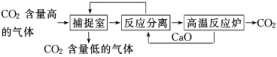
①能耗大是该方法的一大缺点
②整个过程中,只有一种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①② B.②③ C.③④ D.①④
解析:该方法中高温反应炉分离出CO2,需要消耗较多能量,①对;整个过程中NaOH和CaO均可循环利用,②错;从捕捉室中得到的溶液中含有大量的NaHCO3,加入CaO后生成CaCO3和NaOH,通过过滤的方法即可分离,③错;捕捉到的CO2可与H2反应制备甲醇:CO2+3H2CH3OH+H2O,④对。
答案:D
2.(2019·北京朝阳区模拟)实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下。下列分析正确的是( )
粗盐水精制盐水Cl2漂白液NaCl
A.①中采用蒸馏的方法精制粗盐水
B.②中阳极的主要电极反应:4OH--4e-===2H2O+O2↑
C.③中制备漂白液的反应:Cl2+OH-===Cl-+HClO
D.②、③、④中均发生了氧化还原反应
解析:A项,①中采用蒸馏只能得到蒸馏水,得不到精制盐水,要得到精制盐水需要使用化学方法除去其中的杂质,错误;B项,阳极发生氧化反应,②中阳极的主要电极反应:2Cl--2e-===Cl2↑,错误;C项,生成的氯气与氢氧化钠反应生成次氯酸钠,③中制备漂白液的反应:Cl2+2OH-===Cl-+ClO-+H2O,错误;D项,②中电解氯化钠溶液生成氢气和氯气以及氢氧化钠,③中氯气与氢氧化钠反应生成氯化钠和次氯酸钠、④中次氯酸钠与氨气反应生成氮气和氯化钠,均存在元素化合价的变化,发生了氧化还原反应,正确;故选D。
答案:D
3.(2019·西安质检)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下。下列说法正确的是( )
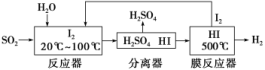
A.分离器中的物质分离操作为过滤
B.膜反应器中,增大压强有利于提高速率和HI的平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2===H2+2H2SO4+2HI
解析:反应器中的反应为SO2+I2+2H2OH2SO4+2HI。A项,H2SO4和HI互溶,不能用过滤法分离,错误;B项,膜反应器中的反应为2HI(g)H2(g)+I2(g),增大压强不能提高HI的平衡转化率,错误;C项,根据反应器中的反应和膜反应器中的反应,该工艺中I2和HI的相互转化体现了“碘循环”,正确;D项,将反应器中的反应和膜反应器中的反应相加,总反应为SO2+2H2O===H2SO4+H2,错误。
答案:C
4.(2019·南阳联考)SO2废气的回收利用方案如图所示。下列说法错误的是( )
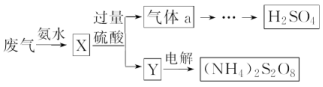
A.废气与氨水混合一定发生反应:2NH3·H2O+SO2===2NH+SO+H2O
B.Y中含有NH4HSO3
C.气体a既有氧化性又有还原性
D.(NH4)2S2O8中含有O—O键,S的化合价为+6
解析:A项,废气用氨水吸收一定发生反应:2NH3·H2O+SO2===2NH+SO+H2O,正确,(NH4)2SO3与过量H2SO4反应生成(NH4)2SO4、SO2和H2O,Y为(NH4)2SO4和过量H2SO4,不含NH4HSO3,错误;C项,气体a为SO2,SO2中S元素的化合价为+4价,SO2既有氧化性又有还原性,正确;D项,(NH4)2S2O8中含有O—O键,则O元素的化合价为-1价,N元素的化合价为-3价,H元素的化合价为+1价,根据正负化合价代数和为0,S元素的化合价为+6价,正确;答案选B。
答案:B
5.(2019·北京海淀区质检)以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下。下列说法不正确的是( )
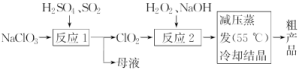
A.反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B.从母液中可以提取Na2SO4
C.反应2中,H2O2作氧化剂
D.采用减压蒸发可能是为了防止NaClO2受热分解
解析:A项,在反应1中,NaClO3和SO2在硫酸的作用下生成Na2SO4和ClO2,反应的离子方程式为2ClO+SO2===SO+2ClO2,根据方程式可知,每生成1 mol ClO2有0.5 mol SO2被氧化,正确;B项,根据上述分析可知,反应1中除了生成ClO2,还有Na2SO4生成,则从母液中可以提取Na2SO4,正确;C项,在反应2中,ClO2与H2O2在NaOH作用下反应生成NaClO2,氯元素的化合价从+4价降低到+3价,则ClO2是氧化剂,H2O2是还原剂,故C错误;D项,减压蒸发在较低温度下能够进行,可以防止常压蒸发时温度过高,NaClO2受热分解,正确;答案选C。
答案:C
6.ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示。下列说法错误的是( )
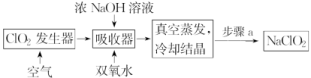
A.通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2 ===2ClO+2H++O2↑
C.步骤a的操作包括过滤、洗涤和干燥
D.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
解析:在ClO2发生器中一定产生ClO2气体,通入空气,可以将其赶入吸收塔中进行吸收,选项A正确。吸收塔中加入了浓氢氧化钠溶液,显然其中的反应不可能得到氢离子,选项B错误。冷却结晶得到NaClO2固体,应该经过过滤,洗涤,干燥得到产品,选项C正确。气体的贮存和运输都远比固体困难,所以将ClO2气体制成NaClO2固体的主要目的是便于贮存和运输,选项D正确。
答案:B
7.(2019·郑州模拟)CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
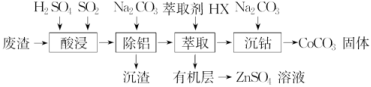
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式__________
_____________________________________________________。
(2)“除铝”过程中需要调节溶液pH的范围为________________,形成沉渣时发生反应的离子方程式为__________________________
_____________________________________________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
_______________________________________________________
_____________________________________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因____________________________________________________
_____________________________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为0.672 L(标准状况),则该钴氧化物的化学式为_____________________________________________。
解析:(1)“酸溶”时加入H2SO4和SO2,由于SO2具有还原性,SO2将钴废渣中+3价的Co还原为+2价,“酸溶”时发生的非氧化还原反应为:CoO+H2SO4===CoSO4+H2O、Al2O3+3H2SO4===Al2(SO4)3+3H2O、ZnO+H2SO4===ZnSO4+H2O,发生的氧化还原反应为Co2O3+SO2+H2SO4===2CoSO4+H2O。
(2)“除铝”过程中Al3+完全沉淀,其他金属阳离子不形成沉淀,根据Co2+、Al3+、Zn2+开始沉淀和沉淀完全的pH,“除铝”过程中需要调节溶液pH的范围为5.0~5.4。形成沉渣时加入的是Na2CO3,发生的是Al3+与CO的双水解反应,形成沉渣时反应的离子方程式为2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑。
(3)在实验室里,萃取操作用到的玻璃仪器主要有分液漏斗、烧杯。由有机层获得ZnSO4溶液,要使平衡ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层)逆向移动,所以要向有机层中加入硫酸然后分液,由有机层获得ZnSO4溶液的操作是:向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层。
ZnX2(有机层)+H2SO4(水层)逆向移动,所以要向有机层中加入硫酸然后分液,由有机层获得ZnSO4溶液的操作是:向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层。
(4)“沉钴”时是向CoSO4溶液中加入Na2CO3溶液产生CoCO3沉淀,由于Na2CO3溶液呈碱性,若Na2CO3溶液滴加过快会导致局部碱性过强而产生Co(OH)2沉淀,导致产品CoCO3中混有Co(OH)2。
(5)n(CO2)==0.03 mol,根据C守恒,n(CoCO3)=n(CO2)=0.03 mol;根据Co守恒,n(Co)=0.03 mol,氧化物中n(O)==0.04 mol,n(Co)∶n(O)=0.03 mol∶0.04 mol=3∶4,该钴氧化物的化学式为Co3O4。
答案:(1)Co2O3+SO2+H2SO4===2CoSO4+H2O
(2)5.0~5.4 2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑
(3)分液漏斗,烧杯 向有机层中加入适量的硫酸溶液充分振荡,静置,分离出水层
(4)Na2CO3溶液滴加过快,会导致局部碱性过强而产生Co(OH)2
(5)Co3O4
高考化学一轮复习高考热考题型攻关13 含解析: 这是一份高考化学一轮复习高考热考题型攻关13 含解析,共6页。试卷主要包含了已知,H2C2O4为二元弱酸等内容,欢迎下载使用。
高考化学一轮复习高考热考题型攻关12 含解析: 这是一份高考化学一轮复习高考热考题型攻关12 含解析,共7页。
高考化学一轮复习高考热考题型攻关11 含解析: 这是一份高考化学一轮复习高考热考题型攻关11 含解析,共8页。












