



- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 粗盐提纯 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 氯气的发现与制备 ( Word版含解析,2课时打包) 教案 2 次下载
- 苏教版(2019)高中化学必修一教案:专题4 硫及环境保护 二氧化硫的性质与应用 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题4 硫及环境保护 含硫物质之间的转化 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题4 硫及环境保护 氧化还原方程式的配平 ( Word版含解析,2课时打包) 教案 1 次下载
苏教版(2019)高中化学必修一教案:专题3 从海水中获得的化学物质 钠的性质与制备 ( Word版含解析,2课时打包)
展开![]() 3.2.1 钠的性质与制备
3.2.1 钠的性质与制备
![]()
教材以提问的方式引入新课,指出钠在自然界分布很广,都以化合态存在,介绍了生活中应用很广泛的几种含钠元素的物质。通过3个探究实验,引导学生探究钠的物理性质和化学性质;然后从原子结构的微观角度进行了讲解和归纳。在此基础上,进一步讲解了工业上钠的冶炼方法和应用。在实验探究中培养学生通过微观分析和实验探究揭示物质的性质的能力;培养学生能结合实验中的现象和数据,尝试概括出具体物质发生化学反应的条件、特征与规律的能力;培养学生能运用化学符号表征化学反应的能力;培养学生能运用化学变化规律解释或解决生产、生活中的实际问题的能力。
![]()
1、宏观辨识与微观探析:通过微观分析和实验探究揭示物质的性质
2、证据推理与模型认知:以钠及其化合物的性质为例,通过微观分析和实验探究揭示物质的性质
3、科学探究与创新意识:培养学生能结合实验中的现象和数据,尝试概括出具体物质发生化学反应的条件、特征与规律的能力
4、科学精神与社会责任:养学生能运用化学变化规律解释或解决生产、生活中的实际问题的能力。
![]()
1、钠的化学性质、工业制法。
2、钠的物理性质和应用。
![]()
课件、相关实验视频
![]()
引入新课:钠元素在自然界分布很广,储量极为丰富,而且都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。含钠化合物(如食盐、纯碱、小苏打等)在生产、生活中被广泛应用。为什么在自然界中不存在钠的单质?怎样才能获得的钠单质?是谁首次制出了钠单质?钠有哪些性质呢?请同学们阅读教材第67-70页内容。
学生活动:学生阅读教材第67-70页内容。
板书:一、钠原子的结构
钠原子的结构示意图:
思考:根据钠原子的原子结构示意图,推测钠的化学性质稳定还是不稳定?为什么?
学生回答:
讲解:钠原子最外层只有一个电子,很容易失去一个电子,表现出还原性。
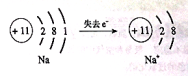
钠的化学性质很活泼,能与很多物质发生化学反应,生成钠的化合物,表现出还原性。
学生活动1:观看钠切割视频。
板书:二、物理性质
钠是一种银白色的金属,质软,密度为0.97g.cm-3,熔点为97.8℃。
学生活动2:观看钠在空气中燃烧视频,注意观察反应中的现象。
板书:三、化学性质
1、与非金属反应:O2、Cl2、S等
(1)与O2反应:
①常温:4Na+O2==2Na2O(白色)
现象:表面迅速变暗
讲解:氧化钠是碱性氧化物,能与水反应生成碱,或与酸溶液反应生成盐和水。
Na2O + H2O == 2NaOH
2Na2O + 2HCl == 2NaCl + 2H2O
②加热或点燃:2Na + O2 == Na2O2(淡黄色)
现象:加热熔化成光亮的小球,燃烧,黄色火焰,产生淡黄色物质。
讲解:过氧化的是一种淡黄色的固体,具有强氧化性,可与水反应生成氢氧化钠和氧气,也可与二氧化碳反应生成碳酸钠和氧气。因此,过氧化钠可作漂白剂和呼吸面具中的供氧剂。
2Na2O2 + 2H2O == 4NaOH + O2↑
2Na2O2 + 2CO2 == 2Na2CO3 + O2↑
(2)与氯气反应:
2Na + Cl2 == 2NaCl
现象:黄色火焰,冒白烟。
学生活动:学生观看钠与氯气反应视频
(3)与S反应
2Na + S == Na2S
讲解:钠的性质很活泼,能与很多非金属发生化学反应。在反应中失去电子,表现出还原性。
过度:钠单质除与非金属反应外,还可与水发生反应
学生活动:观看钠与水反应视频,同时观察反应现象。
板书:2、与水反应
现象:浮----钠的密度比水的密度小。
熔----钠熔化成小球,说明钠与水反应放出热量。
游----小球四处流动,说明有气体生成,证明产生了氢气。
响----有“嘶嘶”的响声,是氢气的轻微爆炸。
红----向反应后的溶液中滴加酚酞试剂,溶液变红色,说明溶液显碱性。
板书:2Na + 2H2O == 2NaOH + H2↑(反应剧烈)
思考:通过上述学习我知道了钠的化学性质很活泼,能与很多物质发生化学反应,所以自然界中不存在游离态,只存在化合态,而且要保存在煤油中。那么,怎样制备钠单质呢?
板书:四、钠的制备
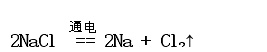 讲解:工业上采用电解熔融状态的氯化钠来制备钠单质。
讲解:工业上采用电解熔融状态的氯化钠来制备钠单质。
学生活动:阅读教材第69-70页的“科学史话”。
过度:钠有哪些的用途呢?
板书:五、钠的用途
1、制备高压钠灯。发出的黄光射程远,透雾能力强、常用于道路和广场的照明。
2、钠和钾形成的合金熔点低,常温下呈液态,导热性好,可用作快中子反应堆的热交换剂。
3、利用钠的强还原性,在一定条件下还可以将钛、钻、银等稀有金属从其氯化物中置换出来,
![]() 例如:
例如:
课堂小结:钠最外层只有一个电子,在化学反应很容易失去一个电子,表现出强还原性,在化学反应中做还原剂。能与非金属、水等众多物质发生反应,有很广泛的用途。工业上采用电解法来制备钠单质。
![]()
本节课从钠原子的原子结构出发,分析了钠的物理性质、化学性质、工业制备和用途。突出了化学学习中的“结构决定性质”这一特点。









