


所属成套资源:【同步教案】 鲁科版(2019)高中化学 选择性必修一 同步教案
鲁科版 (2019)选择性必修1第1节 化学反应的方向精品教案设计
展开
这是一份鲁科版 (2019)选择性必修1第1节 化学反应的方向精品教案设计,共6页。教案主要包含了教学目标,教学过程,针对练习,情景引入,问题指导,教师指导,展示图片等内容,欢迎下载使用。
第二章第1节 化学反应的方问 教学设计 【教学目标】知识与技能目标:(1)通过介绍熵的概念,使学生知道化学反应存在熵变。(2)通过分析反应的熵变与反应的方向,使学生了解反应熵变与反应方向有关,但不是唯一的影响因素。过程与方法目标:结合实际现象几相关化学知识理解化学反应进行的方向。情感态度与价值观目标:通过对本节内容的学习,初步树立起辩证唯物主义的世界观,激发探求未知知识的兴趣。 【教学过程】环节教师活动学生活动设计意图复习回顾【提问】 1、什么是自发反应?请举例说明。 2、焓变时如何影响反应方向的?【针对练习】下列叙述正确的是 ( )A.焓变为正的反应都是吸热反应B.焓变为负的反应都能自发进行C.焓变为正的反应不能自发进行D.化学反应焓变直接决定反应方向 思考回答:在温度压强一定的条件下,不借助光、电等外部力量就能自动进行的反应称为自发反应。比如燃烧;△H<0有利于自反进行,但有些△H>0的反应也能自发进行。即焓变时判断反应方向的重要依据,但不是唯一依据。 答:A 检查学生对上节课学习的知识的掌握情况,为本节课的引入做好铺垫。 检查学生对上节课知识的理解情况。创设情境【情景引入】你已知道,硝酸铵溶于水是吸热过程,氢氧化钠溶于水是放热过程,而蔗糖溶于水热效应微乎其微。这也说明了焓变并不是决定反应方向的唯一依据。那么,你能说出这三个过程的共同点吗? 【问题指导】同学们给出的两种说法差不多,而且都很好。但是请大家思考,这两种说法有什么不妥吗? 小范围讨论:1、它们溶于水都电离成阴、阳离子了。 2、它们都从块状固体,分散成了肉眼看不见的微粒。 思考回答:蔗糖是非电解质,溶于水时不电离。 聆听 培养学生思考问题能力、语言表达能力。 学生给出的两个问题都是经过思考了的,但是很显然,第一个说法是错误的,蔗糖是非电解质,溶于水时是不电离的 。培养学生辨别问题的能力。 【讲解】同学们说的很好。它们都是由不同微粒构成的,但是这些微粒本来是有序的、紧密的排列在一起的,但是溶于水后,都变成了混乱的了。自主学习【教师指导】请同学们阅读教材,回答一下问题:1、什么是熵?用什么表示?2、不同物质的熵相同吗?同种物质的熵与什么有关? 3、什么是熵变?如何表示?阅读教材回答:1、熵是用来表示体系物理量的物理量,用S表示,S越大说明体系混乱度越大。2、同一条件下,不同物质的S不同,同种物质的S与其聚集状态有关:S(g)>S(l)>S(s)。3、熵变△S=S(反应产物)-S(反应物)。△S>0表示熵增加,△S<0表示熵减小。 培养学生自主学习能力、信息提取能力、语言表达能力。板书§2-1-2 反应熵变与反应方向一、熵、熵变1、熵:描述体系混乱度的物理量2、S(g)>S(l)>S(s)3、熵变:△S=S(反应产物)-S(反应物)。△S>0即熵增加,△S<0即熵减小理解 笔记 是知识系统化。情境创设【设疑】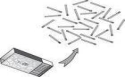 我们下面从反应熵变即混乱度的角度考虑,熵变对反应方向会有何影响呢?【展示图片】 读图思考回答:熵增加是有利于自发进行的。 用图片启发学生,熵增加是有利于反应自发进行的。理论联系实际,培养学生严谨的科学态度。知识深化【讲评】同学们回答的对! 【讲解】有很多的△S>0的反应在常温、常压下是能够自发进行的,如:2H2O2(aq)=2H2O(l)+O2(g) △S=57.2J·mol-1·K-1有些△S>0的反应在常温、常压下不能自发进行,但是在较高温度下就能自发进行了,如:CaCO3(s)=CaO(s)+CO2(g) △S=169.6J·mol-1·K-1事实上,还有一些△S<0的反应在一定条件下也能自发进行,比如:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △S=-39.4J·mol-1·K-1 【设疑】请同学们思考,这说明什么? 聆听 思考 了解 思考小范围讨论回答:这说明熵增加有利于反应自发进行,但是熵减小的反应有时也可以自发进行,熵变(△S)也只是一个与反应能否自发进行有关的因素,但不是唯一因素。 介绍熵变对反应方向的影响,并通过举例构成思想冲突:并不是所有的△S>0的反应在任何条件下都能自发进行,也并不是所有△S<0的反应不能自发进行。 意在培养学生辩证的唯物主义思想。 锻炼学生的思考、分析问题能力和语言表达能力。板书二、熵变对反应方向的影响△S>0有利于反应自发进行△S<0不利于反应自发进行△S影响反应方向,但不是唯一因素聆听 笔记 使所学知识系统化。学生练习【针对练习】下列过程中△S<0的是 ( )A.H2O(l)=H2O(g)B.C(s)+H2O(g)=CO(g)+H2(g)C.N2(g)+3H2(g)=2NH3(g)D.2H2O(l)=2H2(g)+O2(g) 读题解答:C 针对性练习巩固。课堂小结【教师指导】请同学们回顾本节课,尝试复述所学内容,并交流共享你的收获。思考讨论、交流回答: 这节课学习了一个描述体系混乱度的物理量——熵。了解了熵增加有利于反应自发进行,熵减小不利于反应自发进行。但是熵变也不是决定反应方向的唯一因素。 拓展延伸 【设疑】通过前两节课的学习,我们已经知道,焓变和熵变都不是觉得反应方向的唯一因素。请同学们思考,既然△H>0不利于反应自发进行,为什么还有些能够自发进行?还有△S<0不利于自发进行,为什么有些能够自发进行?【讲评】回答的很好。化学反应能否在一定条件下自发进行,既与焓变有关,由于熵变有关,我们不能只考虑单一因素。下节课,我们将一起探讨:到底什么因素决定了反应方向,请大家提前预习。 思考小范围讨论回答:△H>0(不利于自发)时有可能△S>0(有利于自发),△S<0(不利于自发)时有可能△H<0(有利于自发)。 聆听 整合两节课的学习内容,让学生前后联系,使知识完整、系统。 通过学生的讨论回答,让学生知道思考问题要考虑大局、考虑全面,培养学生思考、解决问题的能力。 化学反应方向的判断依据1.焓判据(1)焓变(ΔH)只与反应体系的始态和终态有关,与反应进行的途径无关。(2)焓变(ΔH)是决定反应能否自发进行的一个因素,但不是唯一因素。(3)ΔH<0时,反应有自发进行的倾向。2.熵判据(1)对于确定的化学反应,在一定条件下,具有确定的熵变。(2)熵变(ΔS)只与反应体系的始态和终态有关,与反应进行的途径无关。(3)熵变(ΔS)是决定反应能否自发进行的一个因素,但不是唯一因素。(4)熵增加(ΔS>0)有利于反应的自发进行。3.复合判据ΔH-TΔS(1)放热和熵增加都对ΔH-TΔS<0有所贡献,因此放热的熵增加反应一定能自发进行,吸热的熵减小反应一定不能自发进行。(2)当反应的焓变和熵变的影响相反时,如果二者相差悬殊,某一因素可能占主导地位,若二者相差不大时,温度有可能对反应的方向起决定性作用。用大爆炸宇宙学来观测事实大爆炸宇宙学是现代宇宙学中最有影响的一种学说,与其它宇宙模型相比,它能说明较多的观测事实。它的主要观点是认为我们的宇宙曾有一段从热到冷的演化史。在这个时期里,宇宙体系并不是静止的,而是在不断地膨胀,使物质密度从密到稀地演化。 这一从冷到热,从密到稀的过程如同一次规模很大的爆发。 根据大爆炸宇宙学的观点,大爆炸的整个过程是:在宇宙的早期,温度极高,在100亿度以上。物质密度也相当大,整个宇宙体系达到平衡。宇宙间只有中子、质子、电子、光子和中微子等一些基本粒子形态的物质。但是因为整个体系在不断膨胀,结果温度很快下降。当温度降到10亿度左右时,中子开始失去自由存在的条件,它要么发生衰变,要么与质子结合成重氢、氦等元素;化学元素就是从这一时期开始形成的。 温度进一步下降到100万度后,早期形成化学元素的过程结束。宇宙间的物质主要是质子、电子、光子和一些比较轻的原子核。当温度降到几千度时,辐射减退,宇宙间主要是气态物质,气体逐渐凝聚成气云,再进一步形成各种各样的恒星体系,成为我们今天看到的宇宙。 大爆炸模型能统一说明以下几个观测事实: 1、大爆炸理论主张所有恒星都是在温度下降后产生的,因而任何天体的年龄都应比自温度至今天这一段时间为短,即应小于200亿年。各种天体年龄的测量证明了这一点。 2、观测到河外天体有系统性的谱线红移,而且红移与距离大体成正比。如果用多普勒效应来解释,那么红移就是宇宙膨胀的反映。 3、在各种不同天体上,氦丰度相当大,而且大都是30%。用恒星核反应机制不足以说明为什么又如此多的氦。而根据大爆炸理论,早期温度很高,产生氦的效率也很高,则可以说明这一事实。 4、根据宇宙膨胀速度以及氦丰度等,可以具体计算宇宙每一历史时期的温度。大爆炸理论的创始人之一伽莫夫曾预言今天的宇宙已经很冷,只有绝对温度几度。1965年,果然在微波波段上探测到具有热辐射谱的微波背景辐射,温度大约为3K。这一结果无论在定性上或者定量上都与大爆炸理论的预言相符。但是,在星系的起源和各向同性分布等方面,大爆炸宇宙学还存在一些未解决的困难问题。
我们下面从反应熵变即混乱度的角度考虑,熵变对反应方向会有何影响呢?【展示图片】 读图思考回答:熵增加是有利于自发进行的。 用图片启发学生,熵增加是有利于反应自发进行的。理论联系实际,培养学生严谨的科学态度。知识深化【讲评】同学们回答的对! 【讲解】有很多的△S>0的反应在常温、常压下是能够自发进行的,如:2H2O2(aq)=2H2O(l)+O2(g) △S=57.2J·mol-1·K-1有些△S>0的反应在常温、常压下不能自发进行,但是在较高温度下就能自发进行了,如:CaCO3(s)=CaO(s)+CO2(g) △S=169.6J·mol-1·K-1事实上,还有一些△S<0的反应在一定条件下也能自发进行,比如:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △S=-39.4J·mol-1·K-1 【设疑】请同学们思考,这说明什么? 聆听 思考 了解 思考小范围讨论回答:这说明熵增加有利于反应自发进行,但是熵减小的反应有时也可以自发进行,熵变(△S)也只是一个与反应能否自发进行有关的因素,但不是唯一因素。 介绍熵变对反应方向的影响,并通过举例构成思想冲突:并不是所有的△S>0的反应在任何条件下都能自发进行,也并不是所有△S<0的反应不能自发进行。 意在培养学生辩证的唯物主义思想。 锻炼学生的思考、分析问题能力和语言表达能力。板书二、熵变对反应方向的影响△S>0有利于反应自发进行△S<0不利于反应自发进行△S影响反应方向,但不是唯一因素聆听 笔记 使所学知识系统化。学生练习【针对练习】下列过程中△S<0的是 ( )A.H2O(l)=H2O(g)B.C(s)+H2O(g)=CO(g)+H2(g)C.N2(g)+3H2(g)=2NH3(g)D.2H2O(l)=2H2(g)+O2(g) 读题解答:C 针对性练习巩固。课堂小结【教师指导】请同学们回顾本节课,尝试复述所学内容,并交流共享你的收获。思考讨论、交流回答: 这节课学习了一个描述体系混乱度的物理量——熵。了解了熵增加有利于反应自发进行,熵减小不利于反应自发进行。但是熵变也不是决定反应方向的唯一因素。 拓展延伸 【设疑】通过前两节课的学习,我们已经知道,焓变和熵变都不是觉得反应方向的唯一因素。请同学们思考,既然△H>0不利于反应自发进行,为什么还有些能够自发进行?还有△S<0不利于自发进行,为什么有些能够自发进行?【讲评】回答的很好。化学反应能否在一定条件下自发进行,既与焓变有关,由于熵变有关,我们不能只考虑单一因素。下节课,我们将一起探讨:到底什么因素决定了反应方向,请大家提前预习。 思考小范围讨论回答:△H>0(不利于自发)时有可能△S>0(有利于自发),△S<0(不利于自发)时有可能△H<0(有利于自发)。 聆听 整合两节课的学习内容,让学生前后联系,使知识完整、系统。 通过学生的讨论回答,让学生知道思考问题要考虑大局、考虑全面,培养学生思考、解决问题的能力。 化学反应方向的判断依据1.焓判据(1)焓变(ΔH)只与反应体系的始态和终态有关,与反应进行的途径无关。(2)焓变(ΔH)是决定反应能否自发进行的一个因素,但不是唯一因素。(3)ΔH<0时,反应有自发进行的倾向。2.熵判据(1)对于确定的化学反应,在一定条件下,具有确定的熵变。(2)熵变(ΔS)只与反应体系的始态和终态有关,与反应进行的途径无关。(3)熵变(ΔS)是决定反应能否自发进行的一个因素,但不是唯一因素。(4)熵增加(ΔS>0)有利于反应的自发进行。3.复合判据ΔH-TΔS(1)放热和熵增加都对ΔH-TΔS<0有所贡献,因此放热的熵增加反应一定能自发进行,吸热的熵减小反应一定不能自发进行。(2)当反应的焓变和熵变的影响相反时,如果二者相差悬殊,某一因素可能占主导地位,若二者相差不大时,温度有可能对反应的方向起决定性作用。用大爆炸宇宙学来观测事实大爆炸宇宙学是现代宇宙学中最有影响的一种学说,与其它宇宙模型相比,它能说明较多的观测事实。它的主要观点是认为我们的宇宙曾有一段从热到冷的演化史。在这个时期里,宇宙体系并不是静止的,而是在不断地膨胀,使物质密度从密到稀地演化。 这一从冷到热,从密到稀的过程如同一次规模很大的爆发。 根据大爆炸宇宙学的观点,大爆炸的整个过程是:在宇宙的早期,温度极高,在100亿度以上。物质密度也相当大,整个宇宙体系达到平衡。宇宙间只有中子、质子、电子、光子和中微子等一些基本粒子形态的物质。但是因为整个体系在不断膨胀,结果温度很快下降。当温度降到10亿度左右时,中子开始失去自由存在的条件,它要么发生衰变,要么与质子结合成重氢、氦等元素;化学元素就是从这一时期开始形成的。 温度进一步下降到100万度后,早期形成化学元素的过程结束。宇宙间的物质主要是质子、电子、光子和一些比较轻的原子核。当温度降到几千度时,辐射减退,宇宙间主要是气态物质,气体逐渐凝聚成气云,再进一步形成各种各样的恒星体系,成为我们今天看到的宇宙。 大爆炸模型能统一说明以下几个观测事实: 1、大爆炸理论主张所有恒星都是在温度下降后产生的,因而任何天体的年龄都应比自温度至今天这一段时间为短,即应小于200亿年。各种天体年龄的测量证明了这一点。 2、观测到河外天体有系统性的谱线红移,而且红移与距离大体成正比。如果用多普勒效应来解释,那么红移就是宇宙膨胀的反映。 3、在各种不同天体上,氦丰度相当大,而且大都是30%。用恒星核反应机制不足以说明为什么又如此多的氦。而根据大爆炸理论,早期温度很高,产生氦的效率也很高,则可以说明这一事实。 4、根据宇宙膨胀速度以及氦丰度等,可以具体计算宇宙每一历史时期的温度。大爆炸理论的创始人之一伽莫夫曾预言今天的宇宙已经很冷,只有绝对温度几度。1965年,果然在微波波段上探测到具有热辐射谱的微波背景辐射,温度大约为3K。这一结果无论在定性上或者定量上都与大爆炸理论的预言相符。但是,在星系的起源和各向同性分布等方面,大爆炸宇宙学还存在一些未解决的困难问题。
相关教案
这是一份高中化学鲁科版 (2019)选择性必修1第3节 沉淀溶解平衡一等奖教案,共3页。教案主要包含了四溶洞和珊瑚的形成等内容,欢迎下载使用。
这是一份鲁科版2019 高中化学 选修一 2.4《化学反应条件的优化——工业合成氨》教学设计,共7页。教案主要包含了复习引入,拓展视野,交流·研讨,活动探究,知识前沿等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第1节 元素与物质分类教案,共5页。教案主要包含了简单介绍,课堂练习等内容,欢迎下载使用。










