课题 | 化学反应条件的优化——工业合成氨 | 授课人 | |
教学目标 | 知识与技能 1.学生理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。 2.学生了解应用化学原理选择化工生产条件的思路和方法。 过程与方法 1.教学时应以化学反应速率和化学平衡原理为主线,以合成氨知识为中心,结合工业生产的实际情况,将知识串联、拓展、延伸,培养学生的归纳思维能力。 2.在运用理论的过程中,可以进一步加深学生对所学理论的理解和提高知识的实际应用能力。 情感态度与价值观 1.通过了解合成氨的全过程,可以激发学生爱科学、探索科学的热情。 2.通过合成氨前景的展望,激发学生学习兴趣,使学生体会化学学科中逻辑结构严谨深刻的科学美。 |
重点难点 | 应用化学反应速率和化学平衡原理选择合成氨的适宜条件 |
教学方法 | 讲授法、小组讨论法、自学法 |
教学用具 | 多媒体设备 |
教学过 程 | 教师活动预设 | 学生活动预期 | 设计意图 |
新 课 引 入 | 【复习引入】化学反应方向,限度,平衡状态复习。 影响化学反应速率和化学反应平衡移动的因素复习 【板书】化学反应条件的优化——工业合成氨 【拓展视野】合成氨反应发展的漫长而又艰难的历程。 【过渡】假如你是哈伯,让我们一起探究工业合成氨的最适宜条件。选择适宜条件的目的应该是加快速率,提高产率,那么选择适宜条件的依据又是什么? | 讨论后回答:选择适宜生产条件的依据为外界条件对化学平衡和化学反应速率影响。 | 引入新课,激发兴趣。 通过事例分析指出本节重点及学习方法,明确学生的学习方向 |
判断合成氨反应能否自发进行 | 【过渡】阅读教材P65页,分析反应的可行性。 【交流·研讨】合成氨反应是一个可逆反应:N2(g)+3H2(g) 2NH3(g)已知298K时,△H=-92.2kJ·mol-1 2NH3(g)已知298K时,△H=-92.2kJ·mol-1 △S=-198.2J·K-1·mol-1 请根据正反应的焓变和熵变分析298K下合成氨反应能否自发进行。 | 学生讨论分析反应特点: 合成氨反应为放热、气态物质系数减少的可逆反应。 △H-T△S =-92.2kJ·mol-1-298K×(-198.2J·K-1·mol-1)<0 298K时,合成氨反应是可以自发进行的。 | 为讨论合成氨适宜生产条件做准备。使学生体会一般的研究思路:第一步是先判断反应的方向,再利用平衡移动 |
合成氨反应的限度 | 【活动探究】请同学们根据合成氨反应的特点,利用影响化学平衡移动的因素,分析什么条件有利于氨的合成? 【板书】一、合成氨反应的限度 【讲述】如图2-4-3所示,在不同反应温度、压强下反应达平衡时,平衡混合物中氨含量的测定结果与上述理论分析结果一致。 进一步研究发现,在一定的温度、压强下,反应物氮气、氢气的体积比为1:3时平衡混合物中氨的含量最高。 | 学生讨论回答: 降低温度、增大压强有利于化学平衡向生成氨的方向移动;N2、H2的体积比为1:3时平衡混合物中氨的含量最高。 学生观看图2-4-3进行分析。 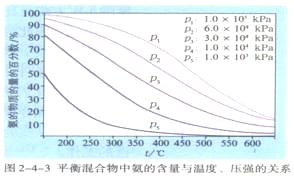
| 原理分析如何提高氨的产量。 |
合成氨反应的速率 | 【过渡】在寻找最佳的生产条件时,除了考虑反应的限度时,还需要研究采取哪些措施来提高化学反应速率。 【板书】二、合成氨反应的速率 【交流·研讨】 1、结合影响反应速率的因素,思考什么条件能提高合成氨反应的速率? 2、实验表明,在特定条件下,合成氨反应的速率与参与反应的物质的浓度的关系为v =kc(N2)c1.5(H2)c-1(NH3) 请你根据关系式分析:各物质的浓度对反应速率有哪些影响?可以采取哪些措施来提高反应速率? 3、请你根据下表所给的数据分析催化剂对合成氨反应速率的影响: 【补充】除此之外,温度对合成氨反应的速率也有显著影响:温度越高,反应进行得越快。 | 学生分析回答: 1、升高温度 增大压强 增大反应物浓度 使用催化剂 2、增大N2、H2浓度,将氨及时从混合气中分离出去 3、分析下表所给的数据使用催化剂可使合成氨反应的速率提高上万亿倍。 表2-4-1 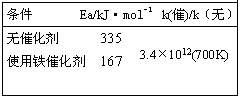
| 让学生从整体上对影响化学反应速率的各种影响进行定性分析。 |
结合生产实际选择合成氨的适宜条件 | 【板书】三、合成氨的适宜条件 【交流·研讨】根据合成氨反应的特点,应分别采取什么措施提高反应的平衡转化率和反应速率?请将你的建议填入下表。 在合成氨生产中,达到高转化率与高反应速率所需要的条件有时是相互矛盾的。由理论分析再结合生产实际(高压对设备材质、加工制造的要求和所需能耗多少、温度对催化剂活性的影响等)讨论:⑴既然增大压强既可提高反应速率,又可提高氨的产量,那么在合成氨工业中压强是否越大越好? ⑵要不要催化剂呢? ⑶既然降低温度有利于平衡向生成氨的方向移动,那么生产中是否温度越低越好? ⑷从气体在催化剂表面的吸附问题讨论浓度比。 【讲述】因此,选择合成氨的条件时,既不能片面地追求高转化率,也不能只追求高反应速率,应该寻找以较高的反应速率获得适当平衡转化率的反应条件。此外,还应该考虑原料的价格、未转化的合成气的循环使用、反应热的综合利用等问题。 【总结】合成氨的适宜条件: 选择铁做催化剂;反应温度在700K左右;根据反应器可使用的钢材质量及综合指标来选择压强,大致分为低压(1×107Pa)、中压(2×107~3×107Pa)和高压(8.5×107~1×108Pa)三种类型;n(N2):n(H2)=1:2.8。 | 学生讨论后完成下表 外界条件 | 使NH3产率高 | 使NH3生产的快 | 平衡分析 | 速率分析 | 压强 | | | 温度 | | | 催化剂 | | | 反应物浓度 | | | 生成物浓度 | | |
|
复习、整理关于化学反应的方向、限度和速率的理论知识并查阅资料回答: ⑴ 虽然增大压强既可提高反应速率,又可提高氨的产量,但是我们应该考虑到反应器材质及综合指标来选择压强,并非是越大越好。 ⑵ 选择合适的催化剂 ⑶ 低温虽然有利于平衡向生成氨的方向移动,但低温时反应速率低,所以生产中温度不是越低越好。考虑到催化剂活性,应选择适宜的温度。 ⑷ 学生阅读教材后得出 n(N2):n(H2)=1:2.8 | 通过交流研讨使学生体会这是用理论解决实际生产的一个重要步骤,需要综合评价限度与速率的影响,还必须考虑实际工艺技术等各方面因素。 归纳出合成氨生产的适宜条件,引导思考的方向,结合生产数据介绍合成氨实际生产条件,使学生在解决实际生产的过程中进一步加深对所学理论的理解。 |
合成氨的生产流程 | 【板书】合成氨的生产流程 (1)原料气的制备 N2来自空气,H2 来自水中CH4+H2O=CO+3H2 CO+H2O=CO2+H2 (2)净化 消除造气过程中夹带着的杂质,防止催化剂中毒。 (3)合成氨 【简介】国合成氨工业的发展情况。 | 学生认真听讲,观看课本合成氨工艺生产流程图。 | 加深学生对化工生产的了解。 让学生了解我国合成氨工业发展历程,目前我国合成氨工业从生产能力和产量上都位居世界前列,对他们进行情感态度与价值观教育。 |
| 【知识前沿】化学模拟生物固氮 根瘤菌,生物固氨。常温常压下进行。成本低、转化率高、效率高。 模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。 | 学生听讲,思考。 | 让学生了解科学前沿和科技发展动态。 |
课堂小结 | 结合理论依据和生产实际,适宜的合成氨条件为: 铁催化剂,700K,根据反应器选择压强,n(N2):n(H2)=1:2.8 |
学以致用 | 【大屏幕】 1.已知 2SO2(g)+O2(g  2SO3 (g) △H <0 2SO3 (g) △H <0 请应用已有知识分析工业合成SO3 的适宜条件。 【变式】已知 2SO2(g)+O2(g)  2SO3 (g) △H<0 2SO3 (g) △H<0 请据右表数据分析。 2.根据合成氨反应的特点分析,当前最有前途的研究发展方向是( ) A.研制耐高压的合成塔 B.采用超大规模的工业生产 C.研制耐低温复合催化剂 D.探索不用H2和N2合成氨的新途径 3.不能用化学平衡移动原理说明的事实是( ) A.合成氨在高压下进行是有利的 B.温度过高对合成氨不利 C.使用催化剂能使合成氨速率加快 D.及时分离从合成塔中出来的混合气,有利于合成氨 | 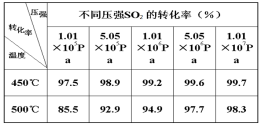
学生思考、回答 | 学生分析解答,进一步加深了本节课的理论和认识。 |
板书设计: 第4节化学反应条件的优化——工业合成氨 一、合成氨反应的限度 有利于化学平衡向生成氨的方向移动的影响因素:降低温度、增大压强、n(N2):n(H2)=1:3 二、合成氨反应的速率 有利于加快生成氨速率的影响因素:升高温度、增大压强、使用催化剂、增大反应物浓度、减小生成物浓度。 三、合成氨的适宜条件 结合生产实际,适宜的合成氨条件为: 铁催化剂,700K,根据反应器选择压强,n(N2):n(H2)=1:2.8 |
| | | | | | |



















