


所属成套资源:【同步练习】高中化学苏教版(2019)必修第一册同步练习与单元检测(含答案)
苏教版 (2019)第二单元 微粒之间的相互作用优秀同步测试题
展开
这是一份苏教版 (2019)第二单元 微粒之间的相互作用优秀同步测试题,共6页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
![]() 5.2微粒之间的相互作用 一、单选题1.下列有关化学用语的表示,正确的是( )A.氨基负离子(NH2-)的电子式:
5.2微粒之间的相互作用 一、单选题1.下列有关化学用语的表示,正确的是( )A.氨基负离子(NH2-)的电子式:![]() B.钾离子的结构示意图:
B.钾离子的结构示意图: C.CS2分子的比例模型:
C.CS2分子的比例模型: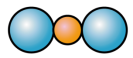 D.碳酸的电离方程式:H2CO3
D.碳酸的电离方程式:H2CO3![]() CO32-+2H+2.下列化学用语正确的是A.
CO32-+2H+2.下列化学用语正确的是A.![]() 、
、![]() 、
、![]() 是氢元素的三种不同粒子 B.
是氢元素的三种不同粒子 B.![]() 和
和![]() 互为同位素C.
互为同位素C.![]() 的结构示意图为
的结构示意图为 D.
D.![]() 中质子数和中子数相差1473.不含共价键的离子化合物是A.CaBr2 B.NaClO C.NH4Cl D.NaOH4.我国汉代器物和秦俑彩绘用的颜料“汉紫”,直到近来人们才研究出来,其成分为紫色的硅酸铜钡(铜为+2价),它的化学式为:BaCuSi2Ox,则x的值为A.3 B.4 C.5 D.65.下列相关的化学用语表示正确的是A.氨气的电子式:
中质子数和中子数相差1473.不含共价键的离子化合物是A.CaBr2 B.NaClO C.NH4Cl D.NaOH4.我国汉代器物和秦俑彩绘用的颜料“汉紫”,直到近来人们才研究出来,其成分为紫色的硅酸铜钡(铜为+2价),它的化学式为:BaCuSi2Ox,则x的值为A.3 B.4 C.5 D.65.下列相关的化学用语表示正确的是A.氨气的电子式:![]() B.乙炔分子的球棍模型:
B.乙炔分子的球棍模型:![]() C.CH4分子的空间充填模型:
C.CH4分子的空间充填模型: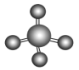 D.乙烷的分子式: CH3CH36.下列说法正确的是( )A.分子间作用力与化学键的大小相当B.分子间作用力比化学键强得多C.分子间作用力主要影响物质的化学性质D.化学键存在于分子内部,分子间作用力存在于分子之间7.下列化学用语正确的是A.乙醇的球棍模型:
D.乙烷的分子式: CH3CH36.下列说法正确的是( )A.分子间作用力与化学键的大小相当B.分子间作用力比化学键强得多C.分子间作用力主要影响物质的化学性质D.化学键存在于分子内部,分子间作用力存在于分子之间7.下列化学用语正确的是A.乙醇的球棍模型: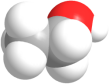 B.质子数为17、中子数为20的氯原子:
B.质子数为17、中子数为20的氯原子:![]() C.过氧化钠的电子式:
C.过氧化钠的电子式:![]() D.草酸的电离方程式:
D.草酸的电离方程式:![]() 8.科学家研究发现普通盐水在无线电波的照射下可以燃烧,其原理是具有一定频率的无线电可以削弱盐水中所含元素原子之间的“结合力”,释放出氢原子和氧原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是A.离子键 B.离子键与共价键 C.共价键 D.氢键9.下列物质中属于含有共价键的离子化合物的是A.NaCl B.CH3COONH4 C.AlCl3 D.H2SO410.下列物质是共价化合物的是A.H2O2 B.NH4Cl C.N2 D.Na2O211.下列物质中属于含有共价键的盐的是A.CaCl2 B.Na2CO3 C.KOH D.H2S12.下列含有离子键的碱是A.Ca(OH)2 B.Na2CO3 C.NH3 D.H2SO413.与NaCl化学键类型相同的物质是A.H2 B.HCl C.KCl D.CO214.下列关于化学概念的理解错误的是A.互为同分异构体的物质化学性质可能相似,可能差别较大B.离子化合物中离子键的强弱同时影响物理性质和化学性质C.酸碱中和生成1mol水放出的热量与溶液浓度、酸碱的强弱等因素有关D.常温下的气体摩尔体积一定大于
8.科学家研究发现普通盐水在无线电波的照射下可以燃烧,其原理是具有一定频率的无线电可以削弱盐水中所含元素原子之间的“结合力”,释放出氢原子和氧原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是A.离子键 B.离子键与共价键 C.共价键 D.氢键9.下列物质中属于含有共价键的离子化合物的是A.NaCl B.CH3COONH4 C.AlCl3 D.H2SO410.下列物质是共价化合物的是A.H2O2 B.NH4Cl C.N2 D.Na2O211.下列物质中属于含有共价键的盐的是A.CaCl2 B.Na2CO3 C.KOH D.H2S12.下列含有离子键的碱是A.Ca(OH)2 B.Na2CO3 C.NH3 D.H2SO413.与NaCl化学键类型相同的物质是A.H2 B.HCl C.KCl D.CO214.下列关于化学概念的理解错误的是A.互为同分异构体的物质化学性质可能相似,可能差别较大B.离子化合物中离子键的强弱同时影响物理性质和化学性质C.酸碱中和生成1mol水放出的热量与溶液浓度、酸碱的强弱等因素有关D.常温下的气体摩尔体积一定大于![]() 15.短周期主族元素X、Y、Z、R、W的原子序数依次增大,其中X的阴离子的核外电子数与Y、Z原子的核外内层电子数相同,Z原子的最外层电子数是内层电子数的3倍,R单质能在Y单质中燃烧,生成的二元化合物与H2O反应,产生的气体能使湿润的红色石蕊试纸变蓝,W与Z同主族。下列说明正确的是A.简单氢化物的沸点:Z>YB.简单离子半径r(W)>r(Z)>r(Y)C.X、Y、Z、W四种元素组成的化合物中只含有共价键D.氧化物对应水化物的酸性:Y<W 二、填空题16.下图为元素周期表的一部分:A B C DE 请回答下列问题:(1)A、B、C、D、E五种元素中原子半径最大的是___________(填元素符号)。(2)D在元素周期表中的位置是___________。(3)E的最高价氧化物对应的水化物的化学式为___________。(4)用电子式表示元素A与E的化合物的形成过程:___________。(5)化合物C2B2中含有的化学键类型是___________,C2B2与CO2反应的化学方程式为___________。(6)欲比较D与E的非金属性强弱,以下说法可作为判断依据的是___________。①比较D、E两种元素单质的沸点高低②比较D、E两种元素单质与H2化合的难易程度③比较D、E两种元素气态氢化物的稳定性④比较D、E两种元素的氧化物对应水化物的酸性强弱17.晶体的性质与晶体类型和结构紧密相关。(1)氯酸钾熔化时克服的作用力是______;二氧化硅熔化时克服的作用力是______;碘升华时克服的作用力是______。三种晶体的熔点由高到低的顺序是______(填化学式)。(2)下列六种晶体:①
15.短周期主族元素X、Y、Z、R、W的原子序数依次增大,其中X的阴离子的核外电子数与Y、Z原子的核外内层电子数相同,Z原子的最外层电子数是内层电子数的3倍,R单质能在Y单质中燃烧,生成的二元化合物与H2O反应,产生的气体能使湿润的红色石蕊试纸变蓝,W与Z同主族。下列说明正确的是A.简单氢化物的沸点:Z>YB.简单离子半径r(W)>r(Z)>r(Y)C.X、Y、Z、W四种元素组成的化合物中只含有共价键D.氧化物对应水化物的酸性:Y<W 二、填空题16.下图为元素周期表的一部分:A B C DE 请回答下列问题:(1)A、B、C、D、E五种元素中原子半径最大的是___________(填元素符号)。(2)D在元素周期表中的位置是___________。(3)E的最高价氧化物对应的水化物的化学式为___________。(4)用电子式表示元素A与E的化合物的形成过程:___________。(5)化合物C2B2中含有的化学键类型是___________,C2B2与CO2反应的化学方程式为___________。(6)欲比较D与E的非金属性强弱,以下说法可作为判断依据的是___________。①比较D、E两种元素单质的沸点高低②比较D、E两种元素单质与H2化合的难易程度③比较D、E两种元素气态氢化物的稳定性④比较D、E两种元素的氧化物对应水化物的酸性强弱17.晶体的性质与晶体类型和结构紧密相关。(1)氯酸钾熔化时克服的作用力是______;二氧化硅熔化时克服的作用力是______;碘升华时克服的作用力是______。三种晶体的熔点由高到低的顺序是______(填化学式)。(2)下列六种晶体:①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。18.非金属及其化合物种类繁多,用途广泛,在化工生产和经济发展中具有重要地位。(1)写出工业制硝酸的基础——氨的催化氧化___________(2)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2的方法来除去SO2.写出该反应的化学方程式:___________(3)(NH4)2Fe(SO4)2是一种重要的硫酸盐,写出其电离方程式___________(4)用电子式表示MgCl2的形成过程___________19.(1)下列属于吸热反应的是________;属于放热反应的是________。①煅烧石灰石 ②木炭燃烧 ③酸碱中和 ④二氧化碳和碳高温反应(2)
,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。18.非金属及其化合物种类繁多,用途广泛,在化工生产和经济发展中具有重要地位。(1)写出工业制硝酸的基础——氨的催化氧化___________(2)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2的方法来除去SO2.写出该反应的化学方程式:___________(3)(NH4)2Fe(SO4)2是一种重要的硫酸盐,写出其电离方程式___________(4)用电子式表示MgCl2的形成过程___________19.(1)下列属于吸热反应的是________;属于放热反应的是________。①煅烧石灰石 ②木炭燃烧 ③酸碱中和 ④二氧化碳和碳高温反应(2)![]() 熔点较低,易升华,溶于醇和醚,其与
熔点较低,易升华,溶于醇和醚,其与![]() 化学性质相似。由此可推断
化学性质相似。由此可推断![]() 的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。20.钠是一种非常活泼、具有广泛应用的金属。(1)钠的原子结构示意图为_______,钠在反应中容易_______电子(填“得到”或“失去”)。(2)某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解:2NaN3 = 2Na + 3N2,从而为气囊充气。其中Na是_______(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是_______。ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为_______。ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为_______g。 (保留小数点后一位。) 三、实验题21.过碳酸钠(Na2CO4)是一种很好的供氧剂,与稀盐酸发生反应的化学方程式为2Na2CO4 + 4HCl = 4NaCl + 2CO2↑ + O2↑ + 2H2O市售过碳酸钠中一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋(该气袋耐酸碱腐蚀),取适量样品于其中,打开分液漏斗活塞,将足量稀盐酸滴入气袋中至充分反应。
的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。20.钠是一种非常活泼、具有广泛应用的金属。(1)钠的原子结构示意图为_______,钠在反应中容易_______电子(填“得到”或“失去”)。(2)某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解:2NaN3 = 2Na + 3N2,从而为气囊充气。其中Na是_______(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是_______。ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为_______。ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为_______g。 (保留小数点后一位。) 三、实验题21.过碳酸钠(Na2CO4)是一种很好的供氧剂,与稀盐酸发生反应的化学方程式为2Na2CO4 + 4HCl = 4NaCl + 2CO2↑ + O2↑ + 2H2O市售过碳酸钠中一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋(该气袋耐酸碱腐蚀),取适量样品于其中,打开分液漏斗活塞,将足量稀盐酸滴入气袋中至充分反应。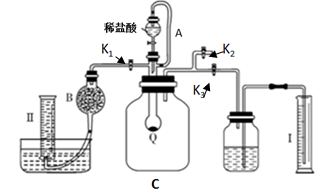 (1)过碳酸钠的化学式也可表示为 aNa2O2· bNa2CO3,请写出Na2O2的电子式:__________________(2)仪器B的名称为________,导管A的作用是_________________________________________(3)该实验共需测定两个数据,首先需测定反应所生成的气体的总体积,故滴加稀盐酸前必须关闭___和___并打开____(均填“K1”、“K2”或“K3”)(4)其次用量筒Ⅱ测定混合气体中某种成分的体积,则 B中装的固体试剂名称为_________,具体测定过程如下:当Q中反应停止后,使 K1 和 K3 处于关闭状态, K2处于打开状态,再缓缓打开K1即可。 (5)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是_____________(用含有x、y的代数式表示)。
(1)过碳酸钠的化学式也可表示为 aNa2O2· bNa2CO3,请写出Na2O2的电子式:__________________(2)仪器B的名称为________,导管A的作用是_________________________________________(3)该实验共需测定两个数据,首先需测定反应所生成的气体的总体积,故滴加稀盐酸前必须关闭___和___并打开____(均填“K1”、“K2”或“K3”)(4)其次用量筒Ⅱ测定混合气体中某种成分的体积,则 B中装的固体试剂名称为_________,具体测定过程如下:当Q中反应停止后,使 K1 和 K3 处于关闭状态, K2处于打开状态,再缓缓打开K1即可。 (5)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是_____________(用含有x、y的代数式表示)。
参考答案:1.C2.A3.A4.D5.B6.D7.D8.C9.B10.A11.B12.A13.C14.D15.A16.(1)Na(2)第三周期ⅥA(3)HClO4(4)![]() (5) 离子键、(非极性)共价键
(5) 离子键、(非极性)共价键 ![]() (6)②③ 17. 离子键 共价键 分子间作用力
(6)②③ 17. 离子键 共价键 分子间作用力 ![]() ①<⑤<③<②<④<⑥18.
①<⑤<③<②<④<⑥18. ![]()
![]() (NH4)2Fe(SO4)2=2NH
(NH4)2Fe(SO4)2=2NH![]() + Fe2++2SO
+ Fe2++2SO![]()
![]() 19. ①④ ②③ 共价键 分子晶体20.(1)
19. ①④ ②③ 共价键 分子晶体20.(1) 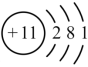 失去(2) 还原产物 6Na + Fe2O3 = 3Na2O + 2Fe 2NaHCO3
失去(2) 还原产物 6Na + Fe2O3 = 3Na2O + 2Fe 2NaHCO3 ![]() Na2CO3 + CO2 ↑ + H2O 32.3 21.
Na2CO3 + CO2 ↑ + H2O 32.3 21. ![]() 干燥管 平衡分液漏斗和反应体系内的压强,使稀盐酸顺利滴下,同时消除所滴下的稀盐酸体积对所测量气体体积的影响。 K1 K2 . K3 碱石灰(其他合理答案均可)
干燥管 平衡分液漏斗和反应体系内的压强,使稀盐酸顺利滴下,同时消除所滴下的稀盐酸体积对所测量气体体积的影响。 K1 K2 . K3 碱石灰(其他合理答案均可) ![]() ×100%
×100%
相关试卷
这是一份高中苏教版 (2019)第二单元 微粒之间的相互作用当堂检测题,共20页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用复习练习题,共23页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用复习练习题,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。










