






所属成套资源:苏教版化学选择性必修一课件全册
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优秀课件ppt
展开
这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优秀课件ppt,共30页。PPT课件主要包含了电解饱和食盐水,氢气和氯气,注意事项,硫酸铜浓度不变,①阴极-待镀金属,②阳极-镀层金属,作业布置等内容,欢迎下载使用。
1.能够对氯碱工业、电镀、电解精炼铜、电冶金等原理进行分析;2.认识电能与化学能的能量转换;3.加深对间接原理的理解和应用
用 的方法来制取 ,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
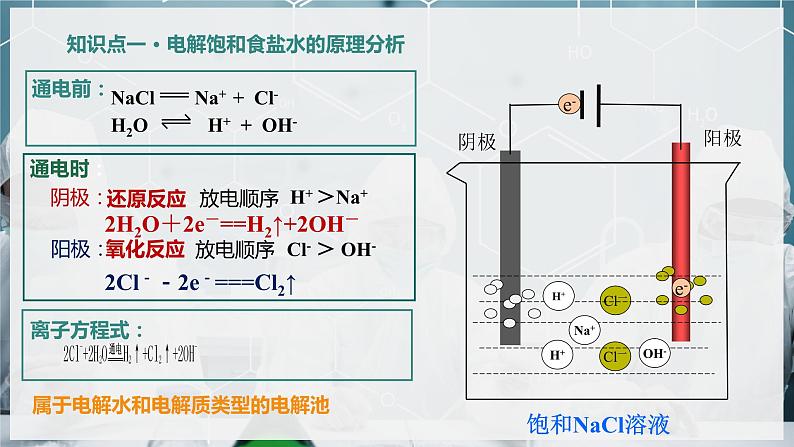
知识点一 · 电解饱和食盐水的原理分析
2Cl--2e-===Cl2↑
2H2O+2e-==H2↑+2OH-
属于电解水和电解质类型的电解池
知识点一·电解饱和食盐水
1.当电解过程中被电解的是水和电解质时,电极反应式中出现的是H+或OH-放电,但在书写总反应式时要将反应物中的H+或OH-均换成水,如电解饱和食盐水。
1.电解池中阴极、阳极的酸碱性如何变化?
阴极碱性增强,阳极酸性增强
2.工业电解饱和食盐水存在什么隐患?
(2)生成物H2和Cl2混合,混合后遇火或遇强光爆炸。
(1)Cl2接触NaOH溶液会反应,使产品不纯。反应方程式: .
Cl2 +2 NaOH =NaCl + NaClO + H2O
解决方法:使用离子交换膜
离子交换膜由高分子特殊材料制成,分三类:(1)阳离子交换膜,简称阳膜,只允许阳离子通过,不允许阴离子通过。(2)阴离子交换膜,简称阴膜,只允许阴离子通过,不允许阳离子通过。(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。
知识点一· 电解饱和食盐水
(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
如果得到产物NaOH,阴极侧生成OH-,还需要Na+移向阴极,而我们要避免OH-移向阳极与产物Cl2反应,所以应选择阳离子交换膜。
H2O(含少量NaOH)
电解饱和食盐水的原理示意图
电解帮助人类创造出更多自然界不存在的新物质,成为化学重要分支——电化学或能源化学的基础,因此也形成了电解工业。 电解的本质是使电流通过电解质溶液或熔融状态的电解质,而在阴阳两极引起氧化还原反应的过程。 电解除广泛应用于金属矿物冶炼、金属精炼外,还促进了电镀、污水处理等领域的技术革命,为新的制造业的发展提供了理论基础。
对于像钠、镁、铝这样非常活泼的金属,采用一般的还原剂很难将它们从其化合物中还原出来,工业上常用电解法冶炼。
知识点二 · 电解法冶炼活泼金属
AlCl3是共价化合物,不是电解质,不能电解。Al2O3是离子化合物;熔点2050℃,冰晶石在铝电解中作为助溶剂,降低氧化铝的熔点。
阳极--粗铜阴极--纯铜电解液-- CuSO4溶液
1.粗铜中含有的杂质:
Zn、Fe、Ni、Ag、Au等
知识点三 · 电解法精炼铜
粗铜的杂质中比铜活泼的金属(Zn、Fe、Ni)只溶解,不析出;比铜不活泼的金属(Au、Ag)不溶解,以金属单质形式沉淀。
Cu–2e- == Cu2+
Fe–2e- == Fe2+
Zn-2e-== Zn2+
阴极:放电顺序:Cu2+ > H+ > Fe2+
Cu2++2e-===Cu
2.铁作电解池的阳极时,铁并不是失去 3个 电子生成Fe3+,而是失去2个电子生成Fe2+;在阴极Fe3+得电子生成Fe2+,而不是铁单质。
4.电解精炼过程中的“两不等”:
①电解质溶液浓度在电镀前后不相等;
②阴极增加的质量和阳极减少的质量不相等。
电解后铜离子浓度减小,铁离子等浓度增加。
阴极得到精铜,由于阳极泥的存在,阳极减少的质量比应急增加的质量大。
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
增强金属抗腐蚀能力,增加美观和硬度。
1.铁制品应该在哪一极?2.电解质溶液中应该含有什么离子?3.另一极应该用什么材料做电极?
Cu2++2e-=Cu
Cu-2e-=Cu2+
电解一段时间后溶液中硫酸铜浓度怎样变化?
③电解液-含镀层金属阳离子的盐溶液
一多——阴极上有镀层金属沉积 一少——阳极上有镀层金属溶解 一不变——电解质溶液的浓度不变
3.若在铁片上镀锌,以下叙述错误的是( )《导与练》P31A.把铁片与电源的正极相连B.电解质必须用含有锌离子的可溶性盐C.锌极发生还原反应D.铁极的电极反应式为Zn2+ +2e-==Zn
应用电解原理在某些金属表面镀上一层其它金属的装置。
①镀层金属接电源正极,待镀金属接电源负极②电镀液须含有镀层金属的离子
阳极:镀层金属;阴极:镀件
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极②电解质溶液须待提纯金属的离子
阳极:不纯金属;阴极:纯金属
电解精炼池、电镀池的比较
4.粗铜精炼时,阴极增重与阳极减重不相等;电镀时两极质量变化相等。
电解原理及应用中常见误区
3.水溶液中,在金属活动性顺序表中排在氢前面的金属,其阳离子不一定不能放电,如:在镀件上镀锌,电解质溶液应是含Zn2+的浓溶液,在阴极Zn2+得电子生成Zn,而不是H+放电。
5.电解时的氧化产物或还原产物能与电解质溶液中的微粒发生反应时,应将该微粒写入电极反应式中。
知识点五 · 有关电解的计算
1.如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 ml·L-1的氯化铜溶液,B池中加入0.1 ml·L-1的硝酸银溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( ) A.2∶2∶4∶1B.1∶1∶2∶1C.2∶1∶1∶1D.2∶1∶2∶1
2.在100 mL硫酸和硫酸铜的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况),则原混合液中,Cu2+的物质的量浓度为( )A.1 ml·L-1B.2 ml·L-1C.3 ml·L-1D.4 ml·L-1
(1)电源中X极是 (填“正”或“负”)极。(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前 c(CuSO4)= 。(3)若A中KCl溶液的体积也是200 mL,则电解后溶液的c(OH-)= 。
3.如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
0.025 ml·L-1
1.《课时作业》第157~159页2.预习金属的腐蚀与防护
相关课件
这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优质ppt课件,共27页。PPT课件主要包含了电解熔融氯化钠,课堂小结,习题探究等内容,欢迎下载使用。
这是一份高中化学第二单元 化学能与电能的转化公开课课件ppt,共31页。PPT课件主要包含了化学能与电能的转化,主要内容,主要特点,学习方法,两极一液一连线,习题探究,作业布置等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化背景图课件ppt,共10页。PPT课件主要包含了学习目标,电解饱和食盐水,电镀与电解精炼,电镀铜与精炼铜的比较,电冶金等内容,欢迎下载使用。










