





化学选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt
展开1.认识化学平衡常数是表征反应限度的物理量2.知道化学平衡常数的含义
v正(B)= v逆(B) ≠0
反应混合物中各组分的浓度保持不变
反应总压强、物质的量、质量等保持不变
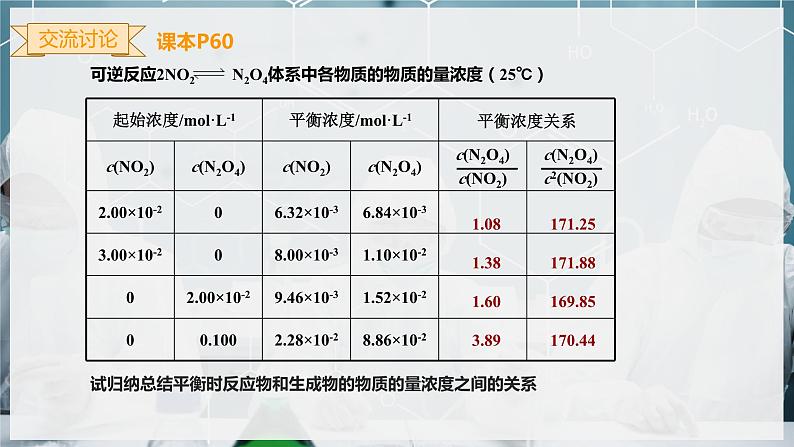
可逆反应2NO2 N2O4体系中各物质的物质的量浓度(25℃)
试归纳总结平衡时反应物和生成物的物质的量浓度之间的关系
①化学平衡常数是温度的函数,随温度的变化而变化,使用化学平衡常数应表明所处温度。
在一定温度下,当一个可逆反应达到化学平衡时, 与 的比值是一个常数(简称平衡常数),用符号K表示。
知识点一 · 化学平衡常数
②固体、纯液体、水溶液中水的浓度可视为定值,其浓度不列入平衡常数公式。
③化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。
对于一般的可逆反应 m A(g) + n B(g) p C(g) + q D(g) 在一定温度下达到化学平衡时,各物质的浓度满足的数学关系式为:
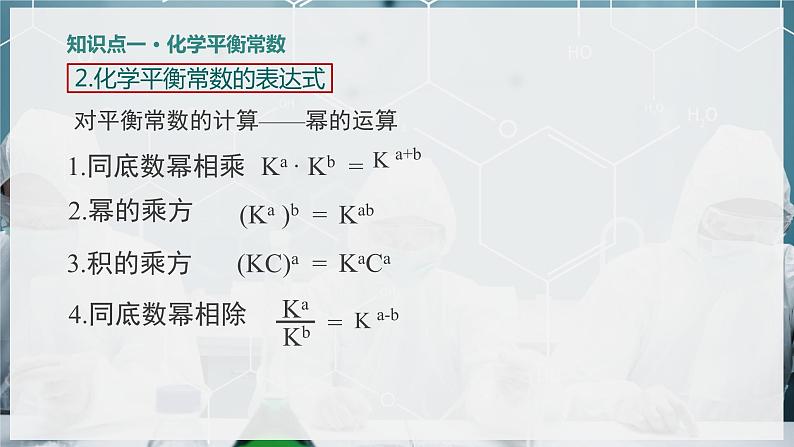
2.化学平衡常数的表达式
①书写时,注意分子为生成物的浓度幂之积,分母为反应物的浓度幂之积。②计算时,c(A)、 c(B)、 c(C)、 c(D)是平衡时各物质的量浓度,不可使用物质的量数据,且不可使用任意时刻的物质的量浓度。
对平衡常数的计算——幂的运算
写出下列可逆反应的平衡常数表达式。
若反应方向改变、化学计量数等倍扩大或缩小,化学平衡常数都会相应改变。
化学平衡常数表达式与化学方程式的书写有关。
题点一 · 化学平衡常数表达式及不同书写形式的相互换算
3.化学平衡常数的影响因素
25 ℃ 时,生成卤化氢反应的平衡常数
请根据以下资料提供的数据,分析影响平衡常数的因素。
1.对于反应3Fe(s)+4H2O(g) ⇌ Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是( )
4.化学平衡常数的意义
25 ℃ 时,生成卤化氢反应的平衡常数
生成卤化氢的平衡常数K值从上到下依次减小,反应进行的程度也依次减小。在上述反应中,生成氟化氢的反应进行得最为完全。
平衡常数的大小定量反映了化学反应进行的程度。
写出下表中各反应的平衡常数表达式
当K<10-5时,该正反应很难发生。
K值越大,表示反应进行得越完全
当K>105时,该正反应进行完全。
K值越小,表示反应进行得越不完全
化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和化学反应速率。也就是说,某个化学反应的平衡常数很大,可能化学反应速率却很小。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,即反应物的转化率最大。
平衡转化率与平衡常数均能表示化学反应进行的程度,但平衡常数不直观,转化率能更直观地表示化学反应进行的程度。
某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,请根据以下数据计算达到化学平衡时H2的转化率。
起始量/ml 变化量/ml 平衡量/ml
5 15 0
2 6 4
3 9 4
N2 + 3H2 2NH3
知识点二 · 化学平衡常数的应用
1.判断、比较可逆反应进行的程度
浓度商:用任意状态的浓度幂之积的比值,用Q 表示
m A(g) + n B(g) p C(g) + q D(g)
Q<K:可逆反应向正反应方向进行。
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
2.判断可逆反应的热效应
1.同一反应,k只与温度有关,与反应物或生成物的浓度无关。
温度不变,化学平衡常数不变;温度改变,化学平衡常数改变
升高温度,k值增大;降低温度,k值减小
升高温度,k值减小;降低温度,k值增大
若升高温度,K 增大,则正反应为吸热反应;若升高温度,K 减小,则正反应为放热反应。
3.利用化学平衡常数的相关计算
利用平衡常数可计算物质的平衡浓度、物质的量分数和转化率等。
【例2】在一密闭容器中, CO与H2O混合加热到800 ℃达到下列平衡: CO(g)+H2O(g) ⇌ CO2(g)+H2(g) K = 1.00 若反应开始时CO和H2O的浓度均为0.200 ml·L-1,求达到平衡时CO转化为CO2的转化率。
CO(g)+H2O(g) ⇌ CO2(g)+H2(g)
题点二 · 化学平衡常数的应用
3. 在常温下,下列反应的平衡常数数值如下:2NO(g)⇌N2(g)+ O2(g) K1=1×10302H2(g)+O2(g) ⇌ 2H2O(g) K2=2×10812CO2(g)⇌2CO(g)+ O2(g) K3=4×10-92以下说法正确的是( )
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt,共29页。PPT课件主要包含了总结归纳,习题研究,作业布置等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度精品ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度精品ppt课件,共19页。PPT课件主要包含了n气减小ΔS<0,总结归纳,ΔGΔH-TΔS,作业布置等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第1节 化学反应的方向作业课件ppt: 这是一份鲁科版 (2019)选择性必修1第1节 化学反应的方向作业课件ppt,共27页。PPT课件主要包含了c平CO2,Mpa等内容,欢迎下载使用。













