






所属成套资源:人教版化学必修一PPT课件
人教版 (2019)必修 第一册第三节 氧化还原反应优质ppt课件
展开
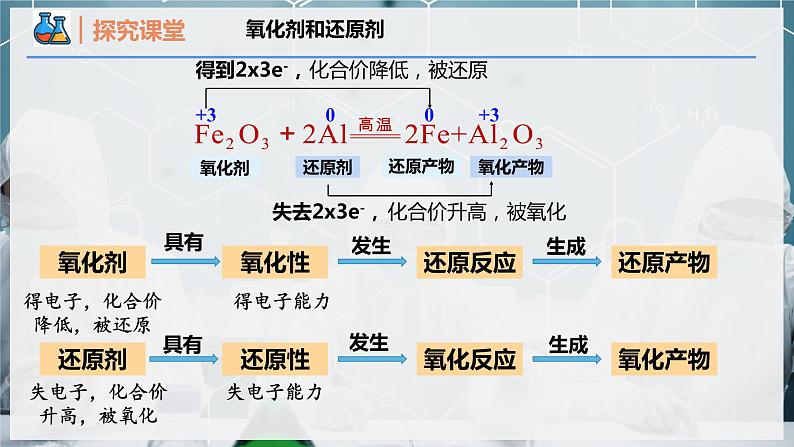
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应优质ppt课件,共27页。PPT课件主要包含了氧化剂和还原剂,单线桥,氧化性和还原性,本节重点,本节难点,置换反应,温故知新,得到2x3e-,失去2x3e-,化合价降低被还原等内容,欢迎下载使用。
Fe2O3+2Al Al2O3+2Fe 所属基本反应类型是________________。在该反应中_________元素的化合价升高,该元素的原子____________电子,被____________;而_________元素的化合价降低,该元素的原子____________电子,被____________。该反应中Fe2O3发生了____________反应,Al发生了____________反应。
+3 0 0 +3
注意:氧化剂、还原剂、氧化产物、还原产物都是指物质而不是元素。
得到电子(或电子对偏向)的物质。
失去电子(或电子对偏离)的物质。
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
【例1】下列说法正确的是( ) A. KFeO4中Fe元素的化合价为+3价 B. C2O42-中C元素的化合价为+3价 C. 氧化剂本身被还原,生成氧化产物 D. 在一个反应中,氧化剂和还原剂不可能是同一物质
【例2】用双线桥法表示下列方程式电子转移的方向和数目,指出下列反应中的氧化剂、还原剂、氧化产物和还原产物。
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
Cl2+2NaOH = NaCl +NaClO+H2O
2H2S+SO2 = 3S↓ + 2H2O
+4 -1 +2 0
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4×e-。
0 -1 +1
-2 +4 0
思考:氧化剂与还原剂一定是不同物质吗?氧化产物与还原产物一定是不同物质吗?
【变式】下列说法正确的是( ) A. Cr2O72- →CrO4-,实现该转化需加氧化剂 B. 3NO2+H2O=2HNO3+NO,NO2只发生氧化反应 C. KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,反应中HCl只体现还原性 D. 2H2O+2Na=2NaOH+H2↑,反应中H2O被还原
思考:在反应中,电子从____________剂转移到____________剂。
0 +3 0 +3
失去电子(或电子对偏离)的物质
得到电子(或电子对偏向)的物质
图1-15 还原剂和氧化剂的关系
意义:表示电子转移的方向及数目
注意:1. 始于反应物中的升价元素,止于反应物中降价元素,要用箭头标明电子转移的方向2. 正确标出反应中转移的电子总数,不需要标明“得到”或“失去”
单线桥和双线桥两种表示方法的形式不同,实质相同——氧化还原反应电子转移关系,可以帮助我们理解氧应还原反应相关概念间的联系。在分析氧化还原反应中电子转移、化合价升降、物质被氧化、被还原等关系时,用“双线桥”方便;在表示电子转移的方向和数目时用“单线桥”方便。
2Na + 2H2O=2NaOH+ H2↑
0 +1 +1 0
+2 0 0 +1
【例3】用单线桥表示下列反应方程式
CuO + H2 === Cu + H2O
2Mg + CO2 2MgO + C
以下列反应为例,分析化合价与物质氧化性、还原性之间的关系:
元素常见化合价:Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1Al:0 ,+3 Cl:-1 ,0, +1, +5,+7 O: -2, -1, 0
Fe2O3 + 3H2 = 2Fe + 3H2O
思考:中间价态具有氧化性还是还原性呢?
氧化剂 + 还原剂 = 还原产物 + 氧化产物
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
升—失—氧化——还原剂
降—得—还原——氧化剂
氧化性:氧化剂>氧化产物还原性:还原剂>还原产物
(1) 根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2) 根据金属的活动性顺序判断
(3)依据相同条件下被氧化(还原)的程度判断
不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如:
氧化性Cl2 S
Cu+2Fe3+= Cu2++2Fe2+
3Zn+2Fe3+ = 3Zn2++2Fe
还原性Zn Cu
不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例如:
(1)氧化剂: 具有氧化性,易得电子
CuO , Fe2O3
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
1) 活泼的非金属单质:
3) 高价的含氧酸及其盐:
(2)还原剂: 具有还原性,失电子
K , Na , Mg , Fe , Al
3)变价元素的低价态物质:
CO ,H2S, Cu2O
中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,例如H2O2、SO2、SO32-等。
2Na + 2HCl = 2NaCl + H2↑Mg + 2HCl = MgCl2 + H2↑2Al + 6HCl = 2AlCl3 + 3H2↑
Na、Mg、Al是______________剂,反应中________电子,1个Na/Mg/Al转移___________个电子?
判断Na、Mg、Al还原性强弱?
决定物质氧化性、还原性强弱的因素是反应过程中电子转移的难易,而非电子转移数的多少。
【例4】下列对氧化还原反应的分析中不合理的是( ) A. Mg变成MgO时化合价升高,失去电子,因此Mg在该反应中作氧化剂 B. KMnO4受热分解制O2时,Mn元素被还原 C. 反应CuSO4+2NaOH===Cu(OH)2↓+Na2SO4不属于氧化还原反应 D. 已知存在反应2Fe3++2I-===2Fe2++I2,氧化性:Fe3+ > I2
【例5】在常温下发生下列反应: ① 16H++10Z-+2XO4-=2X2++5Z2+8H2O ② 2A2++B2=2A3++2B- ③ 2B-+Z2=B2+2Z-根据上述反应,判断下列结论中错误的是( )A. 溶液中可能发生:Z2+2A2+=2A3++2Z-B. Z2在①③反应中为还原剂C. 氧化性强弱顺序为XO4->Z2>B2>A3+D. X2+是XO4-的还原产物
【变式5】已知在相同条件下,下列几种微粒的还原性强弱顺序为Cl-
相关课件
这是一份化学必修 第一册第三节 氧化还原反应优秀课件ppt,共23页。PPT课件主要包含了氧化还原反应的分类,氧化还原反应的配平,本节重难点,一般氧化还原反应,自身氧化还原反应,歧化反应,③NH4NO3,H2O+N2O↑,归中反应,氧化还原反应分类等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应优质ppt课件,共24页。PPT课件主要包含了守恒规律,先后规律,价态规律,本节重点,本节难点,电子守恒规律,Fe2+,Fe3+,常见的强弱顺序,既有氧化性也有还原等内容,欢迎下载使用。
这是一份人教版 (2019)第三节 氧化还原反应精品ppt课件,共27页。PPT课件主要包含了双线桥法表示电子转移,本节重点,本节难点,氧化反应,Fe2O3,还原反应,得氧失氧,思考与讨论,发生了氧化反应,发生了还原反应等内容,欢迎下载使用。










