
专题03 化学反应原理运用综合题-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用)
展开专题03 化学反应原理运用综合题
题型介绍
浙江省选考第19题为化学反应原理综合题,主要考查热化学、电化学、化学反应速率和化学平衡、电解质溶液等主干理论知识,主要命题点有盖斯定律的应用,反应速率和化学平衡的分析,化学平衡常数的表达式书写与计算,反应条件的分析选择、生产生活中的实际应用等,
试题常以填空、读图、作图、计算等形式呈现。试题一般以与生产、生活紧密联系的物质为背景材料命制组合题,各小题之间又有一定的独立性。主要考查学生的信息处理能力、学科内综合分析能力,应用反应原理解决生产实际中的具体问题,体现了“变化观念与平衡思想”的核心素养。在近几年的相关考题中,对单一因素影响的考查已经越来越少了,主要以“多因素影响”出现,考查考生的综合分析判断能力。以实际情景(场景)为背景,更能体现核心素养的要求。而在实际生产过程中,影响因素是多元化、多方位和多层次的。
典例在线
【例1】(2023·浙江省1月选考)“碳达峰•碳中和”是我国社会发展重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
I:CH4(g)+CO2(g)2CO(g)+2H2(g) ∆H1= +247 kJ•mol-1 ,K1
II:CO2(g)+H2(g)CO(g)+H2O(g) ∆H2= +41 kJ•mol-1 , K2
请回答:
(1)有利于提高CO2平衡转化率的条件是___________。
A.低温低压 B.低温高压 C.高温低压 D.高温高压
(2)反应CH4(g)+3CO2(g)4CO(g)+2H2O(g)的∆H=_________kJ•mol-1,K=_________ (用K1、K2表示)。
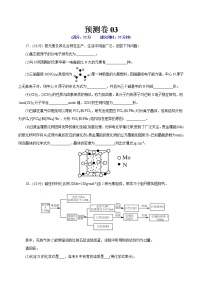
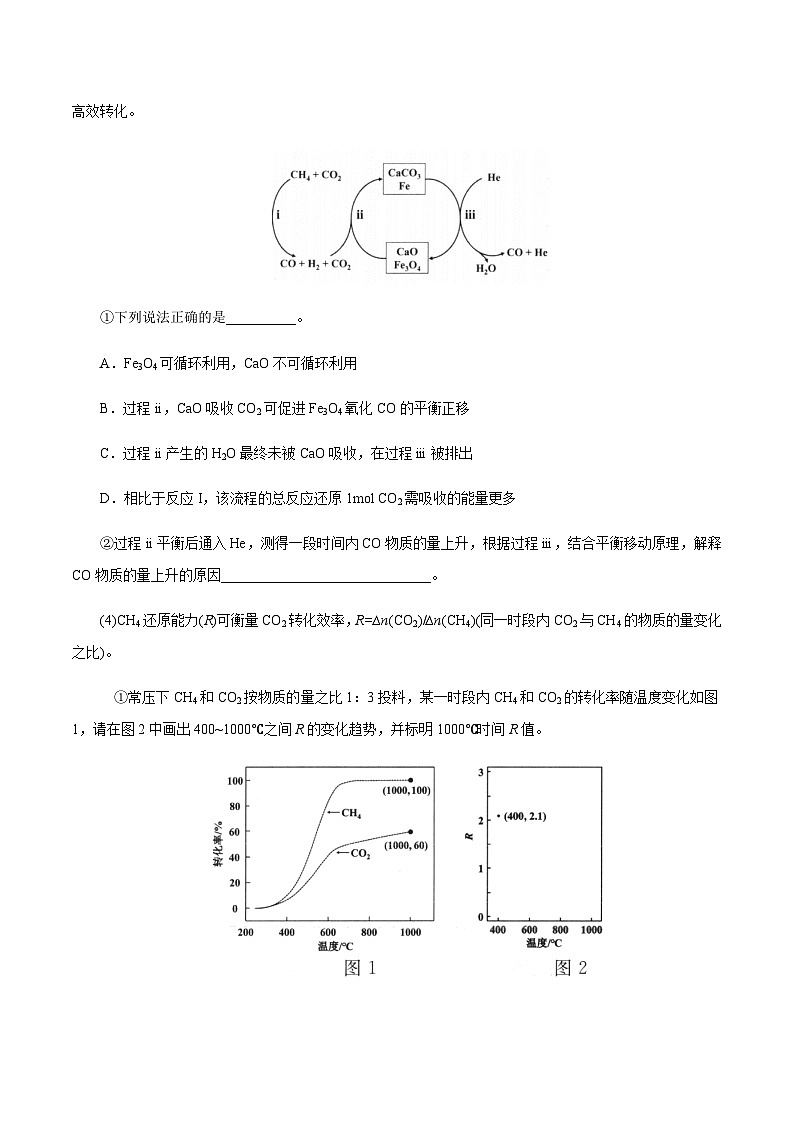
(3)恒压、750℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化。
①下列说法正确的是__________。
A.Fe3O4可循环利用,CaO不可循环利用
B.过程ii,CaO吸收CO2可促进Fe3O4氧化CO的平衡正移
C.过程ii产生的H2O最终未被CaO吸收,在过程iii被排出
D.相比于反应I,该流程的总反应还原1mol CO2需吸收的能量更多
②过程ii平衡后通入He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因______________________________。
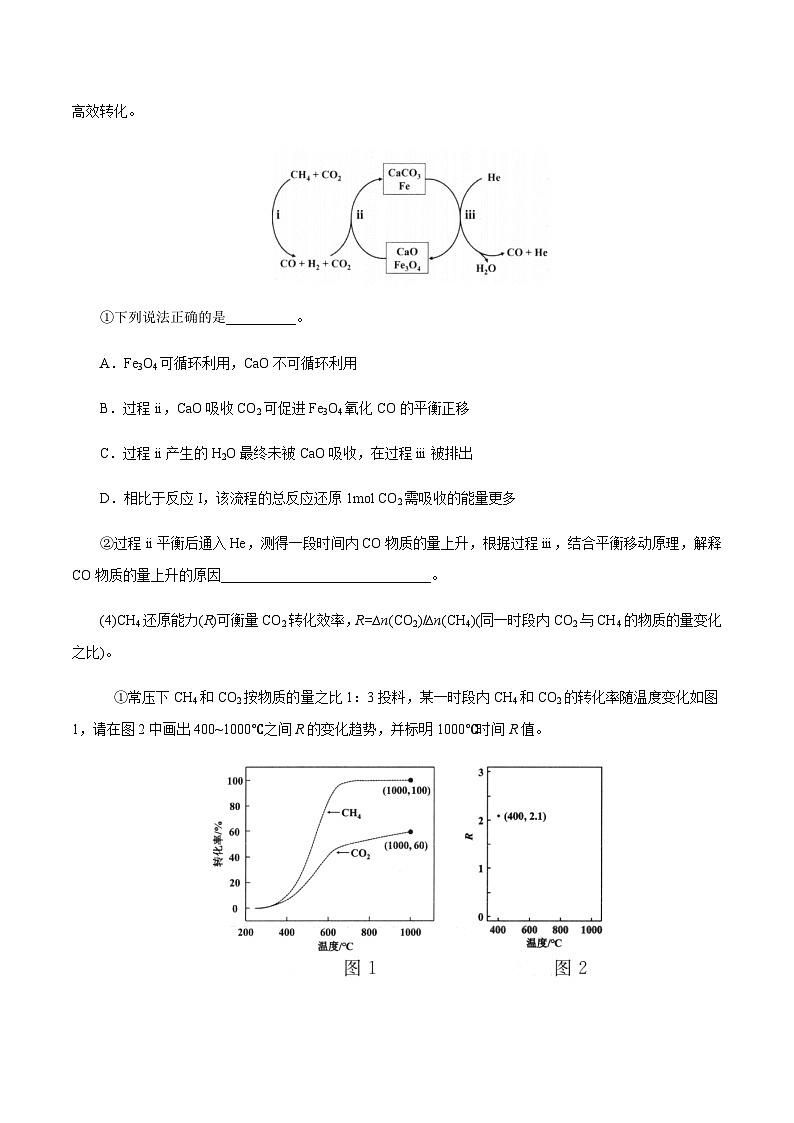
(4)CH4还原能力(R)可衡量CO2转化效率,R=∆n(CO2)/∆n(CH4)(同一时段内CO2与CH4的物质的量变化之比)。
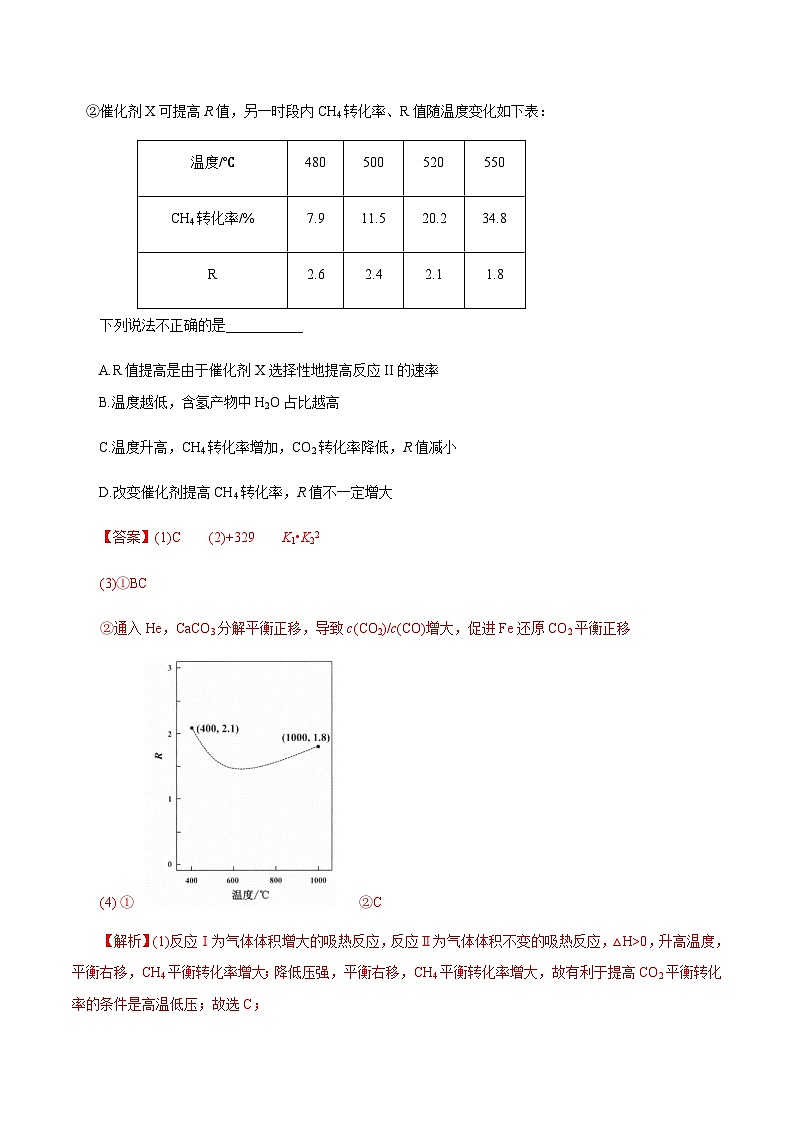
①常压下CH4和CO2按物质的量之比1:3投料,某一时段内CH4和CO2的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时间R值。
②催化剂X可提高R值,另一时段内CH4转化率、R值随温度变化如下表:
温度/℃
480
500
520
550
CH4转化率/%
7.9
11.5
20.2
34.8
R
2.6
2.4
2.1
1.8
下列说法不正确的是___________
A.R值提高是由于催化剂X选择性地提高反应II的速率
B.温度越低,含氢产物中H2O占比越高
C.温度升高,CH4转化率增加,CO2转化率降低,R值减小
D.改变催化剂提高CH4转化率,R值不一定增大
【答案】(1)C (2)+329 K1•K22
(3)①BC
②通入He,CaCO3分解平衡正移,导致c(CO2)/c(CO)增大,促进Fe还原CO2平衡正移
(4) ① ②C
【解析】(1)反应Ⅰ为气体体积增大的吸热反应,反应Ⅱ为气体体积不变的吸热反应,△H>0,升高温度,平衡右移,CH4平衡转化率增大;降低压强,平衡右移,CH4平衡转化率增大,故有利于提高CO2平衡转化率的条件是高温低压;故选C;
(2)已知:I:CH4(g)+CO2(g)2CO(g)+2H2(g) ∆H1= +247 kJ•mol-1 ,K1
II:CO2(g)+H2(g)CO(g)+H2O(g) ∆H2= +41 kJ•mol-1 , K2
根据盖斯定律,由Ⅰ+Ⅱ2得反应H4(g)+3CO2(g)4CO(g)+2H2O(g);故△H=△H1+2△H2=+329 kJ•mol-1,K= K1•K22;(3)①A项,根据流程可知,Fe3O4转化为Fe,Fe又转化为Fe3O4,Fe3O4可循环利用;CaCO3受热分解生成CaO和CO2, CaO又与CO2反应生成CaCO3,CaO也可循环利用,A错误;B项,过程ⅱ,CaO吸收CO2使CO2浓度降低,促进Fe3O4氧化CO的平衡正移,B正确;C项,过程ⅱCaO吸收CO2而产生的H2O最终未被CaO吸收,在过程ⅲ被排出,C正确;D项,焓变只与起始物质的量有关,与过程无关,故相比于反应Ⅰ,该流程的总反应还原1 mol CO2需吸收的能量一样多,D错误;故选BC;②通入He,CaCO3分解平衡正移,导致增大,促进Fe还原CO2平衡正移,故过程ⅱ平衡后通入He,测得一段时间内CO物质的量上升;(4)①根据图1可知1000℃时,CH4转化率为100%,即∆n(CH4)=1mol, CO2转化率为60%,即∆n(CO2) =3mol60%=1.8mol,故R=∆n(CO2)/∆n(CH4)==1.8,故400~1000℃间R的变化趋势如图:;②A项,R值提高是由于催化剂X选择性地提高反应Ⅱ的速率,使单位时间内反应Ⅱ中CO2的转化率增大,∆n(CO2)增大的倍数比∆n(CH4)大,则R提高,A正确;B项,根据表中数据可知,温度越低,CH4转化率越小,而R越大,∆n(CO2)增大的倍数比∆n(CH4)大,含氢产物中H2O占比越高,B正确;C项,温度升高,CH4转化率增加,CO2转化率也增大,且两个反应中的CO2转化率均增大,增大倍数多,故R值增大,C不正确;D项,改变催化剂使反应有选择性按反应Ⅰ而提高CH4转化率,若CO2转化率减小,则R值不一定增大,D正确;故选C。
【例2】(2022·浙江省6月选考)主要成分为H2S的工业废气的回收利用有重要意义。
(1)回收单质硫。将三分之一的H2S燃烧,产生的SO2与其余H2S混合后反应:。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol·L-1、c(SO2)= 5.0×10-5mol·L-1、c(H2O)=4.0×10-3mol·L-1,计算该温度下的平衡常数_______。
(2)热解H2S制H2。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ 2H2S(g)2H2(g)+ S2(g) ΔH1=170kJ·mol−1
Ⅱ CH4(g)+ S2(g)CS2(g)+2H2(g) ΔH2=64kJ·mol−1
总反应:
Ⅲ 2H2S(g)+CH4(g)CS2(g)+4H2(g)
投料按体积之比V(H2S):V(CH4)=2:1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
温度/℃
950
1000
1050
1100
1150
H2/V(%)
0.5
1.5
3.6
5.5
8.5
CS2/V(%)
0.0
0.0
0.1
0.4
1.8
请回答:
①反应Ⅲ能自发进行的条件是_______。
②下列说法正确的是_______。
A.其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,H2S的转化率越高
C.由实验数据推出H2S中的S-H键强于CH4中的键
D.恒温恒压下,增加N2的体积分数,H2的浓度升高
③若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图_______。
④在1000℃,常压下,保持通入的H2S体积分数不变,提高投料比[V(H2S):V(CH4)],H2S的转化率不变,原因是_______。
⑤在950℃~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高发生变化,写出该变化规律并分析原因_______。
【答案】(1)8×108 L·mol-1
(2) 高温 AB 1000℃时CH4不参与反应,相同分压的H2S经历相同的时间转化率相同 先升后降;在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高;反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小
【解析】(1)根据方程式可知该温度下平衡常数K==;(2)①根据盖斯定律可知Ⅰ+Ⅱ即得到反应Ⅲ的ΔH=234kJ/mol,这说明反应Ⅲ是吸热的体积增大(即ΔS>0)的反应,根据ΔG=ΔH-TΔS<0可自发进行可知反应Ⅲ自发进行的条件是高温下自发进行;②A项,Ar是稀有气体,与体系中物质不反应,所以其他条件不变时,用Ar替代N2作稀释气体,对实验结果几乎无影响,A正确;B项,正反应吸热,升高温度平衡正向进行,温度越高,H2S的转化率越高,B正确;C项,根据表中数据无法得出H2S中S-H键和CH4中C-H键的相对强弱,事实上C-H键的键能大于S-H键键能,C错误;D项,恒温恒压下,增加N2的体积分数,相当于减压,平衡正向进行,H2的物质的量增加,容器容积增加,H2浓度减小,D错误;故选AB;③反应I、反应Ⅱ和反应Ⅲ均是吸热反应,则反应过程能量示意图可表示为;④根据表中数据可知1000℃时CH4不参与反应,相同分压的H2S经历相同的时间转化率相同,所以在1000℃常压下,保持通入的H2S体积分数不变,提高投料比时H2S的转化率不变;⑤由于在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高;反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小,因此变化规律是先升后降。
1.化学反应原理题答题“五要素”
2.速率与化学平衡的计算模式
化学平衡计算的最基本的方法模式是“平衡三段式法”。具体步骤是在化学方程式下写出有关物质起始时的物质的量、发生转化的物质的量、平衡时的物质的量(也可以是物质的量浓度或同温同压下气体的体积),再根据题意列式求解。
mA(g)+nB(g) pC(g)+qD(g)
n(起始)/mol a b 0 0
n(转化)/mol mx nx px qx
n(平衡)/mol a-mx b-nx px qx
起始、转化、平衡是化学平衡计算的“三步曲”。
【变式1】氨气是一种重要的化工原料。请回答:
(1)已知:
化学键
H-H
N-H
键能/( kJ·mol-1)
945
436
390.8
写出由氢气和氮气合成氨气的热化学方程式___________。
(2)下列关于工业合成氨的说法不正确的是___________。
A.反应温度控制在400~500℃左右,主是为了提高NH3的产率
B.为了防止混有杂质的原料气使催化剂“中毒”,必须对原料气净化处理
C.采用高压的目的只是为了提高反应的速率
D.工业上为了提高H2的转化率,可适当增大H2的浓度
E.生产过程中将NH3液化分离,并及时补充N2和H2,有利于氨的合成
(3)在其他条件相同时,某同学研究该氨气合成反应在不同催化剂I或II作用下,反应相同时间时,N2的转化率随反应温度的变化情况。请在图中补充后的变化情况____________。
(4)在25℃下,将NH3溶于水制成氨水,取a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-)。用含a的代数式表示NH3·H2O的电离平衡常数Kb =________。
(5)工业上用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO (g)+NO2(g)+2NH3(g)2N2 (g)+3 H2O (g)。
以下说法正确的是___________。
A.相同条件下,改变压强对脱氮率没有影响
B.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.由曲线②温度升高到一定程度后脱氮率下降可推知该反应为放热反应
【变式2】利用工业废气CO2制甲醇Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1,可以一定程度摆脱当下对化石燃料的依赖。用CO2为碳源制备甲醇,为早日实现“碳达峰、碳中和”提供了一种较好的研究方向。
(1)上述反应的△H1___0(填“>”或“<”),理由是__________________________。
(2)在VL密闭容器中,充入不同氢碳比的原料气体,控制温度600K,发生上述反应,请在图中画出CH3OH在混合气体中的平衡体积分数随氢碳比递增的变化趋势___。
(3)将1.0molCO2和3.0molH2充入2L恒容密闭容器中,使其按反应Ⅰ进行,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示。下列说法正确的是___。
A.T3对应的平衡常数小于T4对应的平衡常数
B.根据图中曲线分析,催化剂Ⅰ的催化效果好
C.b点v正可能等于v逆
D.a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
(4)某工业废气中含CO2 6.76%,含CO 4.5×10-50%,请结合以下化学方程式:
Ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1
Ⅱ.CO(g)+2H2(g)CH3OH(g) △H2(2△H1=△H2)
分析为何工业废气制甲醇选取CO2而不选CO作碳源:_________________________。
(5)现向恒温恒压(0.1MPa)的密闭容器中充入1mol CO2,3mol H2和6mol He,上述反应达平衡时,测得CO2的转化率为0.2,则该反应的Kp=_____________MPa-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果保留小数点后1位)
(6)CO2制备CH3OH的过程中,往往伴随着另一反应发生:CO2(g)+H2(g) CO(g)+H2O(g) △H3=40.9kJ•mol-1,从而导致CH3OH的选择性下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择性,试说明其可能的原因:________________。
刷模拟
1.(2023·浙南名校七彩联盟高三选考模拟)合成氨在国民经济中占有十分重要的地位。
(1)制备原料气阶段:以煤、焦炭、水蒸气、空气为原料在如图反应器中合成氢气。
氧化层中进行的反应:
Ⅰ、C(s)+O2(g)= CO2(g) ΔH=-393.8 kJ·mol-1
Ⅱ、2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1
还原层中进行的反应:
Ⅲ、C(s)+2H2O(g)= CO2(g)+2H2(g) ΔH=+90.8 kJ·mol-1
Ⅳ、C(s)+H2O(g)= CO(g)+H2(g) ΔH=+131.4 kJ·mol-1
①在还原层中在产物中的体积分数为,写出反应的热化学方程式:___________。
②下列说法正确的是___________
A.氧化层能维持炉中的反应温度
B.升温可提高还原区CO2的平衡选择性,减少CO的排放
C.氧化区中的反应、。
D.若通入的,后续必须要补充才可作为制氨的原料气
(2)氨的合成阶段:气固相合成催化
①氨合成阶段N2 (g)+ 3H2(g) 2NH3(g)在低温时主要由速率控制NH3的产率,已知在接近平衡时:(—氨合成反应的净速率;,—正、逆反应速率常数;,,—N2,H2,NH3的分压;为常数,与催化剂有关,经实验测定以铁为主的氨合成催化剂,试用,表示氨合成反应的平衡常数KP=___________)。
②已知,320℃恒温1L的容器中通入一定量的H2和N2,NH3的产率随时间变化关系如图所示。起始温度为320℃绝热1L的容器中通入与恒温时相同量的H2和N2在t1时刻达到平衡后,调整装置保持320℃,在t2时刻重新达到平衡。画出投料后到t2时刻容器内的NH3的产率随时间变化关系曲线___________。
(3)氨水催化吸收H2S是小型合成氨厂广泛采用的脱硫方法。原料气中H2S在脱硫塔中被氨吸收得到NH4HS。补充完成在吸收液中添加对苯二酚(作为载氧体和催化剂),回收单质硫的化学方程式。
Ⅰ:Ⅱ:___________
2.(2023·浙江省强基联盟高三12月联考)以“水煤气”为原料合成氨,需在变换塔中将CO变换成H2,变换塔中主要发生的反应为:
主反应: H2O (g)+ CO2(g)CO2 (g)+ H2(g) ΔH1<0
副反应: 2H2 (g)+ CO2(g)CH3OH(g) ΔH2<0
(1)关于合成氨工艺的下列理解,正确的有_______。
A.在合成氨时,控制温度远高于室温,是为了保证尽可能高平衡转化率和反应速率
B.在一定压强下,随着温度的升高,变换塔中CO与CO2的物质的量之比增大
C.为提高原料中H2转化率,应向反应器中加入适当过量的空气
D.体系温度升高,可能导致催化剂失活,用热交换器将原料气可预热并使反应体系冷却
(2)相对压力平衡常数的表达式就是在浓度平衡常数表达式中,用相对分压代替浓度。气体B的相对分压等于其分压p(B)(单位为kPa)除以标准压强,其分压p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数。
变换塔中恒容条件下充入1.0molCO、1.4molH2O、1.0molH2、0.5molN2,T℃下,反应达到平衡后,测得CO20.7mol和CH3OH0.1mol。则T℃时,主反应的相对压力平衡常数_______。
(3)变换塔中主反应正逆反应速率可以表示为:,,和都是温度的函数。在图中画出、随温变化的趋势。_______
(4)以煤为原料生产水煤气,反应过程如下:
反应过程
化学方程式
焓变ΔH/ (kJ·mol-1)
送风(空气)发热
C(s)+O2(g)CO2(g)
通水(蒸气)制气
C(s)+H2O(g) H2 (g)+ CO(g)
131
副反应
C(s)+CO2(g)2CO(g)
172
为维持炉温,送风发热和制气交替进行,但实际送风发热产生的热量远远多于制气所需热量,其原因是_______。
(5)研究发现在以Fe3+为主的催化剂上NH3也可还原NO(需O2参与反应),可能发生的反应过程如下,用化学方程式补充该催化反应历程(反应机理):(a) Fe3++NH3= Fe2+-NH2 +H+,(b)_______,(c) 4Fe2+ +4H++O2=4Fe3++2H2O。
3.(2023·浙江省(杭州二中、温州中学、金华一中、绍兴一中)四校高三联考)我国已正式公布实现“碳达峰”、“碳中和”的时间和目标,使含碳化合物的综合利用更受关注和重视。CO2甲烷化目前被认为是实现碳循环利用最实用有效的技术之一,也是目前控制二氧化碳排放的研究热点之一。回答下列问题:
(1)二氧化碳与氢气重整体系中涉及的主要反应如下:
I. 4H2 (g)+ CO2(g)CH4 (g)+ 2H2O(g) ΔH1=-165 kJ·mol-1
Ⅱ. H2 (g)+ CO2(g)CO(g)+ 2H2O(g) ΔH2=+41 kJ·mol-1
Ⅲ. CH4 (g)+ CO2(g)2CO (g)+ 2H2(g) ΔH
反应Ⅲ自发进行的条件是_______;恒温恒容密闭容器中,等物质的量的CO2与CH4发生反应Ⅲ,下列事实能说明该反应达到化学平衡状态的是_______。
A.CO2与CH4的有效碰撞次数不变 B.相同时间内形成C-H键和H-H键的数目相等
C.混合气体的平均相对分子质量不变 D.CO2和CO物质的量之和保持不变
(2)一定温度下,向恒容密闭容器中以体积比为1:3充入CO2和H2,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图1所示。
①其中表示CO2的体积分数与温度关系的曲线为_______(填“L1”、“L2”或“L3”);T1℃之后,H2O(g)平衡体积分数随温度的变化程度小于CH4平衡体积分数随温度的变化程度的原因是_______;
②T1℃时,CO的平衡分压_______(填“>”、“<”或“=”)T2℃时CO的平衡分压。测得T1℃时CO2的平衡转化率为50%,H2O(g)的分压为p0,则反应Ⅱ的平衡常数KP=_______(KP是用分压表示的平衡常数)。
(3)瑞典化学阿伦尼乌斯(Arrhenius)创立的化学反应速率常数随温度变化关系的经验公式为:(为活化能-假设受温度影响忽略不计,k为速率常数,R和C为常数),为探究催化剂m、n的催化效率,进行了相应的实验,依据实验数据获得图2曲线。在催化剂m作用下,该反应的活化能_______J・mol-1。假设催化剂n的催化效率大于m的催化效率,请在图2中画出催化剂n的相应曲线图和标注。_____
4.(2023·浙江省丽水、湖州、衢州三地市高三教学质量检测)我国力争于2030年前做到CO2的排放不再增长。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
Ⅰ.CH4(g)+CO2(g)2CO(g)+2H2(g)
Ⅱ.CH4(g)C(s)+2H2(g)
Ⅲ.CO(g)+H2(gH2O(g)+C(s)
(1)设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。如气体B的相对分压等于其分压pB(pB=xB×p总,xB为平衡系统中B的物质的量分数)除以p0(p0=100kPa)。反应Ⅰ、Ⅱ、Ⅲ的lnKpr随的变化如图1所示。
图1
①反应Ⅰ、Ⅱ、Ⅲ中,属放热反应的是____________。
②图中A点对应温度下,原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为30kPa。CH4的平衡转化率为____________。
(2)二氧化碳加氢制甲醇是研究的另一热点,其总反应可表示为:Ⅳ.CO2(g)+3H2(g)CH3OH(g)+H2O(g),
该反应一般认为通过如下步骤来实现:
Ⅴ.CO2(g)+H2(g)CO(g)+H2O(g) ∆H1=+41kJ·mol−1
Ⅵ.CO(g)+2H2(g)CH3OH(g) ∆H2=−90kJ·mol−1
①反应Ⅴ的∆S______。
A大于0 B.小于0 C.等于0 D.无法判断
②若反应Ⅴ为慢反应,请在图2中画出上述反应能量变化的示意图______。
③不同压强下按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率随温度的变化关系如图3所示。T1温度时,三条曲线几乎交于一点的原因是__________________。
5.(2023·浙江省高三选考科目适应性考试)卤素的单质和化合物在生产和生活中应用广泛。
(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
①图中四种MgX2的热稳定由小到大的顺序是:_______。
②MgBr2(s)+Cl2(g)MgCl2(s)+Br2(g) △H=_______ kJ∙mol-1。
某温度下,在密闭恒容容器中放入一定量MgBr2(s)和Cl2(g)进行该反应,一定时间后不能说明该反应已经达到平衡的是_______。(选填序号)。
A.容器内的压强不再改变 B.混合气体的密度不再改变
C.混合气体的颜色不再改变 D.混合气体的平均相对分子质量不再改变
E.容器内的固体的质量不再改变
③工业上用金属Mg与I2反应制取MgI2时,常加入少量水,水的作用是_______。
④AgBr常用作感光剂和镇静剂,工业制得的AgBr固体常含有AgCl固体。现有含AgCl质量分数为14.35%的AgBr固体100.00g,可用饱和KBr溶液一次性浸泡,恰好溶解除去AgCl固体,需要5.015 mol∙L-1的饱和KBr溶液的体积至少为_______mL。(保留4位有效数字)(已知常温下Ksp(ABr)=5.418×10-13,Ksp(AgCl)=1.806×10-10)
(2)将一定量的PCl5(g)在T℃、Po压强下发生反应:PCl5(g)PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=_______。(用含a的式子表示。其中、、为各组分的平衡分压,如,p为平衡总压,为平衡系统中PCl5的物质的量分数)
(3)向11mL0.40mol∙L-1H2O2溶液中加入适量FeCl3溶液,16分钟时测得生成O2的体积(已折算为标准状况)为44.8mL。资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。反应过程中能量变化如图1所示,在图2中画出在0~16分钟内产生O2的物质的量随时间的变化示意图_______。
6.(2023·浙江省杭州高级中学选考模拟)当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)在C和O2的反应体系中:
反应1:C(s)+O2(g)CO2(g) ΔH1=-394kJ·mol−1
反应2:2CO(g)+O2(g)2CO2(g) ΔH2=-566kJ·mol−1
反应3:2C(s)+O2(g)2CO(g) ΔH3。
设,反应1、2和3的y随温度的变化关系如图所示。图中对应于反应3的线条是____。
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)CO2(aq)
②CO2(aq)+H2O(l) =H+(aq)+HCO3-(aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为,当大气压强为,大气中CO2(g)的物质的量分数为时,溶液中浓度为_______(写出表达式,考虑水的电离,忽略HCO3-的电离)
(3)在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
I. CO2(g)+H2(g)CO(g)+H2O(g) △H1=+41.1kJ•mol-1
II. CO(g)+2H2(g)CH3OH(g) △H2=-90kJ•mol-1
III. CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3=-48.9kJ•mol-1
时,往某密闭容器中按投料比n(H2)/ n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
①图中Y代表_______(填化学式)。
②体系中CO2的物质的量分数受温度的影响不大,原因是_______。
③在下图中画出n(H2)/ n(CO2)随温度变化趋势图_______。
7.(2023·浙江省9 +1高中联盟高三联考)氮及其化合物在工农业生产中有着重要的应用。
(1)在一定温度下,氨气溶于水的过程及其平衡常数为:
NH3(g)NH3(aq)
NH3(aq)+ H2O(1)NH4+(aq)+OH-(aq) K2
其中P为NH3(g)的平衡压强,c(NH3)为NH3在水溶液中的平衡浓度。设氮气在水中的溶解度S= c(NH3)+c(NH4+),则用P、K1和K2表示S的代数式为_______。
(2)氨在催化氧化反应时发生如下反应:
② I. 4NH3 (g)+ 5O2(g)4NO (g)+6H2O(g) ΔH1=-992 kJ·mol-1
③ II. 4NH3 (g)+ 4O2(g)2N2O (g)+6H2O(g) ΔH2=-1118 kJ·mol-1
④ III.4NH3 (g)+ 3O2(g)2N2 (g)+6H2O(g) ΔH3=-1282 kJ·mol-1
⑤ 反应I在常压下自发进行的条件是_______。
②将一定比例的NH3和O2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择率与温度的关系如图所示。
下列说法正确的是_______。
A.其他条件不变,升高温度,NH3的平衡转化率增大
B.其他条件不变,在175~300℃范围,随温度的升高,出口处N2的物质的量先增大后减小
C.催化氧化除去尾气中的NH3应选择反应温度高于250℃
D.随温度的升高,N2选择性下降的原因可能为催化剂对生成N2的反应活性下降,副反应的速率变大
(3)NO的氧化反应:2NO(g)+ O2(g)2NO2(g),分两步进行。
I. 2NO(g)N2O2(g) ΔH1
II. N2O2(g)+ O2(g)2NO2(g) ΔH2
已知:i.决定氧化反应速率的是步骤“II”
ii. ΔH2<ΔH1<0,反应I的活化能为Ea1,反应II的活化能为Ea2
①请在图中画出氧化反应的过程能量示意图(必要的地方请标注)_______。
②某工业制硝酸流程中,进入反应塔的混合气体中和O2发生化学反应:2NO(g)+ O2(g)2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×10-5Pa)
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
NO氧化生成NO2反应的反应速率随温度的升高而_______(填升高、降低或不变),试分析其原因_______。
8.(2023·浙江省绍兴市高三选考科目诊断性联考)丙烷脱氢氧化是丙烷脱氢制丙烯技术的进一步发展,反应过程中伴有生成甲烷、乙烷等物质副反应,涉及反应如下:
主反应
Ⅰ:C3H8(g)C3H6 (g)+ H2(g) ΔH1=+124.3 kJ·mol-1
副反应
Ⅱ:C3H8(g)CH4 (g)+ C2H4(g) ΔH2 ΔS2=+135.4 J·K-1·mol-1
Ⅲ:C2H4(g) + H2(g)C2H6(g) ΔH3=-136.9 kJ·mol-1
Ⅳ:C3H8(g) + H2(g)CH4 (g)+C2H6(g) ΔH4=-55.6 kJ·mol-1
(1)判断反应Ⅱ自发进行可用ΔG=ΔH-TΔS来表述,若ΔG<0,反应能自发进行。反应Ⅱ在1000K时能自发进行的理由_______。(要列出计算过程)
(2)若仅考虑主反应Ⅰ,一定温度下,向恒压密闭容器中通入一定量丙烷,反应后测得的组分的平衡压强(即组分的物质的量分数×总压)为:p(C3H8)=0.25MPa、p(H2)=0.75MPa
①该温度下反应的平衡常数KP的数值为_______。(单位用MPa,保留3位有效数字)
②平衡时丙烷的转化率为_______。
(3)对于反应Ⅰ,某课题组研究设计一套丙烷连续催化脱氢装置如图。
①将1mol丙烷(温度为590℃)以恒定的流速依次逐个通过三个相同的装置,画出丙烯的产率随着时间的变化阶段二和阶段三的图像。(每个阶段反应均未达到平衡)_______
②为提高丙烯的产率,向a、b管中同时通入适量的O2,需要适量O2的理由是_______。
(4)下列说法正确的是_______。
A.对于主反应Ⅰ,其他条件不变,充入H2,该反应的平衡常数减小
B.若只考虑反应Ⅳ,恒温恒容下充入原料气体,若压强不变则该反应达到了平衡
C.副反应Ⅲ对应的是右图中反应(3)
D.主反应断裂C-H键,副反应Ⅱ、Ⅳ断裂C-C键,由图可知高温条件下断裂C-C键更容易,因此要选择合适的催化剂在合适的温度下低压合成比较有利主反应
9.(2023·山东省济宁市统考一模)2022年12月中央经济工作会议强调,“加快新能源、绿色低碳等前沿技术研发和应用推广”。CO2甲烷化是目前研究的热点方向之一,在环境保护方面显示出较大潜力。其主要反应如下:
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0
回答下列问题:
(1)在体积相等的多个恒容密闭容器中。分别充入1 mol CO2和4 mol H2发生上述反应Ⅰ(忽略反应Ⅱ),在不同温度下反应相同时间,测得、H2转化率与温度关系如图所示。已知该反应的速率方程为,,其中、为速率常数,只受温度影响。
图中信息可知,代表曲线的是_______(填“MH”或“NG”),反应Ⅰ活化能Ea(正)_______Ea(逆)(填“>”或“<”);c点的K(平衡常数)与Q(浓度商)的等式关系_______(用含、的代数式表示),温度下反应达到平衡,体系压强为p,则_______。
(2)向恒压密闭装置中充入5 mol CO2和20 mol H2,不同温度下同时发生反应Ⅰ和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量与温度T的关系如下图所示
图中缺少_______(填含碳物质的分子式)物质的量与温度的关系变化曲线,随温度升高该物质的变化趋势为_______,800℃时,CH4的产率为_______。
10.(2023·广东省名校联盟高三大联考)二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
已知:常温常压下,一些物质的燃烧热如表所示。
物质
CH4(g)
H2(g)
CO(g)
燃烧热(△H)/(kJ•mol-1)
-890.3
-285.8
-283.0
回答下列问题:
(1)在催化剂作用下,甲烷的催化重整是制备合成气的重要方法,写出CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式:______。
(2)在恒温恒容密闭容器中,通入一定量的CH4、CO2发生催化重整反应。
①下列能说明该反应达到化学平衡状态的是______(填标号)。
A.混合气体的平均相对分子质量不再变化 B.v正(CH4)=2v逆(CO)
C.CO与H2浓度的比值不再变化 D.容器内混合气体的密度不再变化
②当投料比=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。由图可知:压强p1______2MPa(填“>”、“<”或“=”);当温度为T3、初始压强为2MPa时,a点的v逆______v正(填“>”、“<”或“=”)。起始时向1 L恒容容器中加入2 mol CH4和2 mol CO2,在温度为T6、初始压强为2 MPa条件下反应,用压强表示该反应的平衡常数Kp=______(分压=总压×物质的量分数)。
(3)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→+(2-)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如+2H2O→CO2+(2+)H2。反应过程和能量变化残图如图:
判断过程______(填序号)加入了催化剂,原因是______。控制整个过程②反应速率的是第Ⅱ步,其原因为______。
11.(2023·广东省佛山市统考一模)碳中和是我国的重要战略目标,以H2和CO2为原料合成CH4受到广泛关注。
该过程主要涉及以下反应:
反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1<0
反应II:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0
回答下列问题:
(1)已知:ΔG=ΔH-TΔS,反应I的ΔS_______0(填“>”、“<”或“=”),反应I和II的吉布斯自由能(ΔG)与热力学温度(T)之间的关系如图所示,△H1=_______。
(2)向密闭容器中充入3 molH2、1 molCO2反应合成CH4,平衡时各组分的体积分数随温度变化如图所示。
①在工业上,常选用350℃作为合成温度,原因是_______。
②450℃时CO2对甲烷的选择性=_______(保留2位有效数字,已知:选择性=生成CH4的物质的量/参与反应的CO2的物质的量),该温度下反应II的KP=_______。(保留2位有效数字,已知:分压=组分物质的量分数×总压)
(3)光催化剂在光能作用下,电子发生跃迁,形成类似于电解池的阴阳极,将CO2转变为CH4。酸性环境下该过程的电极反应式为_______。
刷真题
1.(2022·浙江省1月选考)工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:
(1)在C和O2的反应体系中:
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是___________。
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比______。
A.不变 B.增大 C.减小 D.无法判断
(2)水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是__________________。
(3)一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为________。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为________。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是________。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:__________________;步骤Ⅱ:_______________________。
2.(2021·浙江6月选考)含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)== CuSO4(s)+SO2(g)+2H2O(l) ΔH=-11.9kJ·mol−1。判断该反应的自发性并说明理由_______。
(2)已知2SO2(g)+O2(g)2SO3(g) ΔH=-198kJ·mol−1。850K时,在一恒容密闭反应器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。
①该温度下反应的平衡常数为_______。
②平衡时SO2的转化率为_______。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法正确的是_______。
A.须采用高温高压的反应条件使SO2氧化为SO3
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和SO2的转化率
D.在吸收塔中宜采用水或稀硫酸吸收SO3以提高吸收速率
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是_______。
A.a1→b1 B.b1→a2 C.a2→b2 D.B2→a3 E. a3→b3 F. B3→a4 G. a4→b4
③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应2SO2(g)+O2(g)2SO3(g)的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图(标明曲线Ⅰ、Ⅱ)_______。
(4)一定条件下,在Na2S-H2SO4-H2O2溶液体系中,检测得到pH-时间振荡曲线如图4,同时观察到体系由澄清→浑浊→澄清的周期性变化。可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
Ⅰ.S2-+H+=HS-
Ⅱ.①_______;
Ⅲ.HS-+H2O2+H+=S↓+2H2O;
Ⅳ.②_______。
3.(2021·浙江1月选考)“氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:
(1)电解饱和食盐水制取氯气的化学方程式是______。
(2)下列说法不正确的是______。
A.可采用碱石灰干燥氯气
B.可通过排饱和食盐水法收集氯气
C.常温下,可通过加压使氯气液化而储存于钢瓶中
D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)Cl2(aq) K1=c(Cl2)/p
Cl 2(aq) + H2O(l)H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)Cl2(aq)的焓变ΔH1______0。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=______。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=______。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为;
I.TiO2(s)+2Cl2(g)TiCl4(g)+O2(g) ΔHI=181 mol·L-1,KI=-3.4×10-29
II.2C(s)+O2(g)2CO(g) ΔHII= - 221 mol·L-1,KII=1.2×1048
结合数据说明氯化过程中加碳的理由______ 。
(5)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。
A.适当提高反应温度 B.改变催化剂
C.适当降低反应温度 D.改变反应物浓度
4.(2020·浙江7月选考)研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。
相关的主要化学反应有:
Ⅰ C2H6(g)C2H4(g)+H2(g) ΔH1=136 kJ·mol−1
Ⅱ C2H6(g)+CO2(g)C2H4(g)+H2O(g)+CO(g) ΔH2=177 kJ·mol−1
Ⅲ C2H6(g)+2CO2(g)4CO(g)+3H2(g) ΔH3
Ⅳ CO2(g)+H2(g)CO(g)+H2O(g) ΔH4=41 kJ·mol−1
已知:298K时,相关物质的相对能量(如图1)。
可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:
H2O(g)H2O(l) ΔH4=(−286 kJ·mol−1)-(−242 kJ·mol−1)=−44 kJ·mol−1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3=________kJ·mol−1。
②下列描述正确的是________。
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正问移动
C.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:[C2H6(g)+CO2(g)]→[C2H4(g)+H2(g)+CO2(g)]→[C2H4(g)+CO(g)+H2O(g)],且第二步速率较慢(反应活化能为210 kJ·mol−1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量−反应过程图”,起点从[C2H6(g)+CO2(g)]的能量−477 kJ·mol−1开始(如图2)。
(2) ①CO2和C2H6按物质的量1∶1投料,在923 K:和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
催化剂
转化率C2H6/%
转化率CO2/%
转化率C2H4/%
催化剂X
19.0
37.6
3.3
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是________,判断依据是________。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773 K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明乙烷转化率增大的原因是________。
5.(2020·浙江1月选考)研究NOx之间的转化具有重要意义。
(1)已知:N2O4(g) 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____。
专题01 有机合成与推断综合题-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份专题01 有机合成与推断综合题-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含专题05有机合成与推断综合题原卷版docx、专题05有机合成与推断综合题解析版docx等2份试卷配套教学资源,其中试卷共131页, 欢迎下载使用。
预测卷03-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷03-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含预测卷03原卷版docx、预测卷03解析版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
专题03 化学反应原理运用综合题-冲刺高考化学大题突破+限时集训(浙江专用): 这是一份专题03 化学反应原理运用综合题-冲刺高考化学大题突破+限时集训(浙江专用),文件包含专题03化学反应原理运用综合题解析版docx、专题03化学反应原理运用综合题原卷版docx等2份试卷配套教学资源,其中试卷共84页, 欢迎下载使用。