资料中包含下列文件,点击文件名可预览资料内容





还剩11页未读,
继续阅读
成套系列资料,整套一键下载
- 5.2.2 重要的金属化合物(第2课时)-2023-2024学年度高一化学同步精品讲义(沪科版必修第二册) 其他 3 次下载
- 5.2.3 重要的金属化合物(第3课时)-2023-2024学年度高一化学同步精品讲义(沪科版必修第二册) 其他 3 次下载
- 5.3.2 化学变化中的能量变化(第2课时)-2023-2024学年度高一化学同步精品讲义(沪科版必修第二册) 其他 2 次下载
- 如何测定菠菜中铁元素的含量-2023-2024学年度高一化学同步精品讲义(沪科版必修第二册) 其他 2 次下载
- 第5章 金属及其化合物(章末复习)-2023-2024学年度高一化学同步精品讲义(沪科版必修第二册) 其他 3 次下载
5.3.1 化学变化中的能量变化(第1课时)-2023-2024学年度高一化学同步精品讲义(沪科版必修第二册)
展开
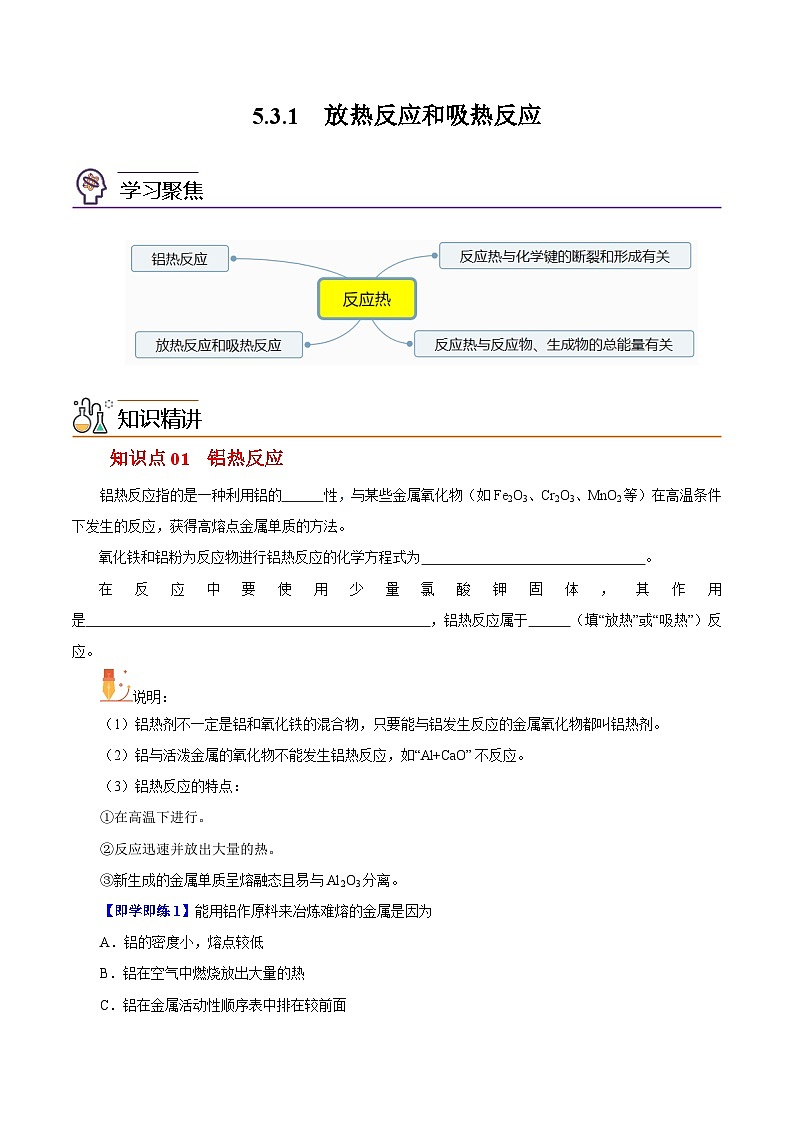
5.3.1 放热反应和吸热反应
学习聚焦
知识精讲
知识点01 铝热反应
铝热反应指的是一种利用铝的 还原 性,与某些金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温条件下发生的反应,获得高熔点金属单质的方法。
氧化铁和铝粉为反应物进行铝热反应的化学方程式为 2Al+Fe2O32Fe+Al2O3 。
在反应中要使用少量氯酸钾固体,其作用是 氯酸钾受热分解生成氧气,使镁条更剧烈地燃烧 ,铝热反应属于 放热 (填“放热”或“吸热”)反应。
说明:
(1)铝热剂不一定是铝和氧化铁的混合物,只要能与铝发生反应的金属氧化物都叫铝热剂。
(2)铝与活泼金属的氧化物不能发生铝热反应,如“Al+CaO”不反应。
(3)铝热反应的特点:
①在高温下进行。
②反应迅速并放出大量的热。
③新生成的金属单质呈熔融态且易与Al2O3分离。
【即学即练1】能用铝作原料来冶炼难熔的金属是因为
A.铝的密度小,熔点较低
B.铝在空气中燃烧放出大量的热
C.铝在金属活动性顺序表中排在较前面
D.铝具有还原性,发生铝热反应时放出大量热
【答案】D
【解析】“用铝作原料来冶炼难熔的金属”就是铝热反应,利用的是铝的还原性,在铝热反应中放热较多而使所得金属熔化,便于所得金属从产物中分离出来。答案为D。
知识点02 吸热反应和放热反应
在化学反应中,化学能可能有多种能量变化形式,如热能、光能、电能等。如果仅从化学能转化为热能的角度,就有了放热反应和吸热反应。
说明:
(1)任何化学反应都有能量变化,不存在既不放热、也不吸热的反应。
(2)对于可逆反应,如果正反应是放热反应,那么逆反应一定是吸热反应。
【即学即练2】 有下列七个反应:①煅烧石灰石制生石灰、②燃烧蜂窝煤取暖、③炸药爆炸、④硫酸与氢氧化钾溶液反应、⑤生石灰与水作用制熟石灰、⑥食物腐败、⑦碳与水蒸气反应制得水煤气。其中属于放热反应的一组是
A.①⑦ B.①⑤⑦ C. ②③④⑥ D. ②③④⑤⑥
【答案】D
【解析】由于大多数分解反应是吸热的,①是分解反应,应为吸热。另外,从反应条件也可得知,该反应需持续加热才能进行,也推测应为吸热反应。⑦的反应属于课本上已知吸热反应。答案为D。
知识点03 化学变化中的能量变化与化学键的关系
物质在发生化学反应时,反应物中化学发生断裂,需要吸收热量;而生成物中新的化学键形成,会放出热量。二者的能量差,便是反应所放出或吸收的热量。
可简单记为:断键吸热,成键放热。
对于放热反应,化学能转化为热能等释放出来;对于吸热反应,热能会转化为化学能储存起来。
【即学即练3】化学反应中的能量变化常表现为热量变化,如有的反应为放热反应,有的为吸热反应,请从下列选项中选出对此解释合理的为
A.旧化学键断裂时吸收的能量高于新化学键形成时所释放的总能量为吸热反应
B.旧化学键断裂时吸收的能量低于新化学键形成时所释放的总能量为吸热反应
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要使用催化剂的反应为放热反应
【答案】A
【解析】在化学反应中,断键吸热,成键放热。选项A,断键吸热大于成键放热,为吸热反应,此说法正确。选项C,有的放热反应也需加热,比如铝热反应,选项C错误。选项D,催化剂与反应的放热或吸热无关。
知识点04 化学变化中的能量变化与反应物、生成物总能量的关系
从反应物总能量和生成物总能量的角度看,反应热是二者的相对大小,如下图。
【即学即练4】由下图分析,下列说法正确的是
A.A = B+C与B+C = A两个反应吸收和放出的热量不等
B.A = B+C是放热反应
C.A具有的能量高于B和C具有的能量总和
D.A = B+C是吸热反应,B+C = A是放热反应
【答案】D
【解析】从图像可知,反应物A的能量较低,生成物B+C的能量较高。答案为D。
常见考法
常见考法一 铝热反应的实验方法及反应方程式
c
b
a
【例1】右图是铝热反应的装置图,对该反应叙述正确的是
A.铝热反应是放热反应,所以常温下可以反应
B.图中a为Mg条,b为KClO3,c为Al2O3和Fe的混合物
C.KClO3是该反应的催化剂
D.利用铝热反应可焊接钢轨,也可冶炼锰等难熔金属
【答案】D
【解析】选项A错,铝热反应需在高温下进行。选项B错,铝热剂是“Al和Fe2O3的混合物”,而不是“Al2O3和Fe的混合物”。答案为D。
必杀技
1.铝热反应是铝单质与某些金属氧化物的置换反应,也遵循金属活动性顺序表。
2.引发铝热反应需要高温。
3.反应生成的金属一般为熔融态,而生成物Al2O3由于熔点高呈固态,所以生成物易于分离。
【同步练习1】通过铝热反应能冶炼难熔的金属(如Cr、V、Mn等),与铝热反应无关的是
A.铝具有还原性 B.铝具有导电性
C.铝较Cr、V、Mn等价格便宜 D.铝热反应放出大量的热
【答案】B
【解析】铝热反应不需电流,与导电性无关。答案为B。
常见考法二 放热反应和吸热反应的辨识
【例2】下列过程放出热量的是
A.液氨汽化 B.碳酸钙分解 C.铝热反应 D.化学键断裂
【答案】C
【解析】选项A的“汽化”是吸热过程。选项B的分解反应是吸热的。对于选项D,化学反应中“断键吸热,成键放热”。答案为C。
必杀技
常见的吸热反应与放热反应:
【同步练习2】下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
【答案】D
【解析】①和③不是化学反应,应排除。⑤是放热反应。答案为D。
常见考法三 由图像判断放热反应和吸热反应
【例3】已知:Br+H2 = HBr+H,其反应的历程与能量变化如图所示,以下叙述正确的是
能量
反应历程
E1
E2
A.该反应是放热反应
B.加入催化剂,E1-E2的差值减小
C.H-H的键能大于H-Br的键能
D.因为E1>E2,所以反应物的总能量高于生成物的总能量
【答案】C
【解析】曲线的起点是反应物的总能量,终点是生成物的总能量,图像的起点低于终点,所以是吸热反应,选项A错误。“E1-E2的差值”是反应所吸收的热量,而催化剂不影响反应热,选项B错误。由于该反应是吸热反应,所以断开H-H键吸收的热量大于形成H-Br键放出的热量,即H-H的键能大于H-Br的键能,选项C正确。
必杀技
(1)E高→E低,放热;E低→E高,吸热。
(2)放出或吸收热量的多少与反应途径无关,只与起点和终点有关。
(3)物质的能量越低,在自然界中越稳定。
【同步练习3】已知:4Al(s)+ 3O2(g) =2Al2O3 (s),该反应放出的热量为Q kJ。下列能量图与该反应所体现的能量关系匹配的是
A B C D
【答案】B
【解析】该反应是放热反应,而图像A和D体现的是吸热反应,所以A、D可排除。化学反应放出的热量是反应物总能量与生成物总能量之差,所以C是错误的。答案为B。
分层提分
题组A 基础过关练
1.下列物质的组合,不属于铝热剂的是
A.Mg+Al2O3 B.FeO+Al C.Al+V2O5 D.Al+Cr2O3
【答案】A
【解析】铝热剂指的是铝单质作还原剂,而选项A中的还原剂是Mg。答案为A。
2.下列反应既是放热反应,又是氧化还原反应的是
A.Ba(OH)2•8H2O与NH4Cl的反应
B.灼热的炭与CO2反应
C.铝片与稀硫酸反应
D.NaOH溶液与盐酸溶液的中和反应
【答案】C
【解析】选项A、B都是吸热反应,选项D不是氧化还原反应。答案为C。
3.下列变化过程中,需要吸热的是
A.镁与盐酸反应 B.碘单质升华
C.浓硫酸溶于水 D.天然气燃烧
【答案】B
【解析】选项A、D都是放热的化学反应,选项C也是放热很多的。对于选项B,碘由固态到气态能量升高,是个吸热过程。答案为B。
4.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
【答案】A
【解析】“生成物总能量高于反应物总能量”,表明该反应是吸热反应,所以答案为A。
5.下列对铝热反应的说法错误的是
A.铝热剂中还原剂是铝粉 B.铝热剂是纯净物
C.铝与Fe2O3可组成铝热剂 D.铝热反应是放热反应
【答案】B
【解析】“铝热剂”是铝与某些金属氧化物的混合物,答案为B。
6.用铝热法还原下列化合物,若获得金属各1 mol,消耗铝最少的是
A.MnO2 B.Cr2O3 C.WO3 D.CuO
【答案】D
【解析】分别写出相应的化学方程式即可看出来。答案为D。
7.下列过程需要吸热的是
A.O2→O+O B.H+Cl→HCl C.CaO+H2O===Ca(OH)2 D.浓硫酸稀释
【答案】A
【解析】选项A是断开化学键,是个吸热过程。答案为A。
8.下列说法不正确的是
A.化学反应可分为吸热反应和放热反应
B.化学反应中的能量变化都是以热能的形式表现出来
C.化学反应的实质是旧键的断裂与新键的生成
D.化学反应能量变化的实质是旧键断裂吸收的能量与新键形成释放的能量大小不同
【答案】B
【解析】化学反应中的能量变化有多种表现形式,比如,发热、发光、转化为电能等,所以,热能仅是化学能转化的一种形式,选项B的说法不正确,答案为B。
9.下列反应中符合图示能量变化的是
A.煅烧石灰石制生石灰
B.氯酸钾分解制氧气
C.盐酸与NaOH溶液反应
D.工业上用H2还原Fe2O3制Fe
【答案】C
【解析】图像所示的反应是放热反应,而中和反应都是放热的,答案为C。
题组B 能力提升练
10.2A(g) B(g) (放热反应);下列能量变化示意图正确的是
A B C D
【答案】B
【解析】选项A和B都表示的是放热反应,而B(g)的能量应该高于B(l),所以答案为B。
11.对于放热反应H2+Cl22HCl,下列说法中正确的是
A.该反应中,化学能只转变为热能
B.反应物所具有的总能量高于生成物所具有的总能量
C.生成物所具有的总能量高于反应物所具有的总能量
D.断开1 mol H−H键和1 mol Cl−Cl键所吸收的总能量大于形成2 mol H−Cl键所放出的能量
【答案】B
【解析】从物质总能量的角度看,放热反应就是反应物总能量高于生成物总能量,所以选项B是正确的。对于选项D,断键吸热应小于成键放热,选项D是错误的。答案为B。
12.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
【答案】C
【解析】选项A,二者应互为同素异形体。对于B、C,由于石墨完全转化为金刚石需要吸收能量,说明了石墨的能量较低,金刚石的能量较高。物质的能量越低,该物质越稳定,所以B错C对。当质量相等时,由于石墨的能量较低,完全燃烧时放热应较少,选项D错误。答案为C。
反应物
生成物
催化反应
非催化反应
反应过程
能量
13.右图表示某个化学反应过程的能量变化。该图表明
A.催化剂可以改变该反应的热效应
B.该反应是个放热反应
C.反应物总能量低于生成物
D.化学反应遵循质量守恒定律
【答案】B
【解析】反应的能量变化取决于图像的起点和终点,与催化剂无关。该反应的反应物总能量高于生成物总能量,是放热反应。答案为B。
14.反应2 A(g) + B(g) 2 C(g) 的能量变化如图如示,
下列说法错误的是
A.加入催化剂,X点位置不变
B.加入催化剂,G的大小不变
C.该反应为放热反应
D.反应热为E与G的和
【答案】D
【解析】催化剂只能改变化学反应的过程,不改变图像中的X、Z、G,其中反应热就是G。答案为D。
15.把铝粉和氧化亚铁粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是
A.1∶1 B.2∶3 C.3∶2 D.28∶9
【答案】A
【解析】根据2Al+3FeO3Fe+Al2O3,由于“高温下恰好完全反应”,不妨令Al为2 mol,则FeO为3 mol。如果反应后加盐酸,则铝热反应生成的3 mol Fe与盐酸反应将生成3 mol氢气。如果铝热剂直接与烧碱溶液反应,则2 molAl也恰好生成3 mol氢气。所以答案为A。
16.已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2 CO2+2H2O
B.CaCO3 CaO+CO2↑
C.2H2O 2H2↑ + O2↑
D.Pb+PbO2+2H2SO4 2PbSO4+2H2O
【答案】A
【解析】选项A是化学能主要转化为热能;选项B是热能转化为化学能;选项C是电能转化为化学能;选项D的正向是化学能转化为电能,逆向是电能转化为化学能。答案为A。
17.我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2Si3N4+6CO
该反应变化过程中的能量变化如图所示。回答以下问题:
(1)上述反应中的还原剂是__________________,还原产物是______________。
(2)该反应________(填“吸热”或“放热”)。
【答案】(1)C Si3N4 (2)放热
【解析】(1)在反应中,C的化合价升高,作还原剂,N2的化合价降低,作氧化剂,生成的Si3N4是还原产物。
(2)由于图像中反应物的总能量高于生成物的总能量,所以是放热反应。
18.如图所示,把试管放入盛有25℃澄清石灰水饱和溶液的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述实验现象的原因是 。
(3)写出有关的离子方程式 。
(4)由实验推知,MgCl2和H2的总能量 (填“大于”、
“等于”、“小于”)镁条和盐酸的总能量。
【答案】(1)镁条上产生大量气泡;镁条逐渐溶解;烧杯中析出白色浑浊。
(2)镁与盐酸反应产生H2,该反应属于放热反应,而Ca(OH)2的溶解度随着温度的升高而降低,因此析出白色的Ca(OH)2晶体。
(3)Mg+2H+= Mg2++H2↑。
(4)小于。
【解析】镁条与盐酸的反应是放热反应,将使饱和石灰水的温度升高,而Ca(OH)2的溶解度随着温度的升高而降低,便会析出Ca(OH)2晶体。
题组C 培优拔尖练
19.将V1 mL1.00mol/L盐酸溶液和V2 mL 未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+ V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度为 1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
【答案】B
【解析】中和反应是放热反应,图像的最高点是恰好反应的情况。对于选项A,当盐酸加入5 mL时,溶液的温度为22 ℃,所以实验环境应小于22 ℃,选项A是错误的。选项C,当恰好反应时,消耗盐酸30 mL,则NaOH溶液为20 mL,由于盐酸是1.00 mol/L,则NaOH溶液为1.50 mol/L,选项C是错误的。答案为B。
20.某化学反应中生成物的总能量为60 kJ,如果该反应是放热反应,那么反应物总能量可能是
A.50 kJ B.30 kJ C.80 kJ D.20 kJ
【答案】C
【解析】该反应是放热反应,则反应物的总能量将高于生成物的总能量(60 kJ),答案为C。
21.为探究NaHCO3、Na2CO3与1 mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
序号
液体
固体
混合前温度
混合后最高温度
①
35 mL水
2.5 g NaHCO3
20 ℃
18.5 ℃
②
35 mL水
3.2 g Na2CO3
20 ℃
24.3 ℃
③
35 mL盐酸
2.5 g NaHCO3
20 ℃
16.2 ℃
④
35 mL盐酸
3.2 g Na2CO3
20 ℃
25.1 ℃
下列有关说法正确的是
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
【答案】C
【解析】实验①结论:NaHCO3溶于水吸热。实验②结论:Na2CO3溶于水放热。实验③相对于实验①,温度下降更多,所以NaHCO3与盐酸的反应是吸热反应。实验④相对于实验②,温度升高更多,所以Na2CO3与盐酸的反应是放热反应。答案为C。
22.下图是等质量的Na2CO3、NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较多的试管中加入的固体试剂是____________________,当反应结束时,A、B两试管中消耗的盐酸的质量之比为__________。
实验过程中我们还能感受到Na2CO3与盐酸反应时是放热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B两试管中的此反应过程中,反应体系的能量变化的总趋势分别对应于A:____,B:____。(填写a或b)
【答案】碳酸氢钠(NaHCO3) 53 :84; (b) (a)
【解析】等质量时(如都是106 g),Na2CO3将产生1 mol CO2,NaHCO3将产生106/84=1.26 mol CO2,所以NaHCO3产生气体较多。根据二者与盐酸反应的化学方程式可得出消耗盐酸的物质的量之比,由于是同一溶液,则物质的量之比也等于质量之比。
图像a表示的是放热反应,图像b表示的是吸热反应。
23.如图是某同学设计的放热反应的观察装置。
其实验操作步骤如下:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。试回答:
(1)实验前必须进行的一步实验操作是 。
(2)实验中观察到的现象是 。
(3)实验中发生的反应: 。
(4)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系: 。
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象? (填“能”或“否”)。
【答案】(1)检查装置的气密性
(2)U形管液面左低右高
(3)CaO+H2O = Ca(OH)2
(4)CaO和H2O所具有的总能量高于Ca(OH)2的能量
(5)否
【解析】CaO与H2O反应放热,使大试管内气体温度升高,压强增大,使U型管内的液体左低右高。如果把CaO换成NaCl,加水后溶液温度几乎不变,也就不会产生其他现象了。
学习聚焦
知识精讲
知识点01 铝热反应
铝热反应指的是一种利用铝的 还原 性,与某些金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温条件下发生的反应,获得高熔点金属单质的方法。
氧化铁和铝粉为反应物进行铝热反应的化学方程式为 2Al+Fe2O32Fe+Al2O3 。
在反应中要使用少量氯酸钾固体,其作用是 氯酸钾受热分解生成氧气,使镁条更剧烈地燃烧 ,铝热反应属于 放热 (填“放热”或“吸热”)反应。
说明:
(1)铝热剂不一定是铝和氧化铁的混合物,只要能与铝发生反应的金属氧化物都叫铝热剂。
(2)铝与活泼金属的氧化物不能发生铝热反应,如“Al+CaO”不反应。
(3)铝热反应的特点:
①在高温下进行。
②反应迅速并放出大量的热。
③新生成的金属单质呈熔融态且易与Al2O3分离。
【即学即练1】能用铝作原料来冶炼难熔的金属是因为
A.铝的密度小,熔点较低
B.铝在空气中燃烧放出大量的热
C.铝在金属活动性顺序表中排在较前面
D.铝具有还原性,发生铝热反应时放出大量热
【答案】D
【解析】“用铝作原料来冶炼难熔的金属”就是铝热反应,利用的是铝的还原性,在铝热反应中放热较多而使所得金属熔化,便于所得金属从产物中分离出来。答案为D。
知识点02 吸热反应和放热反应
在化学反应中,化学能可能有多种能量变化形式,如热能、光能、电能等。如果仅从化学能转化为热能的角度,就有了放热反应和吸热反应。
说明:
(1)任何化学反应都有能量变化,不存在既不放热、也不吸热的反应。
(2)对于可逆反应,如果正反应是放热反应,那么逆反应一定是吸热反应。
【即学即练2】 有下列七个反应:①煅烧石灰石制生石灰、②燃烧蜂窝煤取暖、③炸药爆炸、④硫酸与氢氧化钾溶液反应、⑤生石灰与水作用制熟石灰、⑥食物腐败、⑦碳与水蒸气反应制得水煤气。其中属于放热反应的一组是
A.①⑦ B.①⑤⑦ C. ②③④⑥ D. ②③④⑤⑥
【答案】D
【解析】由于大多数分解反应是吸热的,①是分解反应,应为吸热。另外,从反应条件也可得知,该反应需持续加热才能进行,也推测应为吸热反应。⑦的反应属于课本上已知吸热反应。答案为D。
知识点03 化学变化中的能量变化与化学键的关系
物质在发生化学反应时,反应物中化学发生断裂,需要吸收热量;而生成物中新的化学键形成,会放出热量。二者的能量差,便是反应所放出或吸收的热量。
可简单记为:断键吸热,成键放热。
对于放热反应,化学能转化为热能等释放出来;对于吸热反应,热能会转化为化学能储存起来。
【即学即练3】化学反应中的能量变化常表现为热量变化,如有的反应为放热反应,有的为吸热反应,请从下列选项中选出对此解释合理的为
A.旧化学键断裂时吸收的能量高于新化学键形成时所释放的总能量为吸热反应
B.旧化学键断裂时吸收的能量低于新化学键形成时所释放的总能量为吸热反应
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要使用催化剂的反应为放热反应
【答案】A
【解析】在化学反应中,断键吸热,成键放热。选项A,断键吸热大于成键放热,为吸热反应,此说法正确。选项C,有的放热反应也需加热,比如铝热反应,选项C错误。选项D,催化剂与反应的放热或吸热无关。
知识点04 化学变化中的能量变化与反应物、生成物总能量的关系
从反应物总能量和生成物总能量的角度看,反应热是二者的相对大小,如下图。
【即学即练4】由下图分析,下列说法正确的是
A.A = B+C与B+C = A两个反应吸收和放出的热量不等
B.A = B+C是放热反应
C.A具有的能量高于B和C具有的能量总和
D.A = B+C是吸热反应,B+C = A是放热反应
【答案】D
【解析】从图像可知,反应物A的能量较低,生成物B+C的能量较高。答案为D。
常见考法
常见考法一 铝热反应的实验方法及反应方程式
c
b
a
【例1】右图是铝热反应的装置图,对该反应叙述正确的是
A.铝热反应是放热反应,所以常温下可以反应
B.图中a为Mg条,b为KClO3,c为Al2O3和Fe的混合物
C.KClO3是该反应的催化剂
D.利用铝热反应可焊接钢轨,也可冶炼锰等难熔金属
【答案】D
【解析】选项A错,铝热反应需在高温下进行。选项B错,铝热剂是“Al和Fe2O3的混合物”,而不是“Al2O3和Fe的混合物”。答案为D。
必杀技
1.铝热反应是铝单质与某些金属氧化物的置换反应,也遵循金属活动性顺序表。
2.引发铝热反应需要高温。
3.反应生成的金属一般为熔融态,而生成物Al2O3由于熔点高呈固态,所以生成物易于分离。
【同步练习1】通过铝热反应能冶炼难熔的金属(如Cr、V、Mn等),与铝热反应无关的是
A.铝具有还原性 B.铝具有导电性
C.铝较Cr、V、Mn等价格便宜 D.铝热反应放出大量的热
【答案】B
【解析】铝热反应不需电流,与导电性无关。答案为B。
常见考法二 放热反应和吸热反应的辨识
【例2】下列过程放出热量的是
A.液氨汽化 B.碳酸钙分解 C.铝热反应 D.化学键断裂
【答案】C
【解析】选项A的“汽化”是吸热过程。选项B的分解反应是吸热的。对于选项D,化学反应中“断键吸热,成键放热”。答案为C。
必杀技
常见的吸热反应与放热反应:
【同步练习2】下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
【答案】D
【解析】①和③不是化学反应,应排除。⑤是放热反应。答案为D。
常见考法三 由图像判断放热反应和吸热反应
【例3】已知:Br+H2 = HBr+H,其反应的历程与能量变化如图所示,以下叙述正确的是
能量
反应历程
E1
E2
A.该反应是放热反应
B.加入催化剂,E1-E2的差值减小
C.H-H的键能大于H-Br的键能
D.因为E1>E2,所以反应物的总能量高于生成物的总能量
【答案】C
【解析】曲线的起点是反应物的总能量,终点是生成物的总能量,图像的起点低于终点,所以是吸热反应,选项A错误。“E1-E2的差值”是反应所吸收的热量,而催化剂不影响反应热,选项B错误。由于该反应是吸热反应,所以断开H-H键吸收的热量大于形成H-Br键放出的热量,即H-H的键能大于H-Br的键能,选项C正确。
必杀技
(1)E高→E低,放热;E低→E高,吸热。
(2)放出或吸收热量的多少与反应途径无关,只与起点和终点有关。
(3)物质的能量越低,在自然界中越稳定。
【同步练习3】已知:4Al(s)+ 3O2(g) =2Al2O3 (s),该反应放出的热量为Q kJ。下列能量图与该反应所体现的能量关系匹配的是
A B C D
【答案】B
【解析】该反应是放热反应,而图像A和D体现的是吸热反应,所以A、D可排除。化学反应放出的热量是反应物总能量与生成物总能量之差,所以C是错误的。答案为B。
分层提分
题组A 基础过关练
1.下列物质的组合,不属于铝热剂的是
A.Mg+Al2O3 B.FeO+Al C.Al+V2O5 D.Al+Cr2O3
【答案】A
【解析】铝热剂指的是铝单质作还原剂,而选项A中的还原剂是Mg。答案为A。
2.下列反应既是放热反应,又是氧化还原反应的是
A.Ba(OH)2•8H2O与NH4Cl的反应
B.灼热的炭与CO2反应
C.铝片与稀硫酸反应
D.NaOH溶液与盐酸溶液的中和反应
【答案】C
【解析】选项A、B都是吸热反应,选项D不是氧化还原反应。答案为C。
3.下列变化过程中,需要吸热的是
A.镁与盐酸反应 B.碘单质升华
C.浓硫酸溶于水 D.天然气燃烧
【答案】B
【解析】选项A、D都是放热的化学反应,选项C也是放热很多的。对于选项B,碘由固态到气态能量升高,是个吸热过程。答案为B。
4.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
【答案】A
【解析】“生成物总能量高于反应物总能量”,表明该反应是吸热反应,所以答案为A。
5.下列对铝热反应的说法错误的是
A.铝热剂中还原剂是铝粉 B.铝热剂是纯净物
C.铝与Fe2O3可组成铝热剂 D.铝热反应是放热反应
【答案】B
【解析】“铝热剂”是铝与某些金属氧化物的混合物,答案为B。
6.用铝热法还原下列化合物,若获得金属各1 mol,消耗铝最少的是
A.MnO2 B.Cr2O3 C.WO3 D.CuO
【答案】D
【解析】分别写出相应的化学方程式即可看出来。答案为D。
7.下列过程需要吸热的是
A.O2→O+O B.H+Cl→HCl C.CaO+H2O===Ca(OH)2 D.浓硫酸稀释
【答案】A
【解析】选项A是断开化学键,是个吸热过程。答案为A。
8.下列说法不正确的是
A.化学反应可分为吸热反应和放热反应
B.化学反应中的能量变化都是以热能的形式表现出来
C.化学反应的实质是旧键的断裂与新键的生成
D.化学反应能量变化的实质是旧键断裂吸收的能量与新键形成释放的能量大小不同
【答案】B
【解析】化学反应中的能量变化有多种表现形式,比如,发热、发光、转化为电能等,所以,热能仅是化学能转化的一种形式,选项B的说法不正确,答案为B。
9.下列反应中符合图示能量变化的是
A.煅烧石灰石制生石灰
B.氯酸钾分解制氧气
C.盐酸与NaOH溶液反应
D.工业上用H2还原Fe2O3制Fe
【答案】C
【解析】图像所示的反应是放热反应,而中和反应都是放热的,答案为C。
题组B 能力提升练
10.2A(g) B(g) (放热反应);下列能量变化示意图正确的是
A B C D
【答案】B
【解析】选项A和B都表示的是放热反应,而B(g)的能量应该高于B(l),所以答案为B。
11.对于放热反应H2+Cl22HCl,下列说法中正确的是
A.该反应中,化学能只转变为热能
B.反应物所具有的总能量高于生成物所具有的总能量
C.生成物所具有的总能量高于反应物所具有的总能量
D.断开1 mol H−H键和1 mol Cl−Cl键所吸收的总能量大于形成2 mol H−Cl键所放出的能量
【答案】B
【解析】从物质总能量的角度看,放热反应就是反应物总能量高于生成物总能量,所以选项B是正确的。对于选项D,断键吸热应小于成键放热,选项D是错误的。答案为B。
12.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
【答案】C
【解析】选项A,二者应互为同素异形体。对于B、C,由于石墨完全转化为金刚石需要吸收能量,说明了石墨的能量较低,金刚石的能量较高。物质的能量越低,该物质越稳定,所以B错C对。当质量相等时,由于石墨的能量较低,完全燃烧时放热应较少,选项D错误。答案为C。
反应物
生成物
催化反应
非催化反应
反应过程
能量
13.右图表示某个化学反应过程的能量变化。该图表明
A.催化剂可以改变该反应的热效应
B.该反应是个放热反应
C.反应物总能量低于生成物
D.化学反应遵循质量守恒定律
【答案】B
【解析】反应的能量变化取决于图像的起点和终点,与催化剂无关。该反应的反应物总能量高于生成物总能量,是放热反应。答案为B。
14.反应2 A(g) + B(g) 2 C(g) 的能量变化如图如示,
下列说法错误的是
A.加入催化剂,X点位置不变
B.加入催化剂,G的大小不变
C.该反应为放热反应
D.反应热为E与G的和
【答案】D
【解析】催化剂只能改变化学反应的过程,不改变图像中的X、Z、G,其中反应热就是G。答案为D。
15.把铝粉和氧化亚铁粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是
A.1∶1 B.2∶3 C.3∶2 D.28∶9
【答案】A
【解析】根据2Al+3FeO3Fe+Al2O3,由于“高温下恰好完全反应”,不妨令Al为2 mol,则FeO为3 mol。如果反应后加盐酸,则铝热反应生成的3 mol Fe与盐酸反应将生成3 mol氢气。如果铝热剂直接与烧碱溶液反应,则2 molAl也恰好生成3 mol氢气。所以答案为A。
16.已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2 CO2+2H2O
B.CaCO3 CaO+CO2↑
C.2H2O 2H2↑ + O2↑
D.Pb+PbO2+2H2SO4 2PbSO4+2H2O
【答案】A
【解析】选项A是化学能主要转化为热能;选项B是热能转化为化学能;选项C是电能转化为化学能;选项D的正向是化学能转化为电能,逆向是电能转化为化学能。答案为A。
17.我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2Si3N4+6CO
该反应变化过程中的能量变化如图所示。回答以下问题:
(1)上述反应中的还原剂是__________________,还原产物是______________。
(2)该反应________(填“吸热”或“放热”)。
【答案】(1)C Si3N4 (2)放热
【解析】(1)在反应中,C的化合价升高,作还原剂,N2的化合价降低,作氧化剂,生成的Si3N4是还原产物。
(2)由于图像中反应物的总能量高于生成物的总能量,所以是放热反应。
18.如图所示,把试管放入盛有25℃澄清石灰水饱和溶液的烧杯中,试管中开始放入几块镁条,再用滴管滴入5mL的盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述实验现象的原因是 。
(3)写出有关的离子方程式 。
(4)由实验推知,MgCl2和H2的总能量 (填“大于”、
“等于”、“小于”)镁条和盐酸的总能量。
【答案】(1)镁条上产生大量气泡;镁条逐渐溶解;烧杯中析出白色浑浊。
(2)镁与盐酸反应产生H2,该反应属于放热反应,而Ca(OH)2的溶解度随着温度的升高而降低,因此析出白色的Ca(OH)2晶体。
(3)Mg+2H+= Mg2++H2↑。
(4)小于。
【解析】镁条与盐酸的反应是放热反应,将使饱和石灰水的温度升高,而Ca(OH)2的溶解度随着温度的升高而降低,便会析出Ca(OH)2晶体。
题组C 培优拔尖练
19.将V1 mL1.00mol/L盐酸溶液和V2 mL 未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+ V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度为 1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
【答案】B
【解析】中和反应是放热反应,图像的最高点是恰好反应的情况。对于选项A,当盐酸加入5 mL时,溶液的温度为22 ℃,所以实验环境应小于22 ℃,选项A是错误的。选项C,当恰好反应时,消耗盐酸30 mL,则NaOH溶液为20 mL,由于盐酸是1.00 mol/L,则NaOH溶液为1.50 mol/L,选项C是错误的。答案为B。
20.某化学反应中生成物的总能量为60 kJ,如果该反应是放热反应,那么反应物总能量可能是
A.50 kJ B.30 kJ C.80 kJ D.20 kJ
【答案】C
【解析】该反应是放热反应,则反应物的总能量将高于生成物的总能量(60 kJ),答案为C。
21.为探究NaHCO3、Na2CO3与1 mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
序号
液体
固体
混合前温度
混合后最高温度
①
35 mL水
2.5 g NaHCO3
20 ℃
18.5 ℃
②
35 mL水
3.2 g Na2CO3
20 ℃
24.3 ℃
③
35 mL盐酸
2.5 g NaHCO3
20 ℃
16.2 ℃
④
35 mL盐酸
3.2 g Na2CO3
20 ℃
25.1 ℃
下列有关说法正确的是
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
【答案】C
【解析】实验①结论:NaHCO3溶于水吸热。实验②结论:Na2CO3溶于水放热。实验③相对于实验①,温度下降更多,所以NaHCO3与盐酸的反应是吸热反应。实验④相对于实验②,温度升高更多,所以Na2CO3与盐酸的反应是放热反应。答案为C。
22.下图是等质量的Na2CO3、NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较多的试管中加入的固体试剂是____________________,当反应结束时,A、B两试管中消耗的盐酸的质量之比为__________。
实验过程中我们还能感受到Na2CO3与盐酸反应时是放热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B两试管中的此反应过程中,反应体系的能量变化的总趋势分别对应于A:____,B:____。(填写a或b)
【答案】碳酸氢钠(NaHCO3) 53 :84; (b) (a)
【解析】等质量时(如都是106 g),Na2CO3将产生1 mol CO2,NaHCO3将产生106/84=1.26 mol CO2,所以NaHCO3产生气体较多。根据二者与盐酸反应的化学方程式可得出消耗盐酸的物质的量之比,由于是同一溶液,则物质的量之比也等于质量之比。
图像a表示的是放热反应,图像b表示的是吸热反应。
23.如图是某同学设计的放热反应的观察装置。
其实验操作步骤如下:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。试回答:
(1)实验前必须进行的一步实验操作是 。
(2)实验中观察到的现象是 。
(3)实验中发生的反应: 。
(4)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系: 。
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象? (填“能”或“否”)。
【答案】(1)检查装置的气密性
(2)U形管液面左低右高
(3)CaO+H2O = Ca(OH)2
(4)CaO和H2O所具有的总能量高于Ca(OH)2的能量
(5)否
【解析】CaO与H2O反应放热,使大试管内气体温度升高,压强增大,使U型管内的液体左低右高。如果把CaO换成NaCl,加水后溶液温度几乎不变,也就不会产生其他现象了。
相关资料
更多









