



所属成套资源:【同步讲义】高中化学(人教版2019)必修第二册-全册讲义+单元测试题
【同步讲义】高中化学(人教版2019)必修第二册--第09讲 化学反应与电能 讲义
展开
这是一份【同步讲义】高中化学(人教版2019)必修第二册--第09讲 化学反应与电能 讲义,文件包含同步讲义高中化学人教版2019必修第二册--第09讲化学反应与电能学生版docx、同步讲义高中化学人教版2019必修第二册--第09讲化学反应与电能教师版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
第09讲 化学反应与电能
目标导航
课程标准
课标解读
1.以原电池为例认识化学能可以转化为电能。
2.从氧化还原反应的角度初步认识原电池的工作原理。
1.培养学生的实验操作能力、观察能力、科学的学习方法,培养学生创造性思维与探究能力,以及提出问题、分析问题、解决问题的能力。
2.通过小组探究实验活动,培养学生自主探索创新精神和同学间的交流合作学习的协作精神,并通过实验不断体现出由实践→认识→再实践一再认识的认知过程。
知识精讲
知识点01 化学能转化为电能
1.化学能间接转化为电能
(1)火力发电原理:通过化石燃料燃烧,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。
(2)能量转换过程
①化学能热能机械能电能
②能量转换的关键环节是可燃物的燃烧,属于氧化还原反应。
(3)火力发电存在的弊端
①使用的化石燃料属于不可再生资源;
②化石燃料的燃烧会产生大量的有害气体(如SO2、CO等)及粉尘,污染环境;
③能量经过多次转化,能量利用率低。
2.化学能直接转化为电能——原电池
(1)实验探究
实验装置
实验现象
实验结论
锌片溶解,表面产生气泡,铜片上无气泡
锌与稀硫酸反应,铜与稀硫酸不反应
锌片溶解,铜片上有气泡
锌片参与反应,铜片上产生氢气
锌片溶解,铜片上有气泡,电流表指针偏转
该装置将化学能转化为电能
(2)原电池:将化学能转变为电能的装置。
(3)工作原理(以铜-锌-稀硫酸原电池为例)
电极材料
电极名称
电子流向
电极反应式
反应类型
锌
负极
流出
Zn-2e-Zn2+
氧化反应
铜
正极
流入
2H++2e-H2↑
还原反应
总反应
化学方程式:Zn+H2SO4ZnSO4+H2↑
离子方程式:Zn+2H+Zn2++H2↑
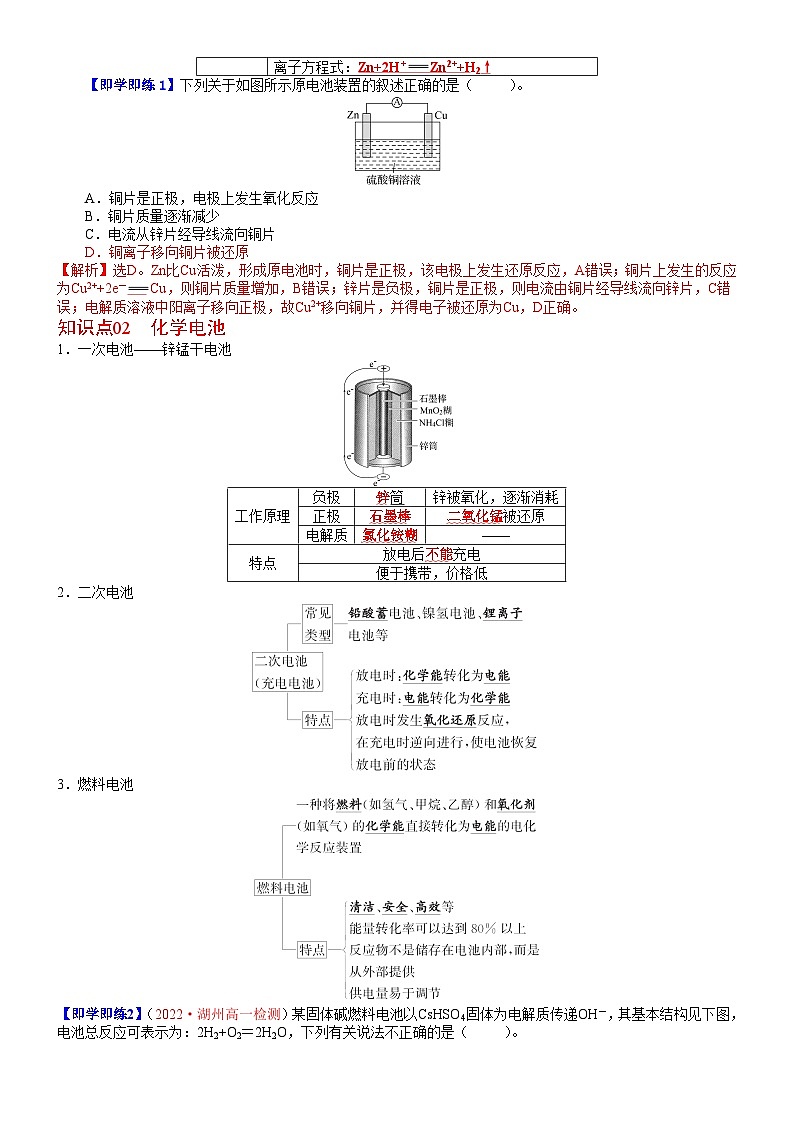
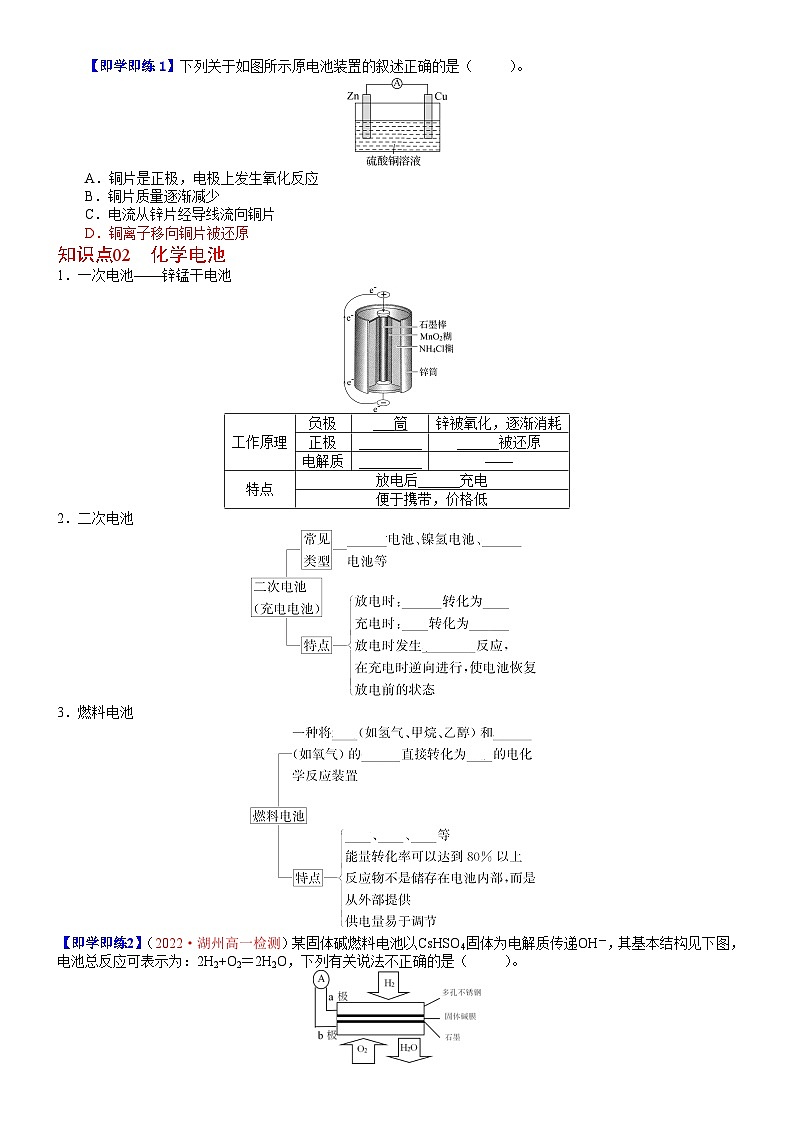
【即学即练1】下列关于如图所示原电池装置的叙述正确的是( )。
A.铜片是正极,电极上发生氧化反应
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.铜离子移向铜片被还原
【解析】选D。Zn比Cu活泼,形成原电池时,铜片是正极,该电极上发生还原反应,A错误;铜片上发生的反应为Cu2++2e-Cu,则铜片质量增加,B错误;锌片是负极,铜片是正极,则电流由铜片经导线流向锌片,C错误;电解质溶液中阳离子移向正极,故Cu2+移向铜片,并得电子被还原为Cu,D正确。
知识点02 化学电池
1.一次电池——锌锰干电池
工作原理
负极
锌筒
锌被氧化,逐渐消耗
正极
石墨棒
二氧化锰被还原
电解质
氯化铵糊
——
特点
放电后不能充电
便于携带,价格低
2.二次电池
3.燃料电池
【即学即练2】(2022·湖州高一检测)某固体碱燃料电池以CsHSO4固体为电解质传递OH-,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法不正确的是( )。
A.电子通过外电路从a极流向b极
B.b电极为正极
C.a极上的电极反应式为:H2-2e-=2H+
D.该装置能将化学能转变为电能
【解析】选C。根据总反应可知氢元素的化合价升高,失去电子,则通入氢气的一极为负极,则a为负极,b为正极,电子通过外电路从负极流向正极,所以电子应该是通过外电路由a极流向b,故A正确;通入氧气的一极为正极,则b电极为正极,故B正确;由题意可知,该燃料电池以CsHSO4固体为电解质传递OH-,则a极上的电极反应式为:H2+2OH--2e-=2H2O,故C错误;该装置为固体碱燃料电池,能将化学能转变为电能,故D正确。
能力拓展
考法01 原电池原理
【典例1】(2022·湖南张家界高一下期中检测)电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-=Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-=Ag+2OH-,总反应式为:Ag2O+H2O+Zn=Zn(OH)2+2Ag。下列说法不正确的是( )。
A.锌是负极,氧化银是正极
B.锌发生氧化反应,氧化银发生还原反应
C.溶液中OH-向正极移动,K+、H+向负极移动
D.随着电极反应的不断进行,电解质溶液的pH会增大
【解析】选C。根据总反应以及原电池的工作原理,Zn的化合价升高,即Zn为负极,氧化银为正极,故A说法正确;根据A选项分析,Zn为负极,发生氧化反应,氧化银中Ag的化合价降低,氧化银发生还原反应,故B说法正确;根据原电池工作原理,阴离子向负极移动,阳离子向正极移动,即OH-向负极移动,K+、H+向正极移动,故C说法错误;电解质溶液为碱性,根据总反应可知,该反应消耗水,KOH浓度增大,pH增大,故D说法正确。
【规律方法】原电池正、负极的判断基础是氧化还原反应,如果给出一个方程式判断正、负极,可以直接根据化合价的升降来判断。发生氧化反应的一极为负极,发生还原反应的一极为正极。
【知识拓展】
1.原电池的构成条件
2.原电池工作原理
(1)反应类型:负极发生氧化反应,正极发生还原反应。
(2)电子的移动方向:从负极流出,经导线流向正极。
(3)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
(4)电流方向:正极→导线→负极。
3.原电池正、负极的判断
考法02 原电池的应用
【典例2】(2022·吉林梅河口高一下期中)有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验
装置
部分实
验现象
a极质量减小,b极质量增大
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )。
A.a>b>d>c B.b>c>d>a
C.a>b>c>d D.d>a>b>c
【解析】选D。原电池中,通常负极金属的活动性大于正极金属的活动性。通过电极现象判断金属的正负极,从而比较金属活动性。装置一:a极质量减小,则a为负极、失电子溶解;b极质量增大,则金属离子得电子析出。故金属活动性a>b。装置二:金属b、c未用导线连接,不是原电池。b极有气体产生,c极无变化,则活动性b>(H)>c。装置三:d极溶解,则a为负极;c极有氢气产生,则c为正极。故金属活动性d>c。装置四:电流从a极流向d极,则d为负极、a为正极,金属活动性d>a。综上,金属活动性d>a>b>c。
【规律方法】根据原电池原理判断金属性强弱
(1)若两种金属作电极,负极的还原性强于正极;
(2)电子是从负极流向正极,而不是从正极流向负极;
(3)原电池负极发生氧化反应,而正极发生还原反应;
(4)金属阳离子的氧化性越弱,对应金属的还原性越强。
【知识拓展】
1.加快化学反应速率
2.比较金属活泼性强弱
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
3.设计原电池
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(一般为电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料;正极材料一般活泼性比负极的弱,也可以是能导电的非金属。
②电解质溶液:电解质溶液一般能与负极材料反应。
考法03 实用电池分析
【典例3】(2022·湖南省等级考)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( )。
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
【解析】选C。海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,故A正确;M极上Li失去电子发生氧化反应,则M电极为负极,电极反应为Li-e-Li+,则N为正极,电极反应为2H2O+2e-2OH-+H2↑,故B正确;Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,但不能传导离子,故C错误;该电池不可充电,属于一次电池,故D正确。
【知识拓展】几种电池的特点
名称
干电池
(一次电池)
充电电池
(二次电池)
燃料电池
特点
活性物质(发生氧化还原反应的物质)消耗到一定程度后,不能再使用
①放电后可再充电使活性物质获得再生
②可以多次充电,重复使用
①电极本身不包含活性物质,只是一个催化转换元件
②工作时,燃料和氧化剂连续由外部供给,在电极上不断进行反应,生成物不断被排出
举例
普通的锌锰干电池、碱性锌锰干电池、银锌电池等
铅酸蓄电池、锂离子电池、镍氢电池等
氢氧燃料电池、CH4燃料电池、CH3OH燃料电池等
分层提分
题组A 基础过关练
1.(陕西省西安市2021~2022学年高一下学期期末)下列电池工作时能量转化形式与其它三个不同的是( )。
A.锌锰碱性电池 B.硅太阳能电池
C.铅蓄电池 D.银锌纽扣电池
【解析】选B。太阳能电池是将太阳能转化为电能的装置,而其他电池均是将化学能转化为电能的装置。
2.化学电池可以直接将化学能转化为电能,化学电池的本质是( )。
A.化合价的升降 B.电子的转移
C.氧化还原反应 D.电能的储存
【解析】选C。化学电池可以直接将化学能转化为电能,其特征是由电流的产生,而电子定向一定才能形成电流,有电子转移的反应为氧化还原反应,所以化学电池的本质是氧化还原反应。
3.在如图所示的8个装置中,属于原电池的是( )。
A.①④ B.③④⑤ C.④⑧ D.②④⑥⑦
【解析】选D。①不存在两个电极,不是原电池;②满足原电池的构成条件,是原电池;③两个电极相同,不是原电池;④满足原电池的构成条件,是原电池;⑤酒精是非电解质,不是原电池;⑥满足原电池的构成条件,是原电池;⑦满足原电池的构成条件,是原电池;⑧未构成回路,不是原电池。
4.(2022·湖南醴陵高一下期中检测)下列可设计成原电池的化学反应是( )。
A.H2O(液)+CaO(固)=Ca(OH)2(固)
B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C.2KClO32KCl+3O2↑
D.CH4(气)+2O2(气)CO2(气)+2H2O(液)
【解析】选D。可设计成原电池的化学反应是能自发进行氧化还原反应,并且是放热反应。C中反应时氧化还原反应,但是属于吸热反应,不能设计成原电池。
5.(2022·株洲高一检测)某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是( )。
A.锌片作正极
B.碳棒上有气泡产生
C.可将电能转化为化学能
D.电子由碳棒经滤纸流向锌片
【解析】选B。电池工作时,Zn失去电子,作负极,故A错误;碳棒为正极,氢离子在正极上得到电子生成氢气,有气泡产生,故B正确;原电池中化学能转化为电能,故C错误;Zn为负极,电子由锌片经导线流向碳棒,故D错误。
6.(山东省济宁市兖州区2021~2022学年高一下学期期中)某原电池总反应的离子方程式为:2Fe3++Fe3Fe2+,能实现该反应的原电池是( )。
A
B
C
D
正极
Ag
C
Fe
Cu
负极
Fe
Fe
Zn
Fe
电解质溶液
FeCl3
FeCl2
Fe2(SO4)3
CuSO4
【解析】选A。A中原电池总反应的离子方程式为2Fe3++Fe3Fe2+,A正确;B中没有自发的氧化还原反应,不能构成原电池,B错误;选项中锌比铁活泼,锌做负极,发生氧化反应,总反应为2Fe3++Zn2Fe2++Zn2+,C错误;D中原电池总反应的离子方程式为Fe+Cu2+Fe2++Cu,D错误。
7.(2022·菏泽高一检测)a、b、c都是金属,把a浸入c的硝酸盐溶液中,a的表面有c析出,a、b和酸溶液组成原电池时,b为电池的负极。a、b、c三种金属的活动性顺序为( )。
A.a>b>c B.a>c>b C.b>a>c D.b>c>a
【解析】选C。a能从c的硝酸盐溶液中置换出c,金属活动性:a>c;a、b和酸溶液组成原电池时,b为负极,则金属活动性:b>a。
8.(2020·山东合格考)某同学设计的原电池装置如图,下列说法错误的是( )。
A.该电池的总反应为Fe+2Fe3+=3Fe2+
B.Fe极为电池的负极
C.电子从C极经导线流向Fe极
D.Fe3+在C极表面被还原
【解析】选C。根据原电池原理,Fe为负极,负极上Fe失去电子生成Fe2+,
C极为正极,正极上Fe3+得电子,被还原,生成Fe2+,电池反应为Fe+2Fe3+=3Fe2+,原电池中电子由负极流出,经导线流入正极,故C错误。
9.某原电池结构如图所示,回答下列问题:
(1)铜作原电池的_______极,发生_______反应,电极反应式为______________;
(2)银作原电池的_______极,发生_______反正,电极反应式为______________;
(3)电子从_______经外电路流向_______,银离子向_______极移动,硝酸根离子向_______极移动(填“正极”或“负极”)。
【解析】(1)铜银原电池中,Cu为负极,负极上铜失去电子生成铜离子,发生氧化反应,电极反应式为Cu-2e-=Cu2+;(2)银为正极,银棒上银离子得到电子生成银,发生还原反应,电极反应式为2Ag++2e-=2Ag;(3)在铜银原电池中,电子从负极经外电路流向正极,电解质溶液中银离子向正极移动,硝酸根离子向负极移动。
【答案】(1)负;氧化;Cu-2e-=Cu2+
(2)正;还原;2Ag++2e-=2Ag
(3)负极;正极;正极;负极
10.(2022·内蒙古赤峰高一下期中检测)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)B中反应的离子方程式为____________________________。
(2)A中作正极的金属是_____,该电极上看到的现象为_________________。
(3)C中作负极的金属是_____,该电极反应方程式为__________________。
(4)现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡产生,在A上发生__________(填“氧化”或“还原”)反应。
【解析】(1)B中是铁和稀硫酸反应,故其离子方程式为Fe+2H+=Fe2++H2↑;(2)A中铁比铜活泼,故铁作负极,铜作正极,该原电池正极上看到的现象为有气泡产生;(3)C中锌比铁更活泼,故锌作负极,负极上通常是电极本身失电子被氧化,故电极反应方程式为Zn-2e-=Zn2+;(4)观察到A上有气泡产生,故A上发生的电极反应为2H++2e-=H2↑,故为还原反应。
【答案】(1)Fe+2H+=Fe2++H2↑
(2)Cu;有气泡产生(3)Zn;Zn-2e-=Zn2+(4)还原
题组B 能力提升练
1.(2022·天津红桥区高一检测)2022年6月5日,神舟十四号载人飞船成功将3名航天员送入空间站,空间站中一种能量储存系统原理如图所示,图中没有涉及的能量转化形式是( )。
A.电能转化为化学能 B.太阳能转化为电能
C.化学能转化为电能 D.太阳能转化为动能
【解析】选D。在装置X中,太阳能电池产生的电能,将水电解生成O2和H2,实现电能转化为化学能,A不符合题意;在太阳能电池板上,太阳能转化为电能,B不符合题意;在装置Y中,O2、H2反应转化为H2O,将化学能转化为电能,C不符合题意;马达工作时,电能转化为机械能,该图中没有涉及太阳能转化为动能,D符合题意。
2.电能是现代社会中应用最广泛的一种能源。下列与电有关的叙述中,正确的是( )。
A.电能属于一次能源
B.锂离子电池属于一次电池
C.火力发电将电能间接转化为热能
D.电池工作时发生了氧化还原反应
【解析】选D。电能是由煤、风等一次能源转化来的能源,属于二次能源,A错误;锂离子电池是可充电电池,属于二次电池,B错误;火力发电的能量转化过程为化学能→热能→机械能→电能,C错误;电池放电时将化学能转化成电能,发生了氧化还原反应,D正确。
3.(2022年1月江苏合格考模拟)如图为发光二极管连接柠檬电池。下列说法不正确的是( )。
A.该装置的能量转化形式主要为化学能→电能
B.电子的流向:Zn→导线→Cu→柠檬液→Zn
C.锌片是负极,质量不断减小
D.铜片上的电极反应为:2H++2e-=H2↑
【解析】选B。A项,该装置的能量转化是化学能变电能,A正确;B项,锌为负极,铜为正极,电子从锌流出,经过导线,流向铜,电子不能通过溶液,B错误;C项,锌为负极,反应生成锌离子,质量不断减小,C正确;D项,铜为正极,溶液中的氢离子得到电子生成氢气,D正确。
4.(2022·福州师大附中高一下期中检测)某普通锌锰干电池的结构如下图所示。下列说法正确的是( )。
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨沿电解质溶液流向锌筒
【解析】选C。锌锰干电池中,锌筒作负极,石墨作正极,选项A错误;锌锰干电池中,锌筒作负极,石墨作正极,正极上二氧化锰得电子发生还原反应,选项B错误;原电池中阳离子定向移动到正极,故铵根离子流向石墨电极,选项C正确;电子经导线由负极锌筒流向正极石墨电极,选项D错误。
5.(2022·宁波高一检测)小明利用家中废旧材料制作了一个可使玩具扬声器发出声音的电池,装置如图。下列有关该电池工作时的说法不正确的是( )。
A.木炭棒是正极材料,发生还原反应
B.电子流向为铝质汽水罐→导线→扬声器→导线→木炭棒
C.食盐水中的Na+向木炭棒移动
D.木炭棒上发生的反应为2H++2e-=H2↑
【解析】选D。该原电池的负极是活泼金属铝,易被腐蚀,发生失电子的氧化反应,木炭棒是正极材料,发生还原反应,故A正确;在原电池中,电子从负极流向正极,铝是负极,木炭棒为正极,则电子流向为铝质汽水罐→导线→扬声器→导线→木炭棒,故B正确;原电池中,电解质溶液里的阳离子钠离子移向正极浸有食盐水的木炭棒,故C正确;在原电池的正极浸有食盐水的木炭棒上发生得电子的还原反应,在中性环境下,发生反应:O2+4e-+2H2O=4OH-,故D错误。
6.(2021~2022学年浙江省宁波市高一下期中)汽车的启动电源常用铅蓄电池。放电时的电池反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )。
A.PbO2是电池的负极
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.负极电极反应式:Pb-2e-+SO42-=PbSO4
【解析】选D。根据电池反应式知,PbO2在反应中得电子化合价由+4价变为+2价,所以二氧化铅作正极,故A错误;放电时,硫酸参加反应,导致溶液中氢离子浓度减小,则溶液的酸性减弱,故B错误;PbO2得电子,被还原,故C错误;Pb失电子作负极,反应式为:Pb+SO42--2e -=PbSO4↓,故D正确。
7.(2022·哈尔滨高一下期中检测)将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )。
【解析】选A。a中加入CuSO4溶液,被置换出的铜覆盖在Zn的表面,形成原电池,产生H2的速率加快,反应所需时间缩短,但置换铜时消耗了一部分锌,故与稀硫酸反应的锌的质量减少,完全反应后生成的H2的量比b少。
8.根据下图,可判断出下列离子方程式中错误的是( )。
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
【解析】选A。第一个原电池装置中,Cd作负极,Co作正极,自发进行的氧化还原反应是:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq),还原性:Cd>Co;第二个原电池装置中,Co作负极,Ag作正极,自发进行的氧化还原反应是:2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq),还原性:Co>Ag,即Cd>Co>Ag。根据置换反应的规律判断:Ag不能置换出Cd,A选项错误,其余选项都正确。
9.甲、乙两位同学分别按图1所示装置进行实验,甲同学在虚线框内接一个电流计,乙同学在虚线框内没有做连接,请回答下列问题:
(1)以下叙述正确的是______。
a.甲同学实验中,石墨棒上无气泡产生
b.甲、乙两同学实验中的铁片都是负极
c.甲同学实验中,电子在溶液中没有迁移
d.甲、乙同学在实验中都发现有气泡生成,产生气泡的速率甲比乙慢
(2)甲同学观察到电流计指针发生偏转,根据实验中的发现,绘制了图2,X轴表示实验时流入正极的电子的物质的量,则Y轴可能表示______。
a.石墨棒的质量 b.铁棒的质量 c.c(H+)
d.c(SO42-) e.c(Fe2+)
(3)采用甲同学装置,实验时把稀硫酸换成硫酸铜溶液,请写出铁电极电极反应式:________________,石墨电极观察到的现象________________,发生了______反应(填“氧化”、“还原”或“非氧化还原”)。
【解析】(1)甲同学实验中,构成铁碳原电池,铁为原电池的负极,石墨棒为正极,氢离子得到电子生成氢气,故a错误;甲同学实验中,构成了原电池,铁为原电池的负极,石墨为原电池的正极,乙同学实验中在虚线框内没有做连接,不构成原电池,铁片与稀硫酸发生化学反应,故b错误;甲同学实验中,构成了原电池,电子在导线上运动,从铁到碳,溶液中没有迁移,故c正确;甲同学实验中,构成了原电池,属于铁的电化学腐蚀,乙同学实验中在虚线框内没有做连接,不构成原电池,铁片与稀硫酸反应,属于化学腐蚀,电化学腐蚀速率大于化学腐蚀的速率,所以甲中产生氢气的速率比乙快,故d错误;(2)铁碳原电池中,铁是负极,失去电子发生氧化反应,电极反应为Fe-2e-=Fe2+,碳是正极,氢离子得电子发生还原反应,电极反应为2H++2e-=H2↑。石墨棒是正极,氢离子得电子发生还原反应,石墨棒的质量不变,故a错误;由于铁是负极,不断发生反应Fe-2e-=Fe2+,所以铁棒的质量减小,故b正确;由于反应不断消耗H+产生氢气,所以溶液的c(H+)逐渐降低,故c正确;SO42-不参加反应,其浓度不变,故d错误;由于铁是负极,不断发生反应Fe-2e-=Fe2+,所以溶液中c(Fe2+)增大,故e错误;(3)如果把硫酸换成硫酸铜溶液,则电池总反应为铁与铜离子的反应,负极铁失去电子,电极反应为Fe-2e-=Fe2+,正极石墨上铜离子得到电子生成铜,Cu2++2e-=Cu,石墨电极上有红色物质析出,发生还原反应。
【答案】(1)c(2)bc
(3)Fe-2e-=Fe2+;石墨电极上有红色物质析出;还原
10.(2022·安徽芜湖高一下期中检测)科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:
(1)该装置的能量转化形式为______________。
(2)Pt(a)电极是电池_____(填“正”或“负”)极。
(3)电解液中的H+向_________(填“a”或“b”)极移动。
(4)如果该电池工作时消耗1molCH3OH,则电路中通过____mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是_________________________。
【解析】(1)该装置的能量转化形式为原电池反应是化学能转化为电能;(2)Pt(a)电极甲醇通入失电子发生氧化反应,是电池负极;(3)燃料电池中,通入燃料的电极Pt(a)为负极,负极上失电子发生氧化反应,通入氧气的电极Pt(b)为正极,氧气得到电子生成氢氧根离子,电解液中的H+向正极移动,即向b电极移动;(4)通入燃料的电极为负极,负极上失电子发生氧化反应,电极反应为:CH3OH+H2O-6e-=CO2+6H+,则该电池工作时消耗1molCH3OH,则电路中通过6mol电子;(5)燃料电池的能量转化率高,甲醇反应产物为CO2和H2O,对环境无污染。
【答案】(1)化学能转化为电能(2)负(3)b(4)6(5)对环境无污染
题组C 培优拔尖练
1.(2022·邯郸高一检测)以电池为动力的纯电动汽车的普及,更有利于我国的环境保护。下列有关电池的叙述不正确的是( )。
A.水果电池是方便实用的家用电池
B.铅酸蓄电池是一种常用的二次电池
C.氢氧燃料电池是一种高效、无污染的发电装置
D.锌锰干电池工作一段时间后,锌外壳逐渐变薄
【解析】选A。水果电池产生的电流非常微弱且不能连续长时间放电,不能作为家用电池;铅酸蓄电池是一种常用的二次电池;氢氧燃料电池产物为水,无污染;锌锰干电池工作时,Zn放电被消耗,故工作一段时间后锌外壳会逐渐变薄,B、C、D正确,A错误。
2.(2022·贵阳高一上学期期末检测)锌与100mL 1mol·L-1盐酸反应的实验中,若设想向溶液中分别加入少量的:①醋酸钠;②溴化铜;③醋酸铜(均为可溶性),并测定生成H2的速率(mL·min-1),预计三种方案的速率大小是( )。
A.①>③>② B.③>②>①
C.②>③>① D.①>②>③
【解析】选C。加入少量醋酸钠固体,CH3COO-与H+结合生成CH3COOH(弱酸),氢离子浓度变小,反应速率减慢;加入溴化铜,锌可以置换出Cu,Cu能与Zn形成原电池,反应速率加快;加入醋酸铜,锌可以置换出Cu,Cu能与Zn形成原电池,反应速率加快,但是同时CH3COO-与H+结合生成CH3COOH,反应速率又减慢,所以反应速率介于①和②之间。
3.(2021·浙江7月学考)某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如图,实验所得数据如下:
实验编号
水果种类
电极间距离/cm
电流/μA
1
番茄
1
98.7
2
番茄
2
72.5
3
苹果
2
27.2
电池工作时,下列说法不正确的是( )。
A.化学能主要转化为电能
B.负极电极反应式为Zn-2e-=Zn2+
C.电子从锌片经水果流向铜片
D.水果种类和电极间距离对电流的大小均有影响
【解析】选C。电池工作时(原电池)为将化学能转化为电能的装置,故A正确;由图示分析可知,Zn为负极,失去电子,发生氧化反应,即负极的电极反应为Zn-2e-=Zn2+,故B正确;电子从锌片经导线流向铜片,而不能经水果流向铜片,故C错误;由表中的数据分析可知不同的水果以及同种水果电极间距离不同,则电流的大小也不同,所以水果种类和电极间距离对电流的大小均有影响,故D正确。
4.(2022·安徽六安高一下期中)常温下,将除去表面氧化膜的铝、铜片插入浓HNO3中组成的原电池如图所示,发现电流计指针偏向铝,铝片上有气体生成,下列说法正确的是( )。
A.铝比铜活泼,作负极,发生氧化反应
B.铝电极上生成的气体是H2
C.电子从铜电极流出,经导线流入铝电极,经过电解质溶液回到铜电极
D.铜电极的电极反应式:Cu-2e-=Cu2+
【解析】选D。铝比铜活泼,但常温下浓硝酸能使铝钝化,则Cu发生氧化反应、作负极,故A错误;铝电极作正极,正极上NO3-得电子生成NO2气体,正极反应式为NO3--e-+2H+=NO2↑+H2O,故B错误;该原电池中,铜作负极,Al作正极,电子从铜电极流出,经导线流入铝电极,但电子不能进入溶液中,故C错误;该原电池中,铜作负极,负极电极反应式为Cu-2e-=Cu2+,故D正确。
5.(2022·宁夏石嘴山高一下期中)如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )。
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
【解析】选D。根据题意,若杠杆为绝缘体,滴入CuSO4溶液后,Cu在铁球表面析出,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,Cu在铜球表面析出,Fe部分溶解,A端下沉。
6.(2021·广东合格考)一种以稀硫酸为电解质溶液的钒(V)蓄电池装置如图所示,a、b为惰性电极。该电池放电时( )。
A.电能转化为化学能
B.a为电池的正极
C.H+由a极移向b极
D.b的电极反应式:V3++e-=V2+
【解析】选B。钒(V)蓄电池放电时,化学能转化为电能,充电时,电能转化为化学能,A错误;从放电时外电路中电子的定向移动方向可知,电子从负极流出,经过导线、电流表,流入正极,因此a为电池的正极,b为电池的负极,B正确;内电路中,带正电的阳离子移向正极,带负电的阴离子移向负极,因此氢离子从负极移向正极,即从b极移向a极,C错误;放电时,负极上发生氧化反应,失去电子,元素的化合价升高,则b极上反应式为V2+-e-=V3+,D错误。
7.以铁片和铜片为两极,以盐酸为电解质溶液组成的原电池,理论上当导线中通过0.02mol电子时,下列说法正确的是( )。
A.正极溶解0.01molFe
B.负极上析出0.02molH2
C.两极上溶解和析出的物质的质量相等
D.有0.01molFe发生氧化反应
【解析】选D。正极上氢气得电子生成氢气,不是铁溶解,故A错误;负极上铁失电子生成二价铁离子,不是析出氢气,故B错误;负极上铁溶解,正极上析出氢气,通过的电子数相等,溶解铁和析出氢气的物质的量相等,因为铁和氢气的摩尔质量不同,导致溶解的铁和析出的氢气的质量不同,故C错误;负极上发生的电极反应式为Fe-2e-=Fe2+,n(Fe)=n(e-)=×0.02mol=0.01mol,当导线中通过0.02mol电子时有0.01molFe发生氧化反应,故D正确。
8.某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号
电极材料
电解质溶液
电流表指针偏转方向
1
Al、Mg
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、C(石墨)
稀盐酸
偏向石墨
4
Al、Mg
氢氧化
钠溶液
偏向Mg
5
Al、Zn
浓硝酸
偏向Al
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同?____(填“是”或“否”)。
(2)由实验3完成下列填空:
①铝为_____极,电极反应式:___________________;
②石墨为_____极,电极反应式:________________;
③电池总反应式:____________________________。
(3)实验4中铝作负极还是正极?_____,理由是____________________________________。写出铝电极的电极反应式:______________________________。
(4)解释实验5中电流表指针偏向铝的原因:_________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:______________。
【解析】在稀盐酸中的活动性:Mg>Al>Cu。由实验1、2可知,原电池中电流表指针是偏向正极。在实验3中电流表指针偏向石墨,由上述规律可知,Al是负极,石墨是正极,化学反应是Al失去电子被氧化为Al3+,盐酸中的H+得到电子被还原为H2。在NaOH溶液中镁不反应,则Al是负极,Mg是正极。Al在浓硝酸中发生钝化,Zn在浓硝酸中被氧化,即在浓硝酸中Zn是负极,Al是正极,所以在实验5中电流表指针偏向铝。
【答案】(1)否(2)①负;2Al-6e-=2Al3+
②正;6H++6e-=3H2↑
③2Al+6H+=2Al3++3H2↑
(3)负极;Al与NaOH溶液自发进行氧化还原反应,而Mg与NaOH溶液不反应;Al-3e-+4OH-=AlO2-+2H2O
(4)Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,Al是原电池的正极
(5)①另一个电极材料的活动性;②电解质溶液
相关试卷
这是一份【同步讲义】高中化学(人教版2019)选修第二册--第09讲:氢键、溶解性、分子的手性 讲义,文件包含第09讲氢键溶解性分子的手性学生版docx、第09讲氢键溶解性分子的手性教师版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
这是一份【同步讲义】高中化学(人教版2019)必修第二册--第18讲 乙酸 讲义,文件包含同步讲义高中化学人教版2019必修第二册--第18讲乙酸学生版docx、同步讲义高中化学人教版2019必修第二册--第18讲乙酸教师版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
这是一份【同步讲义】高中化学(人教版2019)必修第二册--第17讲 乙醇 讲义,文件包含同步讲义高中化学人教版2019必修第二册--第17讲乙醇学生版docx、同步讲义高中化学人教版2019必修第二册--第17讲乙醇教师版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。










