




所属成套资源:【同步讲义】高中化学(苏教版2019)选修第一册-同步讲义+知识点清单
高中化学苏教版 (2019)选择性必修1第二单元 溶液的酸碱性精品课后作业题
展开
这是一份高中化学苏教版 (2019)选择性必修1第二单元 溶液的酸碱性精品课后作业题,文件包含同步讲义高中化学苏教版2019选修第一册--321溶液的酸碱性学生版docx、同步讲义高中化学苏教版2019选修第一册--321溶液的酸碱性教师版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
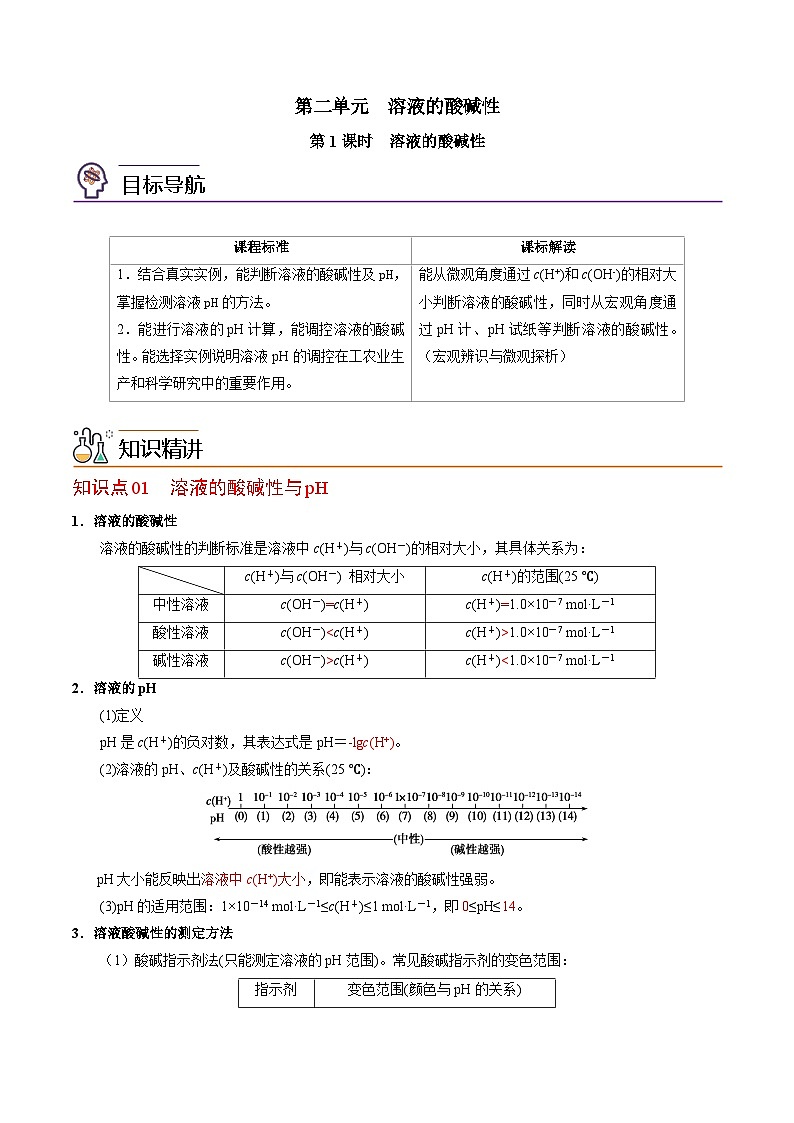
第二单元 溶液的酸碱性第1课时 溶液的酸碱性 课程标准课标解读1.结合真实实例,能判断溶液的酸碱性及pH,掌握检测溶液pH的方法。2.能进行溶液的pH计算,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。能从微观角度通过c(H+)和c(OH-)的相对大小判断溶液的酸碱性,同时从宏观角度通过pH计、pH试纸等判断溶液的酸碱性。(宏观辨识与微观探析) 知识点01 溶液的酸碱性与pH1.溶液的酸碱性溶液的酸碱性的判断标准是溶液中c(H+)与c(OH-)的相对大小,其具体关系为: c(H+)与c(OH-) 相对大小c(H+)的范围(25 ℃)中性溶液c(OH-)____c(H+)c(H+) ____1.0×10-7 mol·L-1酸性溶液c(OH-) ____c(H+)c(H+)____1.0×10-7 mol·L-1碱性溶液c(OH-) ____c(H+)c(H+) ____1.0×10-7 mol·L-12.溶液的pH(1)定义pH是c(H+)的负对数,其表达式是pH=________。(2)溶液的pH、c(H+)及酸碱性的关系(25 ℃):pH大小能反映出________________,即能表示溶液的酸碱性强弱。(3)pH的适用范围:1×10-14 mol·L-1≤c(H+)≤1 mol·L-1,即____≤pH≤____。3.溶液酸碱性的测定方法(1)酸碱指示剂法(只能测定溶液的pH范围)。常见酸碱指示剂的变色范围:指示剂变色范围(颜色与pH的关系)石蕊红色←5.0紫色8.0→蓝色酚酞无色←8.2粉红色10.0→红色甲基橙红色←3.1橙色4.4→黄色(2)利用pH试纸测定,使用的正确操作为____________________________________________________________________________________________________________________。(3)利用pH计测定,仪器pH计可精确测定试液的pH(读至小数点后2位)。【即学即练1】25 ℃的下列溶液中,碱性最强的是( )A.pH=11的溶液B.c(OH-)=0.12 mol·L-1的溶液C.含有4 g NaOH的1 L溶液D.c(H+)=1×10-10 mol·L-1的溶液 知识点02 溶液pH的计算1.酸溶液稀释后的pH的计算(1)25℃时,pH=2的盐酸,若加水稀释10倍,其pH为____;若加水稀释10n倍,其pH为________。(2)25℃时,若将pH=5的盐酸加水稀释103倍,其pH____________。(3)25℃时,pH=2的醋酸(一元弱酸)溶液,加水稀释10倍,其pH大小范围应是________。2.碱溶液稀释后的pH的计算(1) 25℃时,pH=11的氢氧化钠溶液,若加水稀释10倍,其pH为____;若加水稀释10n倍,其pH为_________。(2)25℃时,pH=11的氨水,若加水稀释10n倍,其pH大小范围应是________________;若无限稀释时,其pH____________。3.酸、碱溶液混合后pH的计算方法(1)25℃时,pH=2的盐酸与pH=4的盐酸,若按1∶10的体积比混合后,溶液的c(H+)为____________,pH为____;若等体积混合后,溶液的pH为____。(2) 25℃时,将200 mL 5×10-3 mol·L-1 NaOH溶液与100 mL 2×10-2 mol·L-1 NaOH溶液混合后,溶液的c(OH-)为____________,c(H+)为____________,pH为____。(3) 25℃时,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为____;若按9∶11的体积比混合后,溶液的pH为____;若按11∶9的体积比混合后,溶液的pH为____。【即学即练2】计算溶液的pH:(1)常温下pH均为2的稀盐酸与稀硫酸等体积混合后,pH=______。(2)常温下pH均为3的稀盐酸与醋酸等体积混合后,pH=______。(3)常温下,将pH=8和pH=10的两种强碱溶液等体积混合,溶液的pH是________。 考法01 溶液酸碱性的判断1.根本依据用c(H+)、c(OH-)的相对大小来判断溶液酸碱性,则不受温度影响。c(H+)>c(OH-) 溶液呈酸性;c(H+)=c(OH-) 溶液呈中性;c(H+)<c(OH-) 溶液呈碱性。2.常用依据25 ℃时溶液的pH与酸碱性的关系pH>7,表示溶液呈碱性,pH越大,溶液的碱性越强,pH每增加1个单位,溶液的c(OH-)增大到原来的10倍。pH=7,溶液呈中性。pH<7,表示溶液呈酸性,pH越小,溶液酸性越强,pH每减小1个单位,溶液的c(H+)增大到原来的10倍。3.其他依据使用酸碱指示剂进行判断,要注意指示剂的变色范围。使甲基橙变红的溶液呈酸性;使石蕊变红的溶液呈酸性;使酚酞变红的溶液呈碱性。【典例1】下列溶液一定呈中性的是( )A.由非电解质溶于水得到的溶液B.c(OH-)、c(H+)均为5.0×10-7 mol·L-1的溶液C.等物质的量的强酸与强碱反应得到的溶液D.将c(OH-)=10-5 mol·L-1的烧碱溶液稀释到原来的100倍所得到的溶液 考法02 酸、碱溶液稀释后的pH变化规律1.强酸或弱酸溶液的稀释问题(1)对于pH=a的强酸溶液,每稀释10n倍,强酸的pH就增大n个单位,即pH=a+n(其中a+n<7);(2)对于pH=a的弱酸溶液,由于稀释过程中,弱酸还会继续电离,故弱酸的pH范围是a<pH<a+n(其中a+n<7);(3)酸溶液无限稀释,pH只能无限接近于7,不能大于7。如图Ⅰ所示。2.强碱或弱碱溶液的稀释问题(1)对于pH=b的强碱溶液,每稀释10n倍,强碱的pH减小n个单位,即pH=b-n(其中b-n>7);(2)对于pH=b的弱碱溶液,由于稀释过程中,弱碱还会继续电离,故弱碱的pH范围是b-n<pH<b(其中b-n>7);(3)碱溶液无限稀释,pH只能无限接近于7,不能小于7。如图Ⅱ所示。【典例2】在25 ℃的条件下,将体积都为10 mL、pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积为( )A.a=b=1000 mL B.a=b>1000 mLC.a<b D.a>b 考法03 酸、碱溶液混合后pH计算方法1.强酸与强酸混合先计算:c(H+)混=,然后再求pH。2.强碱与强碱混合先计算:c(OH-)混=,再求c(H+)混=,最后求pH。3.强酸与强碱混合(1)恰好完全反应,溶液呈中性,pH=7。(2)若酸过量:先求c(H+)余=,再求pH。(3)若碱过量:先求c(OH-)余=,再求c(H+)=,然后求pH。【典例3】pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是( )A.11∶1 B.9∶1 C.1∶11 D.1∶9 题组A 基础过关练1.下列说法正确的是( )A.pH=0的溶液不存在B.使用广范pH试纸测得某溶液的pH=3.5C.中性溶液的pH不一定等于7D.Kw=10-14适用于任何温度、任何溶液2.将pH试纸用蒸馏水润湿后测定某溶液的pH,测定结果( )A.一定偏高 B.一定偏低C.可能无影响 D.无影响3.25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,则下列说法正确的是( )A.该溶液的pH一定为9 B.该溶液的pH可能为5C.该溶液的pH可能为7 D.不会有这样的溶液4.下列溶液一定显酸性的是( )A.含H+的溶液 B.c(OH-)<c(H+)的溶液C.pH<7的溶液 D.能与金属Al反应放出H2的溶液5.下列溶液一定呈中性的是( )A.pH=7的溶液B.c(H+)=c(OH-)的溶液C.由强酸、强碱等物质的量反应得到的溶液D.非电解质溶于水得到的溶液6.下列酸溶液的pH相同时,其物质的量浓度最小的是( )A.H2SO3 B.H2SO4 C.CH3COOH D.HNO37.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )A.相同浓度的两溶液中c(H+)相同B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠C.pH=3的两溶液稀释100倍,pH都为5D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小8.下列叙述正确的是( )A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)×c(OH-)=1×10-14B.c(H+)等于1×10-7 mol·L-1的溶液一定是中性溶液C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍D.任何浓度的溶液都可以用pH来表示其酸性的强弱9.恒温条件下,向蒸馏水中滴入少量盐酸后,下列说法正确的是( )A.c(H+)·c(OH-)不变 B.c(OH-)增大C.水的电离程度增大 D.水电离出的c(H+)增大10.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )A.0.1 mol·L-1的盐酸和0.1 mol·L-1的氢氧化钠溶液B.0.1 mol·L-1的盐酸和0.05 mol·L-1的氢氧化钡溶液C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液D.pH=4的盐酸和pH=10的氨水11.在不同温度下的水溶液中c(H+)与c(OH-)的关系如图所示。请回答下列问题:(1)曲线Ⅰ代表的温度下,水的离子积为________,曲线Ⅰ所代表的温度________(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是___________________________________________。(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液的pH为________。12.有pH=12的NaOH溶液100 mL,要使它的pH降为11。(1)若加入蒸馏水,应加________mL;(2)若加入pH为10的NaOH溶液,应加________mL;(3)若加入0.01 mol·L-1 的盐酸,应加________mL。 题组B 能力提升练1.常温下,pH=11的X、Y两种碱溶液各1 mL,分别稀释到100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )A.X、Y两种碱溶液中溶质的物质的量浓度一定相等B.稀释后,X溶液的碱性比Y溶液的碱性强C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积V(X)>V(Y)D.若9<a<11,则X、Y都是弱碱2.某温度下,重水(D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD=-lg c(D+),则在该温度下,下列叙述正确的是( )A.纯净的重水中,c(D+)·c(OD-)>1.0×10-14B.1 L溶解有0.01 mol DCl的重水溶液,其pD=2C.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12D.纯净的重水中,pD=73.某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。据图判断正确的是( )A.Ⅱ为盐酸稀释时的pH变化曲线B.b点溶液的导电性比c点溶液的导电性强C.a点KW的数值比c点KW的数值大D.b点酸的总浓度大于a点酸的总浓度4.现有常温下的六份溶液:①0.01 mol·L-1 CH3COOH溶液②0.01 mol·L-1盐酸③pH=12的氨水④pH=12的NaOH溶液⑤0.01 mol·L-1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液⑥0.01 mol·L-1盐酸与pH=12的NaOH溶液等体积混合后所得溶液(1)其中水的电离程度最大的是______(填序号,下同),水的电离程度相同的是______。(2)若将②③混合后所得溶液pH=7,则消耗溶液的体积②________(填“>”“<”或“=”)③。(3)将六份溶液同等稀释10倍后,溶液的pH:①______②,③______④,⑤______⑥(填“>”“<”或“=”)。5.(1)某温度(t ℃)时,水的Kw=1×10-12,则该温度____(填“>”“<”或“=”)25 ℃,其理由是____________________________________________________________________。(2)该温度下,c(H+)=1×10-7 mol·L-1的溶液呈______(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________mol·L-1。 题组C 培优拔尖练1.甲、乙两种醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列叙述正确的是( )A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍B.中和等物质的量的NaOH,需甲、乙两种醋酸溶液的体积,10V(甲)>V(乙)C.物质的量浓度c(甲)>10c(乙)D.甲中的c(OH-)为乙中的c(OH-)的10倍2.醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+ ΔH>0。(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)3.(1)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=__________。(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。4.下表是不同温度下水的离子积数据:温度/℃25t1t2水的离子积Kw1×10-14a1×10-12试回答以下问题:(1)若25<t1<t2,则a________(填“>”“<”或“=”)1×10-14。(2)25 ℃时,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。(3)在t2 ℃,pH=10的NaOH溶液中,水电离产生的OH-浓度为______________。(4)在t2 ℃下,其溶液的pH=7,则该溶液________(填字母)。a.呈中性 b.呈碱性 c.呈酸性 d.c(OH-)=100c(H+)
相关试卷
这是一份【同步讲义】高中化学(鲁科版2019)选修第一册--第15讲 水溶液的酸碱性与pH 讲义,文件包含同步讲义高中化学鲁科版2019选修第一册--第15讲水溶液的酸碱性与pH学生版docx、同步讲义高中化学鲁科版2019选修第一册--第15讲水溶液的酸碱性与pH教师版docx等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。
这是一份【同步讲义】高中化学(苏教版2019)选修第三册--3.2.1 苯的结构和性质 讲义,文件包含同步讲义高中化学苏教版2019选修第三册--321苯的结构和性质学生版docx、同步讲义高中化学苏教版2019选修第三册--321苯的结构和性质教师版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
这是一份【同步讲义】高中化学(苏教版2019)选修第一册--3.3.1 盐类水解的原理 讲义,文件包含同步讲义高中化学苏教版2019选修第一册--331盐类水解的原理学生版docx、同步讲义高中化学苏教版2019选修第一册--331盐类水解的原理教师版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。









