
2024湖北省部分学校高三上学期8月起点考试化学试题含答案
展开2024届湖北省部分学校高三上学期8月起点24-03c考试
化学试卷
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H1 C12 O16 Na23 Zn65 Ge73 Se79
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.湖北是楚文化的发源地,下列文物的主要成分属于金属材料的是
2.化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言。下列化学用语使用错误的是
A.乙烷的球棍模型: B.乙烯分子中的π键:
C. HCIO的电子式: D.质子数为78,中子数为124的铂(Pt)的原子符号:
3.茶叶中铁元素的检验可经过以下四步完成:
①干茶叶灼烧灰化;②将茶叶灰用6 mol·L-1 HNO3溶液溶解;③过滤,得澄清溶液;④滴加试剂检测滤液中的铁元素。
上述操作中,未用到的仪器为
4.类比是学习化学的重要方法,下列类比结果合理的是
5.向含HCN的废水中加入铁粉和K2CO3可制备K4[Fe(CN)6],发生反应: 6HCN+ Fe+2K2CO3 =K4[Fe(CN)6]+ H2↑+2CO2↑+ 2H2O,下列说法正确的是
A. HCN的VSEPR模型为四面体形
B.基态碳原子和基态氮原子的未成对电子数之比为3:2
C.CO2和H2O均为含有极性键的非极性分子
D. HCN和CO2的中心原子C采用的杂化方式相同
6.从不同的视角对化学反应进行探究、分析,以下观点中错误的是
A.将TiCl4加人水中并加热使其转化为TiO2·xH2O
B. NaHCO3溶液显碱性的原因: HCO3- +H2OCO32- 十H3O+
C.乙烯聚合为聚乙烯的反应是熵减的过程,却能够自发进行,可知该反应的△H<0
D.难溶电解质在水中达到溶解平衡时,再加入相同难溶电解质,溶液中各离子浓度不变
7. FeCl3(易升华)是常见的化学试剂,可通过下列实验制备FeCl3,下列说法中错误的是
A.装置F的作用是尾气吸收,并防止空气中的水蒸气进入收集器
B.硬质玻璃管直接连接收集器的优点是不易因为FeCl3固体积聚而造成堵塞
C.实验室配制FeCl3溶液时应先将FeCl3固体溶于少量盐酸,再加水稀释
D.实验开始时,应先点燃D处酒精灯,后点燃A处酒精灯
8. X、Y、Z、W为原子序数依次增大的四种短周期元素,已知Z、W元素的原子序数之和是X、Y元素的原子序数之和的3倍,且Z、W元素是同主族元素。甲、乙、丙、丁、戊五种二元化合物的组成如下表:
物质间存在反应:甲十乙一→单质Y+丙;丁十戊一→单质 W(淡黄色固体)十丙。下列说法正确的是
A.甲、丙、丁均为极性分子 B.电负性:Y>Z>W
C.可用酒精洗涤粘在容器内壁上的单质W D.化合物乙一定为无色无味的气体
9.NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温下,pH=5的NH4NO3溶液中,水电离出的H+数为10-5NA
B.标准状况下,22.4 L由C2H4和C3H6组成的混合物中含有的碳碳双键数一定为NA
C.2.3g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
D.0.1 mol CH4与0.1 mol Cl2在光照下充分反应生成的HCl分子数为0.1NA
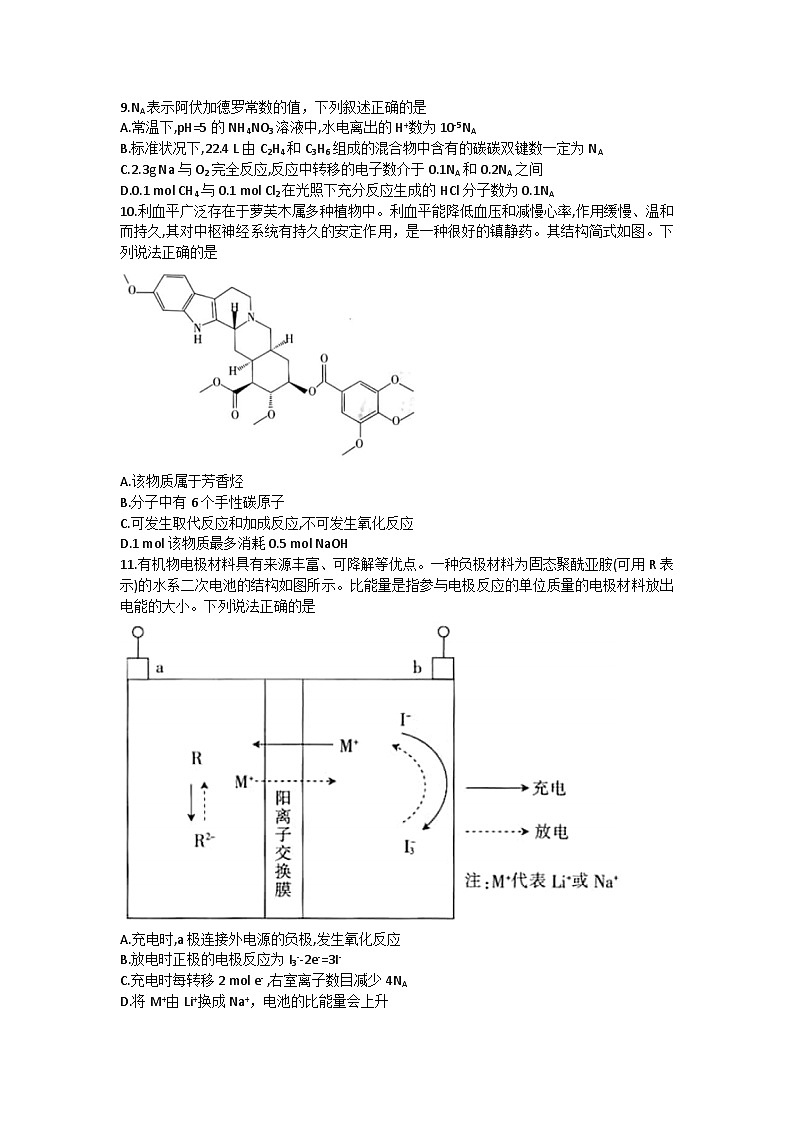
10.利血平广泛存在于萝芙木属多种植物中。利血平能降低血压和减慢心率,作用缓慢、温和而持久,其对中枢神经系统有持久的安定作用,是一种很好的镇静药。其结构简式如图。下列说法正确的是
A.该物质属于芳香烃
B.分子中有6个手性碳原子
C.可发生取代反应和加成反应,不可发生氧化反应
D.1 mol该物质最多消耗0.5 mol NaOH
11.有机物电极材料具有来源丰富、可降解等优点。一种负极材料为固态聚酰亚胺(可用R表
示)的水系二次电池的结构如图所示。比能量是指参与电极反应的单位质量的电极材料放出电能的大小。下列说法正确的是
A.充电时,a极连接外电源的负极,发生氧化反应
B.放电时正极的电极反应为I3--2e-=3I-
C.充电时每转移2 mol e- ,右室离子数目减少4NA
D.将M+由Li+换成Na+,电池的比能量会上升
12.已知Mn的原子序数为25,某种Mn3+的配合物的结构如图所示(R为烷基),则下列说法错误的是
A.该配合物中C的杂化方式有3种 B.1 mol该配合物中配位键有2 mol
C.Mn属于d区元素 D. Mn的价电子排布式为3d54s2
13.下列实验操作、现象和结论(或解释),均正确的是
14.硒化锌,化学式为ZnSe,为黄色结晶性粉末,不溶于水,主要用于制造透红外线材料及红外线光学仪器。其晶胞结构如图所示,晶胞边长为a pm。下列关于硒化锌晶胞的描述错误的是
A.相邻的Se与Zn之间的距离为a pm
B.与Se距离最近且相等的Se有8个
C.已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标为(,,)
D.若硒化锌晶体的密度为ρg·cm-3 ,则阿伏加德罗常数NA= mol-1
15.某温度下,分别向10. 00 mI.0.1 mol·L-1的KCI和K2CrO4溶液中滴加0.1 mol·L-1AgNO3溶液,滴加过程中-lg c(M)(M为CI-或CrO42-)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。已知铬酸银是深红色晶体,下列说法正确的是
A.该温度下,Ksp(Ag2CrO4)=4.0X10-9.8
B.曲线L2表示-lg c(Cl- )与V(AgNO3)的变化关系
C. P点溶液中:c(K+ )>c(NO3-)>c(Ag+ )>c(H+ )>c(OH-)
D.若向等浓度的KCl和K2CrO4的混合溶液中滴加硝酸银溶液,则先出现白色沉淀.
二、非选择题:本题共4小题,共55分。
16.(13分)镍铼高温合金可用于制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴。NH4ReO4
是制备高纯度Re的原料.实验室制备NH4ReO4的装置如图所示。
已知: I. KReO4、与H2S反应生成Re2Sn7 ;
II. 2NH4ReO4+7H2=2Re+ 2NH3 + 8H2O。
有关物质的溶解度S见下表:
回答下列问题:
(1)金属铼具有良好的导电、导热性和延展性,可用于解释这--现象的理论是_ 。
(2)仪器a的名称是_ .
(3)反应开始前先向仪器a中加入一定量的KReO4溶液,再通入一定量的H2S,反应一段时间,仪器a内生成Re2S7,然后滴入足量的H2O2的氨水溶液,生成NH4ReO4,同时有硫酸铵生成;写出生成NH4ReO4的化学方程式:______ , 反应结束后从溶液中分离出NH4ReO4的方法是_ 。
(4)氢气还原NH4ReO4制备金属铼时,在加热前,需先通入一段时间的氢气,其目的是_
。实验室制取氢气时,常用粗锌粒而不用纯锌,其原因是_ _。
(5)铼可形成多种配位化合物, Re2 (CO)10就是其中的一种,其结构如图,其中配位原子为
(填“C"或“O")。
17.(14分)商务部、海关总署在官网发布公告称,决定对镓、锗相关物项实施出口管制。锗,天然的优良半导体,在光纤通信、红外光学、太阳能电池、核物理探测等领域应用颇多。工业
上利用锗锌矿(主要成分为GeO2和ZnS,还含少量Fe2O3 )来制备高纯度锗的流程如图。
已知:①GeCl4的熔点为-49.5℃ ,沸点为84℃,其在水中或酸的稀溶液中易水解。
②GeO2可溶于强碱溶液,生成锗酸盐。
(1)在元素周期表中,Ge、As、Se位于同一周期,则基态原子的第一电离能由大到小的顺序是_ 。
(2)硅和锗与氯元素都能形成氯化物RCL(R代表Si和Ge),从原子结构角度解释原因:
。
(3)“滤渣II”中除含有MgGeO3外,还含有少量_ (填化学式)。
(4)GeCl4中加水反应的离子方程式是_ 。
(5)固态GeCl4为 晶体,“操作III”分离获得GeCl4所使用的装置为 (填标号)。
根据选择,提出改进的方法:______ (若不需要改进,此空填“不需要")。
(6)Ge单晶的晶胞结构类似于金刚石,如图。已知Ge单晶的晶胞边长为a pm,设NA为阿伏加德罗常数的值,Ge单晶的密度为 g·cm-3.
18.(14分)有机物H是合成药物的重要中间体,其合成路线如图:
(1)有机物B分子中含有的官能团的名称为 。
(2)C→D 的反应中,有机物C的碳碳 (填“”或“σ")键断裂。
(3)可用于检验A中含氧官能团的试剂是 (填标号)。
A.溴水 B.新制的氢氧化铜 C.高锰酸钾溶液
(4)在中S原子采用的杂化方式为 。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有_
种(不考虑立体异构)。
①含有六元环 ②能发生银镜反应
(6)已知:, B在碱性溶液中易发生分子内缩合从而构建双环结构而生成C和其他的副产物,写出其中含有四元碳环的副产物的结构简式: 、 (任写两种)。
19.(14分)深人研究含碳、氮元素的物质转化有着重要的实际意义。
I.(1)NH3是重要的配体,其中H—N—H的键角为107°。
①NH3分子的VSEPR模型为 。
②[Cu(NH3)4]2+中H—N—H的键角__ (填“大于”、“小于”或“等于”)107°。
③甲基胺离子(CH3NH3+)的电子式为 。
II.一定条件下,用CH4催化还原可消除NO污染。
已知:①CH4(g) + 2NO2(g)N2(g) +CO2(g)+2H2O(g)△H=-865. 0 kJ·mol-1
②2NO(g) +O2(g)2NO2(g) △H= - 112.5 kJ·mol-1
(2)N2和O2完全反应,每生成2.24 L(标准状况)NO时,吸收8.9 kJ的热量;则CH4(g)+ 4NO(g)2N2(g)+CO2(g) +2H2O(g) △H=_ kJ·mol-1。
(3)汽车尾气中的氮氧化物亦可用如下反应处理:2NO(g) +2CO(g)N2(g) +2CO2(g)
△H= -746.8kJ·mol-1.实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数_ (填“>”、“<”或“=”)逆增大的倍数。
III.CO2转化为高附加值化学品成为科学家研究的重要课题。
(4)CH4—CO)重整技术是一种理想的CO2利用技术,反应为CO2(g) +CH4(g)2CO(g)+2H2(g)。在p MPa时,将CO2和CH4按物质的量之比1 : 1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是_ 。
②在p MPa、T°C、ZrO2催化条件下(保持温度和压强不变) ,将CO2、CH4、H2O按物质的量之比1 : 1 : n充入密闭容器中,CO2的平衡转化率为,此时平衡常数Kp= _
MPa2 (以分压表示,分压=总压X物质的量分数;写出含、n、p的计算表达式)。
2024湖北省部分名校高三上学期新起点8月联考化学试题PDF版含答案: 这是一份2024湖北省部分名校高三上学期新起点8月联考化学试题PDF版含答案,共13页。
2022武汉部分学校高三上学期起点质量检测化学试题含答案: 这是一份2022武汉部分学校高三上学期起点质量检测化学试题含答案,文件包含武汉市2022届高中毕业生起点考试化学参考答案pdf、湖北省武汉市部分学校2022届高三上学期起点质量检测化学试题word含答案docx等2份试卷配套教学资源,其中试卷共16页, 欢迎下载使用。
2022武汉部分学校高三上学期起点质量检测化学试题扫描版含答案: 这是一份2022武汉部分学校高三上学期起点质量检测化学试题扫描版含答案,文件包含化学答题卡-曲线pdf、武汉市2022届高中毕业生起点考试化学参考答案1pdf等2份试卷配套教学资源,其中试卷共4页, 欢迎下载使用。












