
吉林省白山市六所盟校2022-2023年高二下学期期未联考化学试题(原卷版+解析版)
展开
这是一份吉林省白山市六所盟校2022-2023年高二下学期期未联考化学试题(原卷版+解析版),共35页。试卷主要包含了可能用到的相对原子质量, 设为阿伏加德罗常数的值等内容,欢迎下载使用。
白山市六所盟校2022-2023年高二下学期期未联考
化学试卷
本试卷满分100分,考试用时100分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Lu-175
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与人们的生产、生活紧密联系。下列对应的化学解读正确的是
A.石墨烯中碳原子存在两种杂化类型
B.冰雪融化时,断开了极性共价键
C.与原子核外电子跃迁释放能量有关
D.干冰是共价晶体
A. A B. B C. C D. D
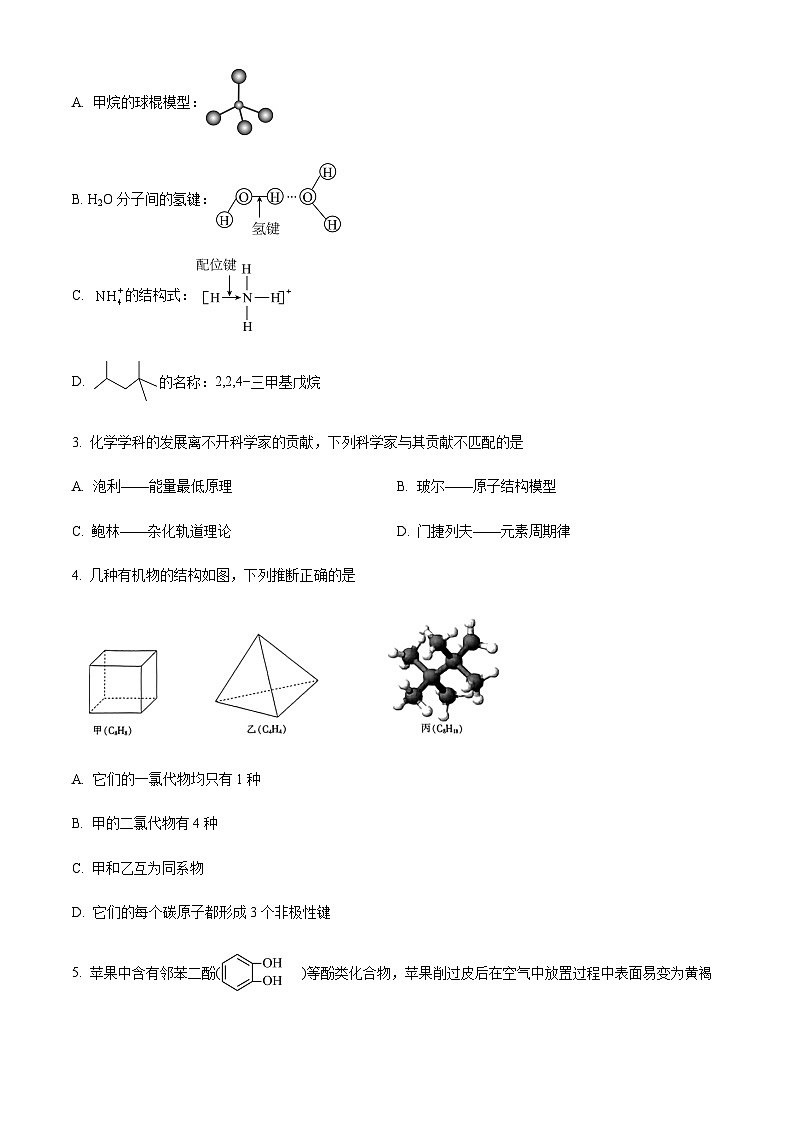
2. 下列物质的化学用语表达正确的是
A. 甲烷的球棍模型:
B. H2O分子间的氢键:
C. 的结构式:
D. 的名称:2,2,4−三甲基戊烷
3. 化学学科的发展离不开科学家的贡献,下列科学家与其贡献不匹配的是
A. 泡利——能量最低原理 B. 玻尔——原子结构模型
C. 鲍林——杂化轨道理论 D. 门捷列夫——元素周期律
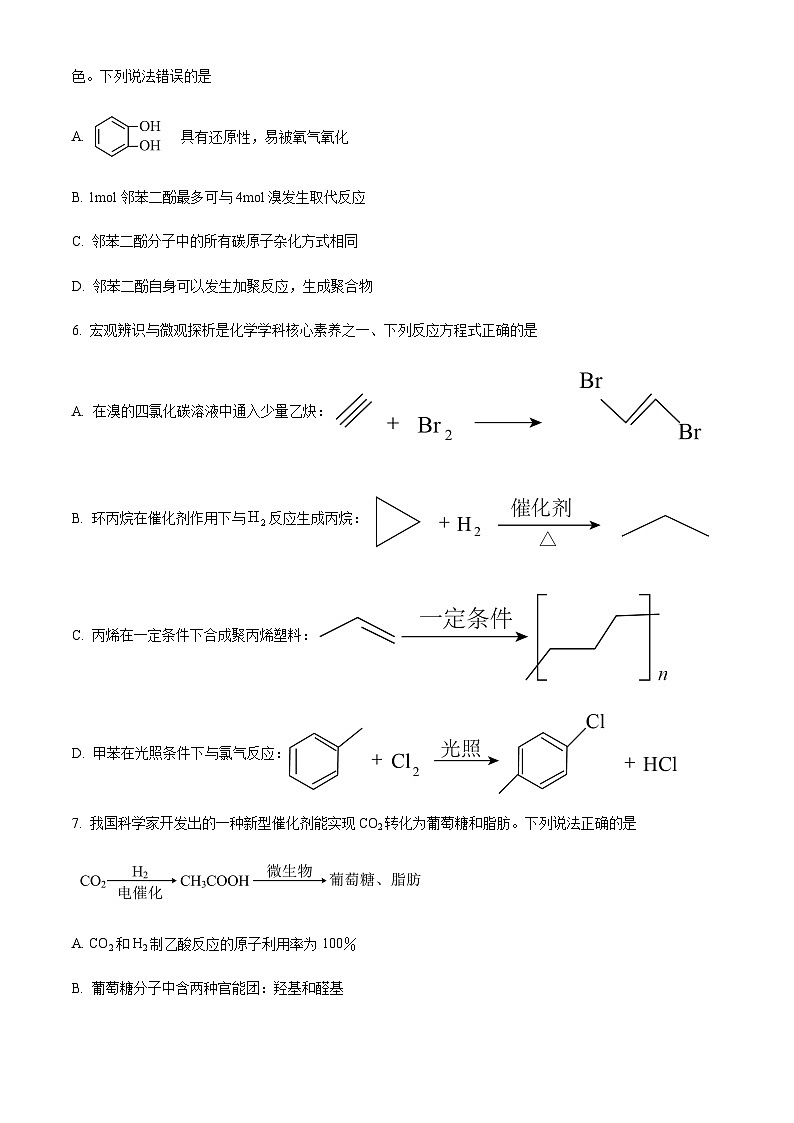
4. 几种有机物的结构如图,下列推断正确的是
A. 它们的一氯代物均只有1种
B. 甲的二氯代物有4种
C. 甲和乙互为同系物
D. 它们的每个碳原子都形成3个非极性键
5. 苹果中含有邻苯二酚( )等酚类化合物,苹果削过皮后在空气中放置过程中表面易变为黄褐色。下列说法错误的是
A. 具有还原性,易被氧气氧化
B. 1mol邻苯二酚最多可与4mol溴发生取代反应
C. 邻苯二酚分子中的所有碳原子杂化方式相同
D. 邻苯二酚自身可以发生加聚反应,生成聚合物
6. 宏观辨识与微观探析是化学学科核心素养之一、下列反应方程式正确的是
A. 在溴的四氯化碳溶液中通入少量乙炔:
B. 环丙烷在催化剂作用下与反应生成丙烷:
C. 丙烯在一定条件下合成聚丙烯塑料:
D. 甲苯在光照条件下与氯气反应:
7. 我国科学家开发出的一种新型催化剂能实现CO2转化为葡萄糖和脂肪。下列说法正确的是
A. CO2和H2制乙酸反应的原子利用率为100%
B. 葡萄糖分子中含两种官能团:羟基和醛基
C. 脂肪高分子化合物
D. 葡萄糖和脂肪在一定条件下都能发生水解反应
8. 下列关于原子结构及元素周期表的说法错误的是
A. 所含元素种类最多族是第ⅢB族
B. 同一原子中,2p、3p、4p能级的能量依次升高
C. 在元素周期表中,ds区只有6种自然形成的元素,且均为金属元素
D. 基态原子价层电子排布式为ns2的元素一定是第IIA族元素(n为周期数)
9. 设为阿伏加德罗常数的值。一种抗癌新药的活性成分MI-888的结构如图所示。下列叙述正确的是
A. 1molMI-888中卤素原子数为
B. 1molMI-888中碳碳双键数为
C. MI-888中共有3种官能团
D. MI—888分子中,苯环上的一溴代物有3种
10. 中南民族大学某课题组开发催化剂高效催化碳水化合物转化为有机酸和呋喃化学品(如图所示)。下列叙述正确的是
A. 图中只有1种有机物能发生银镜反应
B. 图中含3种官能团有机物有2种
C. 图中有机物中的C原子同时采取、杂化的有机物有6种
D. 图中属于二元羧酸的有机物有6种
11. 甘氨酸(结构如图)常作食品的调味剂,还可预防氧化、延缓衰老等。甘氨酸与酸反应生成阳离子(用表示)。甘氨酸聚合成多肽,生成水分子。调节甘氨酸溶液的pH,当净电荷等于0时称为等电点,此时,。下列叙述错误的是
A. 甘氨酸是蛋白质水解的最终产物之一
B. 甘氨酸是两性化合物
C. 甘氨酸溶液调pH后,在等电点时显中性
D. 当n=m+1时合成的肽为肽链
12. 某有机物M对H2的相对密度为30,M分子中各元素的质量分数:碳40.0%,氢6.6%,氧53.4%。该有机物能与钠反应,又能与银氨溶液共热产生银镜。M的结构简式可能是
A. HOCH2CH2CHO B. HCOOCH3
C. HOCH2CHO D. CH3OCHO
13. 乙酸异戊酯天然存在于香蕉、苹果等水果和浆果中,具有香蕉香味。某化学兴趣小组在实验室中利用乙酸和异戊醇( )制备乙酸异戊酯,实验装置如图1所示(加热及夹持仪器略),相关物质的部分性质如表所示。
物质
密度/()
沸点/℃
水中溶解度
异戊醇
0.809
132
微溶
乙酸
l.049
118
易溶
乙酸异戊酯
0.876
142.5
微溶
下列说法错误的是
A. 异戊醇的同分异构体中,与其含有相同官能团的结构有7种
B. 实验中浓硫酸只起到催化作用和脱水作用
C. 图1中的装置可用图2所示装置代替
D. 实验中加入过量的异戊醇可提高乙酸的转化率
14. 下列有关物质结构与性质的论述错误的是
A. “电子气理论”用于描述金属键的本质,可用于解释金属晶体的延展性、导电性和导热性
B. 中S的孤电子对数为0,空间结构是平面三角形
C. O的电负性比C大,则配合物中配位原子是碳原子
D. 除稀有气体单质外,其他气态单质分子中都含有σ键,可能含有π键
15. 化学是以实验为基础的科学,下列实验操作或做法能达到实验目的的是
选项
实验操作或做法
目的
A
将稀盐酸与碳酸钙反应产生的气体直接通入溶液中
验证酸性:
B
向洁净的试管中滴入10~15滴溴乙烷和5mL5%的溶液,振荡后加热,静置。待溶液分层后,取少量上层溶液,滴加2滴溶液,观察现象
检验溴乙烷中的溴
C
在洁净的试管中加入1mL2%的溶液,然后边振荡试管边逐滴滴入2%的氨水,使最初产生的沉淀溶解,再滴入3滴乙醛,振荡后将试管放在热水浴中温热
检验醛基
D
在试管中加入1mL淀粉溶液和2mL10%的溶液,加热煮沸,加入新制,加热并煮沸
检验淀粉水解产物
A. A B. B C. C D. D
二、非选择题:本题共4小题,共55分。
16. 第三周期几种氧化物(不包括过氧化物和超氧化物)的离子键成分的百分数如图所示。回答下列问题:
(1)离子键成分的百分数最高的是_______(填化学式)。
(2)MgO的熔点_______(填“高于”或“低于”)Na2O,原因是_______。
(3)根据图示推知,第三周期主族元素最高价氧化物中离子键成分的百分数最低的是_______(填化学式),下列化合物中离子键成分的百分数最高的是_______(填标号)。
A.CsF B.LiCl C.CaO D.AlBr3
(4)NaCl晶胞结构如图所示,设晶胞的边长为apm,NA为阿伏加德罗常数的值。
①1个NaCl晶胞的质量为_______g。
②与Cl—最近且等距离的Na+数为_______。
③阳离子填充在阴离子构成的_______(填标号)空隙中。
A.正八面体 B.正四边形
C.正四面体 D.正三角锥形
17. 科学家开发了一种氮掺杂氢化镥(Lu—N—H)材料,在压强下,表现出室温(20℃)超导特性。回答下列问题:
(1)已知基态Lu(镥)原子的价层电子排布式为,它位于元素周期表第___________周期第___________族,有___________个未成对电子。
(2)氮族氢化物中,沸点最低的是___________(填化学式),的沸点高于,其主要原因是___________。
(3)一种新药活性成分的结构简式如图所示。1个该分子含___________个手性碳原子。
(4)含N的分子或离子是常见的配体。例如,雷氏盐的化学式为,其常作分析试剂。
①雷氏盐中阳离子的空间结构为___________,阴离子中配位原子是___________(填元素符号)。
②预测:雷氏盐中阴离子的空间结构最可能是___________(填标号)。
A. B. C. D.
(5)Lu—N—H晶胞如图所示。已知晶胞参数为,代表阿伏加德罗常数的值。在该晶胞中,有___________个Lu原子与H原子等距离且最近。该晶体的密度为___________。
18. 肉桂酸是无公害的环保防腐剂,可直接添加于食品中。某小组设计实验制备肉桂酸并探究其性质:
【原理】
【性质】
物质
苯甲醛
肉桂酸
乙酸酐
沸点
179℃
300℃
140℃
水溶性
微溶于水、无色油状液体
难溶于冷水、易溶于热水
与水反应生成乙酸
【步骤】
【装置】利用图1装置完成步骤①,利用图2装置完成步骤②,抽滤操作用图3装置。
回答下列问题:
(1)R是___________(填结构简式)。
(2)图1中,仪器B的名称是___________,仪器A的作用是___________。实验前,要烘干三颈烧瓶,目的是___________。
(3)完成步骤②,蒸馏的主要目的是分离出过量的苯甲醛,毛细管1与空气相通,其作用是___________(答一条即可)。
(4)相比于普通过滤,图3抽滤主要优点有___________(答一条即可)。
(5)步骤③加入溶液的作用是___________,第二次抽滤得到滤饼的主要成分是___________(填名称)。
(6)设计简单实验证明肉桂酸中含有碳碳双键:___________。
19. 一种荧光探针(E)的合成路线如图:
已知:
(1)A的名称为___________;C中的含氧官能团的名称为___________。
(2)B→C反应的化学方程式为___________。
(3)D→E反应的反应类型为___________,D的结构简式为___________,1molD与足量溶液充分反应,最多可消耗___________mol。
(4)W与X互为同系物且W的碳原子数比X多1,H与W互为同分异构体,则满足下列条件的H的结构有___________种(不考虑立体异构)。
①能与溶液发生显色反应
②可与溶液反应
(5)根据以上信息,写出以和为原料制备
的合成路线流程图___________。(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)白山市六所盟校2022-2023年高二下学期期未联考
化学试卷 答案解析
本试卷满分100分,考试用时100分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Lu-175
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与人们的生产、生活紧密联系。下列对应的化学解读正确的是
A.石墨烯中碳原子存在两种杂化类型
B.冰雪融化时,断开了极性共价键
C.与原子核外电子跃迁释放能量有关
D.干冰是共价晶体
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.石墨烯中的碳原子均为sp2 杂化,A错误;
B.冰雪融化是物理变化,不会断开共价键,克服的是分子间作用力,B错误;
C.烟花的焰色与原子核外电子跃迁释放能量有关,C正确;
D.干冰是分子晶体,D错误。
故选C。
2. 下列物质的化学用语表达正确的是
A. 甲烷的球棍模型:
B. H2O分子间的氢键:
C. 的结构式:
D. 的名称:2,2,4−三甲基戊烷
【答案】D
【解析】
【详解】A.碳原子的半径大于氢原子的半径,因此不是甲烷的球棍模型,故A错误;
B.分子间的氢原子与氧原子之间形成的为氢键,图中“∙∙∙”表示分子间氢键,故B错误;
C.配位键由氮原子提供孤对电子,箭头应由氮原子指向氢原子,故C错误;
D.主链由5个碳原子,有3个支链,其名称:2,2,4−三甲基戊烷,故D正确。
综上所述,答案D。
3. 化学学科的发展离不开科学家的贡献,下列科学家与其贡献不匹配的是
A. 泡利——能量最低原理 B. 玻尔——原子结构模型
C. 鲍林——杂化轨道理论 D. 门捷列夫——元素周期律
【答案】A
【解析】
【详解】泡利提出在一个原子轨道里最多只能容纳2个电子且他们的自旋方向相反,这个原理称为泡利不相容原理,故A错误;
故选:A。
4. 几种有机物的结构如图,下列推断正确的是
A. 它们的一氯代物均只有1种
B. 甲的二氯代物有4种
C. 甲和乙互为同系物
D. 它们每个碳原子都形成3个非极性键
【答案】A
【解析】
【详解】A.甲、乙、丙中均只含一种化学环境的氢原子,故它们的一氯代物均只有1种,A正确;
B.甲的二氯代物:二氯代物中一个氯原子在顶点,另一个氯原子可在与其等距离(边长)的顶点、面对角线顶点、体对角线顶点,共3种,B错误;
C.甲和乙结构不相似,不是同系物,C错误;
D.甲和乙中每个碳原子形成3个非极性键,丙中碳原子有的形成1个非极性键,有的形成4个非极性键,D错误;
故选A。
5. 苹果中含有邻苯二酚( )等酚类化合物,苹果削过皮后在空气中放置过程中表面易变为黄褐色。下列说法错误的是
A. 具有还原性,易被氧气氧化
B. 1mol邻苯二酚最多可与4mol溴发生取代反应
C. 邻苯二酚分子中的所有碳原子杂化方式相同
D. 邻苯二酚自身可以发生加聚反应,生成聚合物
【答案】D
【解析】
【详解】A.苯酚易被空气中氧气氧化, 含有酚羟基,具有还原性,易被氧气氧化,故A正确;
B.苯酚与溴水发生取代反应,取代酚羟基的邻位和对位,因此1mol邻苯二酚最多可与4mol溴发生取代反应,故B正确;
C.邻苯二酚分子中的所有碳原子价层电子对数为3,都为sp2杂化,故C正确;
D.邻苯二酚没有碳碳双键或碳碳三键,因此自身不能发生加聚反应,故D错误。
综上所述,答案为D。
6. 宏观辨识与微观探析是化学学科核心素养之一、下列反应方程式正确的是
A. 在溴的四氯化碳溶液中通入少量乙炔:
B. 环丙烷在催化剂作用下与反应生成丙烷:
C. 丙烯在一定条件下合成聚丙烯塑料:
D. 甲苯在光照条件下与氯气反应:
【答案】B
【解析】
【详解】.在溴的四氯化碳溶液中通入少量乙炔,溴过量,乙炔与溴1:2反应,,A项错误;
B.环丙烷催化加氢反应生成丙烷方程式为: ,B项正确;
C.丙烯在一定条件下合成聚丙烯方程式为:,C项错误;
D.甲苯光照与反应: ,D项错误;
答案选B。
7. 我国科学家开发出的一种新型催化剂能实现CO2转化为葡萄糖和脂肪。下列说法正确的是
A. CO2和H2制乙酸反应的原子利用率为100%
B. 葡萄糖分子中含两种官能团:羟基和醛基
C. 脂肪是高分子化合物
D. 葡萄糖和脂肪在一定条件下都能发生水解反应
【答案】B
【解析】
【详解】A.2CO2+4H2CH3COOH+ 2H2O,反应中有水生成,原子利用率不是100%,故A错误;
B.葡萄糖为单糖,含羟基和醛基两种官能团,故B正确;
C.脂肪属于油脂,不是高分子化合物,故C错误;
D.葡萄糖为单糖,不能发生水解反应,故D错误;
故选:B。
8. 下列关于原子结构及元素周期表说法错误的是
A. 所含元素种类最多的族是第ⅢB族
B. 同一原子中,2p、3p、4p能级的能量依次升高
C. 在元素周期表中,ds区只有6种自然形成的元素,且均为金属元素
D. 基态原子价层电子排布式为ns2的元素一定是第IIA族元素(n为周期数)
【答案】D
【解析】
【详解】A.所含元素种类最多的族是第ⅢB族,共有32种元素,故A正确;
B.同一原子中,能级的能量:2p<3p<4p,因此2p、3p、4p能级的能量依次升高,故B正确;
C.在元素周期表中,ds区只有6种自然形成的元素(4、5、6三个周期,每个周期2种元素共6种),且均为金属元素,故C正确;
D.基态原子价层电子排布式为ns2的元素可能为第IIA族元素(n为周期数),也可能是0族元素(比如He),故D错误。
综上所述,答案为D。
9. 设为阿伏加德罗常数的值。一种抗癌新药的活性成分MI-888的结构如图所示。下列叙述正确的是
A. 1molMI-888中卤素原子数为
B. 1molMI-888中碳碳双键数为
C. MI-888中共有3种官能团
D. MI—888分子中,苯环上的一溴代物有3种
【答案】A
【解析】
【详解】A.根据MI-888的结构可知,1molMI-888中卤素原子数为,A正确;
B.根据MI-888的结构可知,MI-888中不含有碳碳双键,B错误;
C.MI-888中含有氯原子、氟原子、酰胺基、亚氨基、羟基等5种官能团,C错误;
D.MI—888分子中,苯环上有6中等效氢,其一溴代物有6种,D错误;
故选A。
10. 中南民族大学某课题组开发催化剂高效催化碳水化合物转化为有机酸和呋喃化学品(如图所示)。下列叙述正确的是
A. 图中只有1种有机物能发生银镜反应
B. 图中含3种官能团的有机物有2种
C. 图中有机物中的C原子同时采取、杂化的有机物有6种
D. 图中属于二元羧酸的有机物有6种
【答案】B
【解析】
【详解】A.图中e和i中都含有醛基,都能发生银镜反应,故A错误;
B.图中e含有醛基、醚键和碳碳双键,f含有羧基、醚键和碳碳双键,故B正确;
C.有机物中单键碳原子采取杂化,双键碳原子采取杂化,故图中C原子同时采取、杂化的有机物有a、b、c、d、g共5种,故C错误;
D.图中属于二元羧酸的有a、c、d、f、h有机物有5种,故D错误;
故选B。
11. 甘氨酸(结构如图)常作食品的调味剂,还可预防氧化、延缓衰老等。甘氨酸与酸反应生成阳离子(用表示)。甘氨酸聚合成多肽,生成水分子。调节甘氨酸溶液的pH,当净电荷等于0时称为等电点,此时,。下列叙述错误的是
A. 甘氨酸是蛋白质水解的最终产物之一
B. 甘氨酸是两性化合物
C. 甘氨酸溶液调pH后,在等电点时显中性
D. 当n=m+1时合成的肽为肽链
【答案】C
【解析】
【详解】A.甘氨酸的结构简式为HOOCCH2NH2,甘氨酸属于氨基酸,蛋白质水解的最终产物是氨基酸,甘氨酸是蛋白质水解的最终产物之一,A项正确;
B.甘氨酸中含有碱性基团—NH2和酸性基团—COOH,甘氨酸是两性化合物,B项正确;
C.甘氨酸中羧基的酸性大于氨基的碱性,在甘氨酸溶液中阴离子H2NCH2COO-(A-)比阳离子(H2A+)多,要达到等电点即c(H2A+)=c(A-),必须加入酸抑制阴离子,故甘氨酸溶液调pH后,在等电点时显酸性,C项错误;
D.1个甘氨酸分子中有1个氨基和1个羧基,nmol甘氨酸聚合成多肽,生成mmol水分子,当n=m+1时说明合成的肽中含有1个氨基、1个羧基和m个肽键,则合成的肽为肽链,D项正确;
答案选C。
12. 某有机物M对H2的相对密度为30,M分子中各元素的质量分数:碳40.0%,氢6.6%,氧53.4%。该有机物能与钠反应,又能与银氨溶液共热产生银镜。M的结构简式可能是
A. HOCH2CH2CHO B. HCOOCH3
C. HOCH2CHO D. CH3OCHO
【答案】C
【解析】
【详解】有机物M对H2的相对密度为30,则M的相对分子质量为60,M分子中各元素的质量分数:碳40.0%,氢6.6%,氧53.4%,则N(C)= =2,N(H)= =4,N(O)=,M分子式为:C2H4O2;有机物能与钠反应,又能与银氨溶液共热产生银镜,可知M中含羟基和醛基,则符合条件的结构简式只有C,故C正确;
故选:C。
13. 乙酸异戊酯天然存在于香蕉、苹果等水果和浆果中,具有香蕉香味。某化学兴趣小组在实验室中利用乙酸和异戊醇( )制备乙酸异戊酯,实验装置如图1所示(加热及夹持仪器略),相关物质的部分性质如表所示。
物质
密度/()
沸点/℃
水中溶解度
异戊醇
0.809
132
微溶
乙酸
l.049
118
易溶
乙酸异戊酯
0.876
142.5
微溶
下列说法错误的是
A. 异戊醇的同分异构体中,与其含有相同官能团的结构有7种
B. 实验中浓硫酸只起到催化作用和脱水作用
C. 图1中的装置可用图2所示装置代替
D. 实验中加入过量的异戊醇可提高乙酸的转化率
【答案】B
【解析】
【详解】A.异戊醇分子式为C5H12O,其同分异构体中含有相同官能团的结构,说明含有羟基,则改写为C5H11OH,则该醇相当于戊烷中一个氢原子被羟基取代,戊烷有三种结构,分别为正戊烷、异戊烷、新戊烷,三种结构中分别有3种、4种、1种位置的氢,则醇的结构有8种,除掉异戊醇还有7种,故A正确;
B.乙酸和异戊醇( )在浓硫酸加热条件下反应生成乙酸异戊酯和水,实验中浓硫酸起到催化作用、脱水作用,还有吸水作用,故B错误;
C.图1中的装置可用图2所示装置代替,其防倒吸作用,故C正确;
D.该酯化反应是可逆反应,实验中加入过量的异戊醇,平衡有利于正向移动,可提高乙酸的转化率,故D正确。
综上所述,答案为B。
14. 下列有关物质结构与性质的论述错误的是
A. “电子气理论”用于描述金属键的本质,可用于解释金属晶体的延展性、导电性和导热性
B. 中S的孤电子对数为0,空间结构是平面三角形
C. O的电负性比C大,则配合物中配位原子是碳原子
D. 除稀有气体单质外,其他气态单质分子中都含有σ键,可能含有π键
【答案】B
【解析】
【详解】A.金属键是金属阳离子和自由电子之间的强烈相互作用,自由电子为整个金属的所有阳离子所共有,此“电子气理论”用于描述金属键的本质,可用于解释金属晶体的延展性、导电性和导热性,A正确;
B.的中心原子S原子的价层电子对数为,孤电子对数为1,为sp3杂化,空间构型为三角锥形,B错误;
C.O的电负性比C大,配合物中铁提供空轨道、碳提供孤电子对,配位原子是碳原子,C正确;
D.单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;除稀有气体单质外,其他气态单质分子中都含有σ键,可能含有π键,D正确;
故选B。
15. 化学是以实验为基础的科学,下列实验操作或做法能达到实验目的的是
选项
实验操作或做法
目的
A
将稀盐酸与碳酸钙反应产生的气体直接通入溶液中
验证酸性:
B
向洁净的试管中滴入10~15滴溴乙烷和5mL5%的溶液,振荡后加热,静置。待溶液分层后,取少量上层溶液,滴加2滴溶液,观察现象
检验溴乙烷中的溴
C
在洁净的试管中加入1mL2%的溶液,然后边振荡试管边逐滴滴入2%的氨水,使最初产生的沉淀溶解,再滴入3滴乙醛,振荡后将试管放在热水浴中温热
检验醛基
D
在试管中加入1mL淀粉溶液和2mL10%的溶液,加热煮沸,加入新制,加热并煮沸
检验淀粉水解产物
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.盐酸易挥发,二氧化碳中含有氯化氢气体,可能是氯化氢与苯酚钠反应生成苯酚,因此不能说碳酸酸性大于苯酚,故A不符合题意;
B.滴加硝酸银溶液前需要先加入稀硝酸,将溶液调至酸性,再加入硝酸银检验溴元素,故B不符合题意;
C.先制备银氨溶液,再滴入3滴乙醛,振荡后将试管放在热水浴中温热,一段时间后有光亮如镜的银生成,则说明含有醛基,故C符合题意;
D.溶液显酸性,应该先加入氢氧化钠溶液调节至碱性,再加入新制氢氧化铜加热,故D不符合题意。
综上所述,答案为C。
二、非选择题:本题共4小题,共55分。
16. 第三周期几种氧化物(不包括过氧化物和超氧化物)的离子键成分的百分数如图所示。回答下列问题:
(1)离子键成分的百分数最高的是_______(填化学式)。
(2)MgO的熔点_______(填“高于”或“低于”)Na2O,原因是_______。
(3)根据图示推知,第三周期主族元素最高价氧化物中离子键成分的百分数最低的是_______(填化学式),下列化合物中离子键成分的百分数最高的是_______(填标号)。
A.CsF B.LiCl C.CaO D.AlBr3
(4)NaCl晶胞结构如图所示,设晶胞的边长为apm,NA为阿伏加德罗常数的值。
①1个NaCl晶胞的质量为_______g。
②与Cl—最近且等距离的Na+数为_______。
③阳离子填充在阴离子构成_______(填标号)空隙中。
A.正八面体 B.正四边形
C.正四面体 D.正三角锥形
【答案】(1)Na2O
(2) ①. 高于 ②. Mg2+的半径小于Na+且Mg2+所带电荷数大于Na+,离子半径、电荷数对离子键强度的影响程度大于离子键成分的百分数,故MgO熔点高于Na2O
(3) ①. Cl2O7 ②. A
(4) ①. ②. 6 ③. A
【解析】
【小问1详解】
由图示可知离子键成分的百分数最高的是原子序数为11的钠元素形成的Na2O;
【小问2详解】
Mg2+的半径小于Na+且Mg2+所带电荷数大于Na+,离子半径、电荷数对离子键强度的影响程度大于离子键成分的百分数,故MgO熔点高于Na2O;
【小问3详解】
由图示可知,第三周期主族元素最高价氧化物中离子键成分的百分数随着原子序数递减,故百分数最低的是Cl2O7;由图可知活泼性强的金属与活泼性强的非金属之间形成的化合物离子键成分较高,结合选项可知Cs的金属性最强,F的非金属性最强,两者形成的化合物的离子键成分最高。
【小问4详解】
①均摊法可知1个NaCl晶胞含Cl-数目为,8×+6×=4,Na+数目为12×+1=4,即4个NaCl,1个NaCl晶胞质量为g;
②由晶胞示意图可知与Cl−最近且等距离的Na+数为6;
③阳离子填充在阴离子构成的正八面体空隙中。
17. 科学家开发了一种氮掺杂氢化镥(Lu—N—H)材料,在压强下,表现出室温(20℃)超导特性。回答下列问题:
(1)已知基态Lu(镥)原子的价层电子排布式为,它位于元素周期表第___________周期第___________族,有___________个未成对电子。
(2)氮族氢化物中,沸点最低的是___________(填化学式),的沸点高于,其主要原因是___________。
(3)一种新药的活性成分的结构简式如图所示。1个该分子含___________个手性碳原子。
(4)含N的分子或离子是常见的配体。例如,雷氏盐的化学式为,其常作分析试剂。
①雷氏盐中阳离子的空间结构为___________,阴离子中配位原子是___________(填元素符号)。
②预测:雷氏盐中阴离子的空间结构最可能是___________(填标号)。
A. B. C. D.
(5)Lu—N—H晶胞如图所示。已知晶胞参数为,代表阿伏加德罗常数的值。在该晶胞中,有___________个Lu原子与H原子等距离且最近。该晶体的密度为___________。
【答案】(1) ①. 六 ②. IIIB ③. 1
(2) ①. ②. 分子间存在氢键
(3)1 (4) ①. 正四面体形 ②. S、N ③. C
(5) ①. 6 ②.
【解析】
【分析】从轨道数据知道周期数,根据构造原理排布规则知道最外层电子数,同一主族元素的氢化物的沸点从上到下随着相对分子质量的增大而升高,要小心氢键的影响力
【小问1详解】
从价电子排布式可知,出现了6s轨道,确定其在第六周期,因为它的f轨道全充满,就基本确定该元素在f区,排除掉全充满的电子,根据构造原理,那么最外层还有3个电子,可确定其在第ⅢB族,故镥在第六周期第ⅢB族;根据价层电子排布式,f和s轨道全充满,没有未成对电子,所以在d轨道上出现1个未成对电子;故答案是1个未成对电子;
【小问2详解】
氮族氢化物属于同一主族氢化物,其沸点随着相对分子质量的增加而升高,所以其氢化物的沸点越往下的元素的氢化物的沸点就越高,但是NH3易形成分子间氢键,使其沸点突然增大,所以氮族氢化物沸点最低的是PH3;NH3的沸点高于AsH3,其主要原因是NH3容易形成分子间氢键造成的;
【小问3详解】
手性碳原子是指该碳原子周围连接了4个全部不同的原子或原子基团,在该结构中,是N原子与标记出来的H原子连接的碳原子,这样的手性碳原子只有1个;
【小问4详解】
雷氏盐中的阳离子是,其空间构型是正四面体;NH4[Cr(SCN)4(NH3)2]中的阴离子是[Cr(SCN)4(NH3)2]—,该阴离子中配位体有两种,是SCN—和NH3,中心原子是Cr,Cr提供空轨道,S与N提供未成对电子,所以该配合物中配位原子是S与N;雷氏盐中的配位数是6,说明离中心原子最近的原子或原子团有6个,能符合的图是C,故阴离子的空间结构最可能的是C;
【小问5详解】
从晶胞结构中可知,该立方体中,顶点上的是H,棱上的是Lu,一个H原子周围距离最近的Lu有6 个;从图中可知,Lu的个数是4,N的个数是8,H的个数是4,故该晶体分子式是LuN2H,该晶胞中有4个这样的分子,所以N为4,所以该晶体的密度为,数据套入公式,则g/cm3
18. 肉桂酸是无公害的环保防腐剂,可直接添加于食品中。某小组设计实验制备肉桂酸并探究其性质:
原理】
【性质】
物质
苯甲醛
肉桂酸
乙酸酐
沸点
179℃
300℃
140℃
水溶性
微溶于水、无色油状液体
难溶于冷水、易溶于热水
与水反应生成乙酸
【步骤】
【装置】利用图1装置完成步骤①,利用图2装置完成步骤②,抽滤操作用图3装置。
回答下列问题:
(1)R是___________(填结构简式)。
(2)图1中,仪器B的名称是___________,仪器A的作用是___________。实验前,要烘干三颈烧瓶,目的是___________。
(3)完成步骤②,蒸馏的主要目的是分离出过量的苯甲醛,毛细管1与空气相通,其作用是___________(答一条即可)。
(4)相比于普通过滤,图3抽滤的主要优点有___________(答一条即可)。
(5)步骤③加入溶液的作用是___________,第二次抽滤得到滤饼的主要成分是___________(填名称)。
(6)设计简单实验证明肉桂酸中含有碳碳双键:___________。
【答案】(1)
(2) ①. 恒压滴液漏斗 ②. 冷凝回流 ③. 避免水与乙酸酐反应
(3)防止液体暴沸(或形成气压中心等)
(4)过滤较快(或固体较干燥或固液更容易分离等)
(5) ①. 将肉桂酸转化成肉桂酸钠 ②. 肉桂酸
(6)取少量产品溶于热水,滴几滴溴水,溶液褪色
【解析】
【分析】苯甲醛和乙酸酐在无水条件下和碳酸钾加热生成肉桂酸,同时生成乙酸,反应后蒸馏除去苯甲醛、乙酸酐,冷却后加入氢氧化钠将肉桂酸转化为钠盐,加入活性炭脱色,冷却抽滤除去固体分离出滤液,肉桂酸难溶于冷水,加入浓盐酸冷却结晶出肉桂酸晶体,抽滤得到固体产品;
【小问1详解】
由分析可知,R为;
【小问2详解】
图1中仪器B的名称是恒压滴液漏斗,仪器A为球形冷凝管,作用是冷凝回流。乙酸酐与水反应生成乙酸,故要烘干三颈烧瓶,目的是避免水与乙酸酐反应;
【小问3详解】
毛细管1与空气相通,其作用是平衡压强且防止液体暴沸(或形成气压中心等)
【小问4详解】
抽滤过程中装置中压强差较大,可以使得过滤较快(或固体较干燥或固液更容易分离等);
【小问5详解】
肉桂酸具有酸的通性,能和氢氧化钠强碱反应,步骤③加入溶液的作用是将肉桂酸转化成肉桂酸钠;肉桂酸难溶于冷水,第二次抽滤得到滤饼的主要成分是肉桂酸;
【小问6详解】
碳碳双键能和溴水发生加成反应使得溴水褪色,故方案可以为:取少量产品溶于热水,滴几滴溴水,溶液褪色。
19. 一种荧光探针(E)的合成路线如图:
已知:
(1)A的名称为___________;C中的含氧官能团的名称为___________。
(2)B→C反应的化学方程式为___________。
(3)D→E反应的反应类型为___________,D的结构简式为___________,1molD与足量溶液充分反应,最多可消耗___________mol。
(4)W与X互为同系物且W的碳原子数比X多1,H与W互为同分异构体,则满足下列条件的H的结构有___________种(不考虑立体异构)。
①能与溶液发生显色反应
②可与溶液反应
(5)根据以上信息,写出以和为原料制备
的合成路线流程图___________。(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)
【答案】(1) ①. 丙二酸 ②. (酚)羟基、酯基
(2)++H2O (3) ①. 取代反应 ②. ③. 4
(4)13 (5)
【解析】
【分析】根据信息分析得到A为CH2(COOH)2,B和发生反应生成C,C在催化剂作用下反应生成D(),D和发生取代反应生成E。
【小问1详解】
依据合成路线可推出A的结构简式为CH2(COOH)2,故A的名称为丙二酸;根据C的结构简式得到C中的含氧官能团的名称为(酚)羟基、酯基;故答案为:丙二酸;(酚)羟基、酯基。
【小问2详解】
B→C反应的化学方程式为++H2O;故答案为:++H2O。
【小问3详解】
D→E反应是D中羧基与中氨基反应,其反应类型为取代反应,根据前面分析得到D的结构简式为,D含有酚羟基、羧基,酚酸酯基,则1molD与足量溶液充分反应,最多可消耗4mol;故答案为:取代反应;;4。
【小问4详解】
W与X()互为同系物且W的碳原子数比X多1,则W分子式为,H与W互为同分异构体,①能与溶液发生显色反应,说明含有苯环和酚羟基;可与溶液反应,说明含有羧基,综合分析得出两种情况,第一种情况:苯环上连有两个取代基(一个酚羟基、一个基团),该结构有邻、间、对3种;第二种情况:苯环上连有三个取代基(一个酚羟基、一个甲基、一个羧基),当甲基和羧基在邻位,苯环上有四种位置氢,其结构有4种;当甲基和羧基在间位,苯环上有四种位置氢,其结构有4种;当甲基和羧基在对位,苯环上有两种位置氢,其结构有2种;共有10种;因此满足条件的H的结构共有13种;故答案为:13。
【小问5详解】
苯甲醛和丙二酸在(CH3CO)2O、浓硫酸作用下反应生成,和苯甲醛反应生成,在催化剂作用下与氢气反应生成,其合成路线为;故答案为:。
相关试卷
这是一份2024届吉林省白山市高三一模考试化学试题(原卷版+解析版),文件包含精品解析2024届吉林省白山市高三一模考试化学试题原卷版docx、精品解析2024届吉林省白山市高三一模考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共36页, 欢迎下载使用。
这是一份2024届吉林省白山市高三一模考试化学试题(原卷版+解析版),文件包含精品解析2024届吉林省白山市高三一模考试化学试题原卷版docx、精品解析2024届吉林省白山市高三一模考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共36页, 欢迎下载使用。
这是一份吉林省四校期初联考2023-2024学年高二下学期开学考试化学试题(原卷版+解析版),文件包含精品解析吉林省四校期初联考2023-2024学年高二下学期开学考试化学试题原卷版docx、精品解析吉林省四校期初联考2023-2024学年高二下学期开学考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。









