

第四章 物质结构元素周期 单元检测(含解析)高中化学人教版(2019)必修1
展开
这是一份第四章 物质结构元素周期 单元检测(含解析)高中化学人教版(2019)必修1,共17页。
第四章物质结构元素周期单元检测
2022——2023学年人教版(2019)高一化学必修上
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.一种微粒的质子数、电子数与另一种微粒的质子数、电子数均相等,则下列叙述中一定错误的是
A.可能是同位素 B.可能是同一种原子
C.可能是同一种元素 D.可能是一种分子和一种离子
2.某微粒M的结构示意图如下,关于该微粒的说法不正确的是
A.M一定不属于稀有气体
B.M一定不可能带正电
C.x一定不大于8
D.物质A在水溶液中可电离出M,则A一定属于盐类
3.下列叙述正确的是
①用电子式表示的形成过程为:
②两个不同种非金属元素的原子间形成的化学键都是极性键
③离子化合物在熔融状态时能够导电
④含有非极性键的化合物一定是共价化合物
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥次氯酸的电子式:
⑦离子化合物中一定含有离子键
A.①②③④⑥⑦ B.①②③⑤⑦ C.②③⑦ D.全部
4.类比的思维方式在化学学习与研究中经常采用,但类比得到的结论是否正确最终要经过实验的验证。以下类比的结论正确的是
A.Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
B.HCl的水溶液是强酸,推出HF的水溶液也是强酸
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.由“Cl2+H2O⇌HCl+HClO”反应可推出“F2+H2O⇌HF+HFO”反应也能发生
5.NA代表阿伏加德罗常数的值,以下说法正确的是
A.将足量Zn与100 mL18 mol/L浓硫酸反应,生成224mL气体,转移电子为0.2NA
B.在标准状况下,22.4 LSO3所含原子总数为4NA
C.31gP4()分子中含有P—P键数为1.5NA
D.1molD318O+中含有的中子数为10 NA
6.下列结论正确的是
①微粒半径:S2->Cl->K+>Al3+
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:HClO>H2SO4>H3PO4>H2CO3
⑥非金属性:O>N>P>Si
⑦金属性:Be>Mg>Ca>K
A.①②④⑥ B.①④⑥ C.①③ D.⑤⑥
7.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14,下列说法错误的是
A.原子半径由小到大的顺序: X< W < Z< Y
B.X的简单气态氢化物比Z的简单气态氢化物更稳定
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.室温下,0.1mol W的气态氢化物溶于1L水中,可制得1mol/L HW溶液
8.X、Y、Z、M是四种短周期主族元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比X原子的少1。M是同周期主族元素中半径最大的。下列说法错误的是
A.X、Y的最简单氢化物中,X的最简单氢化物沸点更高
B.四种元素简单离子的半径大小为Y>X>Z>M
C.Y的最高价氧化物对应水化物的化学式可表示为H2YO4
D.X、Y、M可以组成多种离子化合物
9.与NO在焦炭表面发生反应的机理简化如下(化学键和部分微粒未标出):
下列有关说法不正确的是
A.CO2为直线形分子
B.N2O为催化剂
C.N2的结构式为:
D.参与反应的微粒有部分化学键未发生断裂
10.X、Y、Z为原子序数依次增加的短周期主族元素,且Y、Z同周期,由它们组成的单质或化合物存在以下转化关系。常温下,D是红棕色气体,F为无色液体。下列说法正确的是
A.原子半径:XZ,A错误;
B.非金属性越强氢化物越稳定,非金属性O>N,故氢化物稳定性YF->Na+>Al3+
(3)
(4) bc
(5) 乙
【分析】由题知,N、X为同主族元素,且X单质能讲H2O氧化,可得X单质为F2,与水的反应式为,可得N元素为Cl元素。Z原子序数大于X,则Z为第三周期元素,且其简单离子半径最小,可得Z为Al元素。Y的最高价氧化物对应水化物的碱性最强,可知Y为短周期中金属性最强的元素,为Na元素。M与N、X、Y、Z均不在同一周期,可得M为第一周期的元素,为H元素。
【详解】(1)Na在第三周期第ⅠA族,与H的化合物NaH为离子化合物,其电子式为;
(2)N、X、Y、Z的简单离子分别为Cl-、F-、Na+、Al3+,除了Cl-为三个电子层外,其余离子均为两个电子层。电子层数相同时,质子数越小,半径越大,所以离子半径大小顺序依次为:Cl->F->Na+>Al3+;
(3)由题足量CO2在碱性溶液中与NaAlO2和NaF反应生成NaHCO3和Na3AlF6,反应式为:
(4)①Ga位于元素周期表第四周期第ⅢA族,与Al元素在同一主族,最外层电子数相同,化学性质类似,金属性强于Al元素,b、c正确,a错误。N、P、As均为第ⅤA族元素且原子序数依次增大,其非金属性依次减小,最高价氧化物对应水化物酸性依次减小,d错误,故选bc;
②GaAs中As元素被HNO3氧化生成H3AsO4,化合价从-3价升为+5价,HNO3中氮元素被还原,化合价从+5价降为+4价,结合电子守恒,反应式应为:;
(5)①NaAlH4为强还原剂,其中H元素为-1价,与H2O反应将其中H元素还原,结合电子守恒化学反应式为:;
②通过测定反应生成的H2体积结合化学式计算样品纯度,其中丙装置连接错误,无法用排水法测定H2体积;甲、丁装置中反应产生的氢气会导致现状内部压强大于外界大气压强,测得氢气体积偏小,导致样品纯度偏小;乙装置使用恒压分液漏斗,消除溶液体积压缩气体体积带来的误差,数据准确,选择乙装置;
③根据反应关系是可得,则样品纯度可列式:
18. 第三周期第ⅣA族 CO2 H2SiO3 、 BD 55 2Cs+2H2O=2CsOH+H2↑ 强 B b=a+1或b=a+11
【详解】根据元素周期表的结构可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。
(1) 地壳中含量居于第二位的元素是Si,Si位于周期表中第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2) C的最高价氧化物分子式为CO2,Si的最高价氧化物对应的水化物为H2SiO3,故答案为:CO2;H2SiO3;
(3) H、Na、O元素形成的化合物可能是H2O、H2O2、NaOH、Na2O、Na2O2、NaH,其中既含离子键又含共价键的离子化合物是NaOH和Na2O2,电子式为:、,故答案为:、;
(4) W为Se,Se的非金属性比S弱,故H2Se的稳定性不及H2S,常温下Se与H2难以化合,故选项B、D所述性质不可能,故答案为:BD;
(5) ①根据碱金属元素核外电子排布规律,结合铯在周期表中的位置可知,铯原子核外共有6个电子层,每个电子层的电子数目分别是2、8、18、18、8、1,原子序数等于核外电子总数,故为55,故答案为:55;
②铯与钠、钾同主族,具有极强的金属性,与H2O反应的化学方程式为2Cs+2H2O===2CsOH+H2↑;
③同主族元素,从上到下,金属性依次增强,故铯单质的还原性比钠单质强;
④A项,与铯同主族的氢元素为非金属元素,错误;
B项,铯单质还原性较强,反应时铯原子易失去电子,正确;
C项,碳酸钠为可溶性盐,以此类推,碳酸铯是一种可溶性盐,错误;
D项,金属性较强的元素,其简单阳离子的氧化性较弱,故铯离子的氧化性弱于钾离子,错误;
故答案为:2Cs+2H2O=2CsOH+H2↑;强;B;
(6)若X位于第二、三周期,则b=a+1;若X位于第四周期,则b=a+11,故答案为:b=a+1或b=a+11。
19. ① 26 紫
【详解】Ⅰ.(1)某粒子有1个原子核核中有17个质子、20个中子,核外有18个电子,该粒子电子数比质子数多1,为带1个单位负电荷的阴离子,该粒子符号为;
(2)Mg(OH)2由和构成,电子式为;分子中两个N原子间形成三个共用电子对,电子式为:N⋮⋮N:;由和构成,电子式为;
(3)为离子化合物,由钠离子和硫离子构成,各原子达到稳定结构,用电子式表示形成过程为;
H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为;
Ⅱ.由元素在周期表中的位置可知,①为H,②为,③为K,④为,⑤为,⑥为C,⑦为O,⑧为,⑨为I,⑩为。
(1)元素的金属性,最高价氧化物对应水化物的碱性:;
(2)H原子只有1个电子层,其原子半径最小,答案为①;
(3)元素⑦为O元素,其简单氢化物为,元素⑧的单质为,氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,反应的离子方程式为;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应的化学方程式为;
(5)元素⑩为,位于周期表中第四周期第Ⅷ族,其原子序数为26;元素⑦为O元素,其简单氢化物为,铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为;
(6)元素⑥与元素⑧形成的化合物的化学式为,碘单质易溶于,溶液呈紫色。
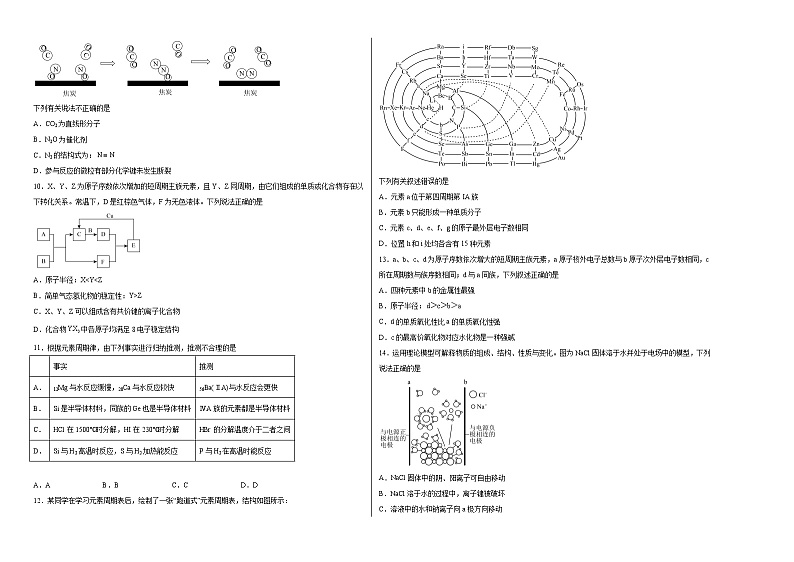
20. 第三周期IIIA族 b
【分析】X是第三周期元素的简单离子中半径最小,则X为Al,Y最简单氢化物丙的水溶液呈碱性,则Y为N元素,丙为NH3,Z原子核外电子数和周期序数相等,则Z为H元素.A、B、D三种单质分别由X、Y、Z元素组成,则A为Al、B为N2、D为H2,丁是一种高能燃料,其组成元素与丙相同,且含有18mol电子,则丁为N2H4;Al与氮气反应生成甲为AlN,AlN水解得到氨气与氢氧化铝,故戊为Al(OH)3,乙为Al2O3,据此解答。
【详解】(1)元素X为A1,在周期表中的位置是第三周期IIIA族,其简单离子的结构示意图为;
(2)单质B为,电子式为;
(3)丙为,N原子与H原子之间形成极性共价键,故选b;
(4)反应②为氨气与的反应,0.5 mol参加反应时,转移1 mol电子,则Cl元素由+1价降低为﹣1价,该反应生成,同时生成和水,则该反应的化学方程式为;
(5) —定条件下,A1与、C(石墨)反应只生成和碳化钬(),该反应的化学方程式为。






