
所属成套资源:2024届高三新高考化学大一轮专题练习 (83份)
2024届高三新高考化学大一轮专题练习:电解池(有答案)
展开这是一份2024届高三新高考化学大一轮专题练习:电解池(有答案),共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:电解池
一、单选题
1.(2023·山西吕梁·统考二模)研究表明,苯能更好地转化成苯甲酸,其相应的机理(自由基过程)如图所示,已知:Ar为芳基(-C6H5); Ac为乙酰基( ),下列说法错误的是
A.K2S2O8中S的化合价为+6价,在该反应机理中作氧化剂
B.CoII (OAc)2一次性加入,不需要中途再加入
C.电解KHSO4制备K2S2O8循环使用: 2KHSO4K2S2O8+H2↑
D.CoIII-O·、CoII-OH、Ar·、ArCO·均为反应过程中的自由基
2.(2023·山东青岛·统考二模)用废旧硬质刀具(含碳化钨、钴、铁)回收金属钻,工艺流程如图。下列说法错误的是
A.“电解”时硬质刀具做阳极,气体为
B.洗涤不充分不影响最终产品的纯度,但会污染环境
C.“焙烧”时发生的主要反应为
D.还原性:
3.(2023春·四川绵阳·高三四川省绵阳南山中学校考期中)氟离子电池是新型电池中的一匹黑马,其理论比能量高于锂电池。一种氟离子电池的工作原理如图所示,下列说法正确的是
A.放电时,a是电源的负极
B.放电时,a极的电极反应为:LaSrMnO4F2-2e-=LaSrMnO4+2F-
C.充电时,电极a接外电源的正极
D.可将含F-的有机溶液换成水溶液以增强导电性
4.(2023春·江苏连云港·高三统考期中)为节约资源,许多重要的化工产品可以进行联合生产。如氯碱工业、金属钛的冶炼工业、甲醇的合成工业可以进行联合生产。联合生产时的物质转化如下图所示:
部分反应的热化学方程式为:
2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
CO(g)+2H2(g)=CH3OH(g) ΔH=-90.7kJ·mol-1
TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) ΔH=-70.0kJ·mol-1
下列关于联合生产的有关说法正确的是
A.通过电解MgCl2溶液可以实现镁的再生
B.电解饱和食盐水时,阳极附近溶液pH升高
C.还原反应时,每生成48gTi,反应共转移2mol电子
D.反应TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)在任何条件下均不能自发进行
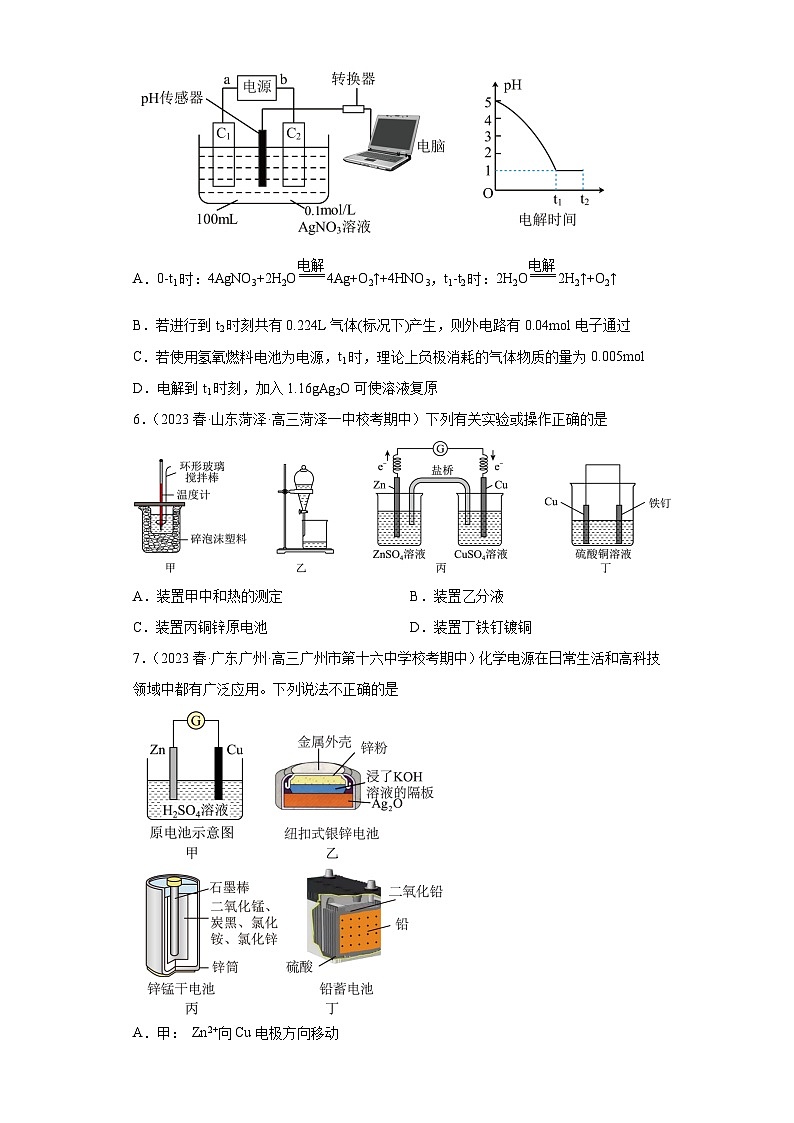
5.(2023·江西鹰潭·统考二模)为探究电解过程中溶液pH的变化。装置、所得数据结果如图所示。电解过程中,充分搅拌使溶液均匀,忽略溶液体积的变化。下列说法错误的是
A.0-t1时:4AgNO3+2H2O4Ag+O2↑+4HNO3,t1-t2时:2H2O2H2↑+O2↑
B.若进行到t2时刻共有0.224L气体(标况下)产生,则外电路有0.04mol电子通过
C.若使用氢氧燃料电池为电源,t1时,理论上负极消耗的气体物质的量为0.005mol
D.电解到t1时刻,加入1.16gAg2O可使溶液复原
6.(2023春·山东菏泽·高三菏泽一中校考期中)下列有关实验或操作正确的是
A.装置甲中和热的测定 B.装置乙分液
C.装置丙铜锌原电池 D.装置丁铁钉镀铜
7.(2023春·广东广州·高三广州市第十六中学校考期中)化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.甲: Zn2+向Cu电极方向移动
B.乙:负极的电极反应式为Zn- 2e-+ 2OH- = Zn(OH)2
C.丙:锌筒作负极,发生氧化反应
D.丁:电池放电时,电子由铅经硫酸溶液流向二氧化铅
8.(2023春·江苏宿迁·高三统考期中)实验室以一定浓度的和混合溶液为电解液,让同时在阴、阳两极发生反应来模拟隔膜电解法处理含的废水,工作原理如图所示。已知阴极区域主要反应可表示为:、(为活泼H)。下列说法不正确的是
A.直流电源b为负极
B.图中离子交换膜是阳离子交换膜
C.阳极区的反应可表示为:
D.电解过程中阴极区溶液的pH变小
9.(2023·全国·高三专题练习)废水中的有机污染物可通过MFC-电芬顿技术来处理,该技术通过产生羟基自由基处理有机污染物,同时高效净化废水,其耦合系统原理示意图如下,下列说法正确的是
A.甲池中溶液的不变
B.电极为阴极,电极反应为
C.乙池中产生的对废水也能起到净水作用
D.乙池中发生反应,之后部分生成絮状沉淀
10.(2023春·湖北·高三校联考期中)间接电解法除N2O,其工作原理如图所示,已知H2S2O4是一种弱酸。下列有关该装置工作的说法正确的是
A.b为直流电源的负极
B.离子交换膜为阴离子交换膜
C.电解池的阴极电极反应式为2H2SO3+2e-+2H+=H2S2O4+2H2O
D.在吸收池中,H2S2O4被N2O还原为H2SO3从而实现循环使用
11.(2023春·四川达州·高三四川省万源中学校考阶段练习)Zn-PbO2是一种新型电池,其示意图如图所示。a、b为离子交换膜,A、B、C三个区域的电解质溶液分别为KOH、K2SO4和H2SO4溶液,该电池工作时B区电解质浓度增大。下列说法错误的是
A.电池工作时,电子由Zn电极流向PbO2电极
B.a膜为阴离子交换膜,b为阳离子交换膜
C.当电路中转移2 mol电子时理论上产生1 mol
D.PbO2电极的电极反应式为:PbO2+2e-++4H+= PbSO4+2H2O
12.(2023春·广东茂名·高三茂名市电白区第一中学校考阶段练习)研究小组以粗铜(含Ag、Fe等金属)、纯铜为电极,聚丙烯酸钠-氨水溶液为电解质,进行精炼铜模拟实验,电解过程中阳极的电极反应式为。下列说法正确的是
A.阳极泥中主要含Ag、Fe单质
B.电解过程向阳极移动
C.电解开始阶段,阴极有产生
D.电解后阶段,阳极生成的同时阴极生成1molCu
13.(2023春·重庆沙坪坝·高三重庆市凤鸣山中学校考阶段练习)氢气是最清洁的能源,用下列装置可以制得氢气和氮气。下列说法不正确的是
A.该系统的能量转化是光能→电能→化学能
B.a极的电极反应式为
C.电解的总反应式为
D.b连接太阳能电池的负极,从a极区往b极区移动
14.(2023春·山西运城·高三康杰中学校考期中)对氨基苯酚(,俗称PAP)是一种重要的精细化工中间体,工业上常采用电解硝基苯的方法制取,其装置原理如图所示。下列说法错误的是
A.电源b为正极
B.电极c上发生的电极反应式为
C.离子交换膜最好用质子交换膜
D.当成时,右侧生成的在标准状况下体积为
二、非选择题
15.(2023春·江苏镇江·高三江苏省镇江中学校考期中)铁元素的纳米材料因具备良好的电学特性和磁学特性,而引起了广泛的研究。纳米零价铁可用于去除水体中的六价铬与硝酸盐等污染物。
(1)用溶液与(H元素为-1价)溶液反应制备纳米零价铁的化学方程式:。当生成时,反应中转移电子的物质的量为___________。
(2)纳米铁碳微电技术是一种利用铁和碳的原电池反应去除水中污染物的技术达到无害排放,该技术处理酸性废水中时,正极电极反应式为___________。
(3)我国科学家研究出USTB工艺制取金属钛,其原理如图。该方法使用的固溶体为具有导电性的,电解质为氯化钙熔盐,电解时阳极发生的主要电极反应为___________。
(4)聚合硫酸铁广泛用于水的净化。以为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品,置于锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的溶液(将还原为),充分反应后,除去过量的。用溶液滴定至终点(滴定过程中与反应生成和),消耗溶液。
①上述实验中若不除去过量的,样品中铁的质量分数的测定结果将___________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)___________。
16.(2023春·河北石家庄·高三正定中学校考阶段练习)Ⅰ.在1×105Pa, 25℃时,H-H键、N ≡N键和N- H键的键能分别为436 kJ·mol-1、945 kJ·mol-1和391 kJ·mol-1。
(1)①根据上述数据判断工业合成氨的反应是___________(填“吸热”或“放热”)反应:
②25℃时,在催化剂存在下进行反应,消耗1 mol氮气和3 mol氢气,理论上放出或吸收的热量为Q1,实际生产中,加入0.5 mol氮气和1.5 mol氢气放出或吸收的热量为Q2, Q1与Q2比较,正确的是___________。
a. Q1> 2Q2 b. Q1<2Q2 C. Q1=2Q2 d.2Q1>Q2
Ⅱ. 某可逆反应在体积为5L的密闭容器中进行,0~3 min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。
(2)该反应的化学方程式为___________。
(3)反应开始至2min时,B的平均反应速率为___________。
(4)能说明该反应已达到平衡状态的是___________(填字母)。
a. v(A)=2v(B)
b.容器内混合气体的密度保持不变
c.2v正(A)=v逆(B)
d.容器内各物质浓度保持不变
(5)在密闭容器里,通入一定量的A、B、C,发生上述反应。达平衡后,当改变下列条件时,反应速率会减小的是___________(填序号)。
①降低温度 ②加入正催化剂 ③减小容器容积
Ⅲ.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:
(6)乙装置中负极反应式为___________。
(7)丙装置中溶液碱性___________(填“增强”或“减弱”)。
(8)假设开始时甲装置中两电极质量相等,导线中转移0.3 mol电子时,两电极质量相差___________ g。
17.(2023春·全国·高三期末)食盐除食用外,还用做工业原料,如生产烧碱、纯碱、金属钠及氯气、盐酸、漂白粉等含氯化工产品。
主要流程:
有关反应的化学方程式:
电解氯化钠:_______________
4Na+TiCl4(熔融)_____________________________
电解饱和食盐水:2NaCl+2H2O2NaOH+H2↑+Cl2↑
侯氏制碱法:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
NaHCO3分解:___________
18.(2023·全国·高三专题练习)从海水中提取镁的工艺流程如图所示:
回答下列问题:
(1)海水通过结晶、过滤得到的固体物质主要是___________。
(2)怎样使失去晶体水,得到?___________。
(3)上述工艺流程涉及到的四大基本反应类型有:___________。
(4)写出电解熔融的电极反应式___________。
参考答案:
1.D
【详解】A.K2S2O8中存在过氧键,六个氧为-2价,两个氧为-1价,S的化合价为最高价+6价,图示中K2S2O8使+2价钴转化为+3价钴,K2S2O8在该反应机理中作氧化剂,A正确;
B.由图示知CoII (OAc)2一次性加入,不需要中途再加入,CoIII-O·、CoII-OH循环使用,B正确;
C.电解KHSO4制备K2S2O8循环使用: 2KHSO4K2S2O8+H2↑,-2价氧失电子化合价升高到-1价,+1价氢得电子降低生成氢气,C正确;
D.CoIII-O·、CoII-OH、Ar·、ArCO·中CoII-OH不是自由基,D错误;
故选D。
2.D
【分析】用废旧硬质刀具回收金属钻,首先用盐酸提供的酸性条件下进行电解,其中钴和铁被溶解,用过氧化氢将二价铁氧化为三价铁,通入氨气将其沉淀,随后加入碳酸铵形成碳酸钴,焙烧后得到氧化钴,再用一氧化碳还原可以得到单质钴,以此解题。
【详解】A.“电解”时硬质刀具做阳极,失去电子被氧化为Fe2+和Co2+,阴极为H+放电得到H2,故A正确;
B.洗涤CaC2O4不充分,会附着氯化铵,在焙烧时氯化铵会分解生成氨气和氯化氢,污染环境,故B正确;
C.由图可知,“焙烧”时发生的主要反应为:,故C正确;
D.由除杂步骤可知Fe2+与H2O2反应生成Fe3+,而Co2+未反应,因此还原性:,故D错误;
故选D。
3.C
【分析】由于Mg是活泼金属,Mg2+氧化性弱,所以该电池工作时Mg失去电子结合F-生成MgF2,即b电极为负极,电极反应式为:Mg+2F--2e-=MgF2,则a为正极,正极反应式为:LaSrMnO4F2+2e-=LaSrMnO4+2F-;充电时,电解池的阳极、阴极与原电池的正、负极对应,电极反应与原电池的电极反应反应物与生成物相反,据此解答;
【详解】A.由于Mg是活泼金属,Mg2+氧化性弱,所以原电池放电时,Mg失去电子,作负极,即b为负极,a为正极,A错误;
B.放电时,a为正极发生还原反应,电极反应为:LaSrMnO4F2+2e-=LaSrMnO4+2F-,B错误;
C.充电时电解池的阳极、阴极与原电池的正、负极对应,所以a极接外电源的正极,C正确;
D.因为Mg能与水反应,因此不能将有机溶液换成水溶液,D错误;
答案选C。
4.D
【详解】A.电解MgCl2溶液生成Mg(OH)2、H2和Cl2,没有Mg生成,不能实现镁的再生,A不正确;
B.电解饱和食盐水时,阳极生成Cl2,阴极生成NaOH、H2等,所以阴极附近溶液pH升高,B不正确;
C.还原反应时,Ti元素的化合价由+4价降为0价,48gTi的物质的量为1mol,则反应共转移4mol电子,C不正确;
D.由反应TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) ΔH=-70.0kJ·mol-1和2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1,根据盖斯定律可得出TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+151kJ·mol-1,该反应的ΔS<0,△H>0,则在任何条件下均不能自发进行,D正确;
故选D。
5.B
【详解】A.银离子氧化性大于氢离子的氧化性,所以溶液中银离子先被还原,水电离出的OH-被氧化生成氧气,0-t1时:4AgNO3+2H2O4Ag+O2↑+4HNO3,当银离子被电解完,水电离出来的氢离子被还原生成氢气,t1-t2时:2H2O2H2↑+O2↑,故A正确;
B.进行到t1时银离子被完全还原,溶液的pH为1,硝酸银溶液中,,由反应得消耗电子转移0.01mol,设此过程生成氧气的物质的量为,,,,,t1- t2电解水生成的气体体积为0.224L-0.056L=0.168L,其中氧气和氢气体积比为1:2,电解水生成的氧气体积为0.056L,氧气的物质的量为,电子转移0.01mol,共计电子转移0.02mol,故B错误;
C.若使用氢氧燃料电池为电源,氢气与通过电子的关系为: ,t1时,电子转移0.01mol,理论上负极消耗的氢气物质的量为0.005mol,故C正确;
D.电解到t1时刻,生成了0.01mol的银和0.025mol氧气,0.01mol硝酸,加入1.16gAg2O其物质的量为,0.005molAg2O与0.01mol硝酸恰好完全反应生成0.01mol硝酸银和0.005mol水,可使溶液复原,故D正确;
故选:B。
6.C
【详解】A.由图可知,装置甲中大小烧杯口不相平,且缺少塑料盖片,会造成热量散失,不能完成中和热的测定,故A错误;
B.由图可知,装置乙中分液漏斗的下端没有紧贴烧杯内壁,会造成液滴飞溅,不能完成分液操作,故B错误;
C.由图可知,装置丙为带有盐桥的锌铜原电池,电子流出的锌电极为负极,电子流入的铜电极为正极,故C正确;
D.由图可知,装置丁无直流电源,不能达到铁钉镀铜的实验目的,故D错误;
故选C。
7.D
【详解】A.甲为铜锌原电池,锌为负极,铜为正极,阳离子Zn2+向Cu电极方向移动,选项A正确;
B.乙为纽扣电池,负极为锌失电子发生氧化反应,反应式为Zn - 2e- + 2OH- = Zn(OH)2,选项B正确;
C.丙为锌锰干电池,锌筒作负极,发生氧化反应被消耗,选项C正确;
D.丁为铅蓄电池,放电时为原电池,电子由负极铅沿导线流向正极二氧化铅,电子不会进入溶液,选项D不正确;
答案选D。
8.D
【详解】A.电解池中阳离子移向阴极,直流电源a为正极,b为负极,故A正确;
B.图中离子交换膜能让钠离子通过,是阳离子交换膜,故B正确;
C.阳极还原剂失电子发生氧化反应,阳极区的反应可表示为:CH3CHO+H2O−2e−=CH3COOH+2H+,故C正确;
D.电解过程中阴极区发生H2O+e−=+OH−,产生氢氧根离子,溶液的pH值变大,故D错误;
故选D。
9.C
【详解】A.甲池是燃烧电池,反应生成二氧化碳和水,溶液体积增大,磷酸浓度减小,因此溶液的增大,故A错误;
B.氧气为正极,则电极为阳极,电极反应为,故B错误;
C.乙池中产生的会形成氢氧化铁胶体,对废水起到净水作用,故C正确;
D.铁离子和氢氧根会反应,则乙池中发生反应,故D错误。
综上所述,答案为C。
10.C
【分析】根据图示,左边反应室H2SO3经反应后生成H2S2O4,S元素的化合价降低,电源a是负极,b是正极,电解池中,硫酸的浓度增大,H+应该向左边移动,所以离子交换膜应该是阳离子交换膜;
【详解】A.根据图示,左边反应室H2SO3经反应后生成H2S2O4,S元素的化合价降低,电源a是负极,b是正极,选项A错误;
B.右边阳极室发生反应2H2O-4e-=4H++O2↑,硫酸的浓度增大,H+应该向左边移动,所以离子交换膜应该是阳离子交换膜,选项B错误;
C.阴极电极反应式为2H2SO3+2e-+2H+=H2S2O4+2H2O,选项C正确;
D.在吸收池中,H2S2O4被N2O氧化为H2SO3从而实现循环使用,选项D错误;
答案选C。
11.B
【分析】a、b为离子交换膜,A、B、C三个区域的电解质溶液分别为KOH、K2SO4和H2SO4溶液,该电池工作时B区电解质浓度增大,则锌变为,化合价升高,失去电子,作负极,PbO2电极变为PbSO4,化合价降低,得到电子,作正极。
【详解】A.根据前面分析锌为负极,则电池工作时,电子由Zn电极流向PbO2电极,故A正确;
B.该电池工作时B区电解质浓度增大,则A区KOH中钾离子向右移动即a膜为阳离子交换膜,C区H2SO4中硫酸根向左移动即b为阴离子交换膜,故B错误;
C.根据,则当电路中转移2 mol电子时理论上产生1 mol ,故C正确;
D.PbO2电极是正极,得到电子,该电极反应式为:PbO2+2e-++4H+= PbSO4+2H2O,故D正确。
综上所述,答案为B。
12.C
【分析】根据精炼铜的原理分析可知,阳极电极反应式为,电解过程向阴极移动,开始阶段尚未到阴极,水放电产生,后阶段计得电子生成铜,电极反应式为。据此回答问题。
【详解】A.粗铜(含Ag、Fe等金属)做阳极,Fe比铜活泼,先放电,阳极泥的主要成分为Ag,故A错误;
B.电解过程向阴极移动,故B错误;
C.电解开始阶段尚未到阴极,阴极上水放电产生,故C正确;
D.由于电解过程中不间断地有附着在粗铜上的Fe参与放电,生成与生成Cu的量不相等,故D错误;
故选C。
13.D
【分析】整个过程中,光伏电池吸收太阳能转化为电能,电解池将电能转化为化学能,a极上氨气失电子生成氮气,电极反应式为:,阴极电极反应:2H2O+2e−=H2↑+2OH−,电解的总反应式为,据此分析解题。
【详解】A.整个过程中,光伏电池吸收太阳能转化为电能,电解池将电能转化为化学能,则能量转化:光能→电能→化学能,故A正确;
B.a极上氨气失电子生成氮气,电极反应式为:,故B正确;
C.阳极电极反应式为:,阴极电极反应:2H2O+2e−=H2↑+2OH−,电解的总反应式为,故C正确;
D.b极是H2O得电子变成H2,b连接太阳能电池的负极,OH−从b极区往a极区移动,故D错误;
故答案选D。
14.D
【分析】经过装置图分析,电极d中,CH3COO−转化为CO2,碳元素化合价升高,失去电子,是阳极,则电极b是正极,电极a是负极。
【详解】A.CH3COO−转化为CO2,碳元素化合价升高,属于氧化反应,则d为阳极,b为正极,A正确;
B.NH4Cl溶液显酸性,c电极上发生反应的电极反应式为+4H++4e-=+H2O ,B正确;
C.电解池中左侧消耗H+,右侧产生H+,故离子交换膜选用质子交换膜,C正确;
D.d电极的反应式为:CH3COO−−8e−+2H2O=7H++2CO2↑,当生成1mol时转移4mole−,右侧生成的CO2在标准状况下体积为22.4L,D错误;
故选:D。
15.(1)
(2)
(3)
(4) 偏大 12.32%
【详解】(1)根据反应:,,氢从-1价升高到0价,化合价升高8价,,氢从+1价降低到0价,化合价降6价,铁从+2价降低到0价,化合价降2,总共将8价,所以当生成1mol Fe时,反应中转移电子的物质的量为8mol;
(2)要使除水中污染物的技术达到无害排放,该技术处理酸性废水中时正极生成无毒气体,电极反应式为:;
(3)TiO·TiC固溶体作阳极,发生失电子的氧化反应,生成Ti2+和CO,其电极反应为TiO·TiC-4e-=2Ti2++CO;
(4)①Sn2+具有还原性,能被K2Cr2O7氧化,从而导致K2Cr2O7消耗偏多,则样品中铁的质量分数的测定结果将偏大;
②将亚铁离子氧化为铁离子,自身被还原为Cr3+,消耗一个转移6个电子,氧化一个亚铁离子转移一个电子,根据转移电子守恒可得关系式,则,Fe元素质量,则样品中铁的质量分数。
16.(1) 放热 a
(2)2A(g)+B(g) 2C(g)
(3)0.1mol·L-1·min-1
(4)d
(5)①
(6)
(7)减弱
(8)18
【详解】(1)①根据反应过程中,断键时吸收能量,形成键的时候放热,工业合成氨反应N2+3H22NH3中,断裂键需要的能量时945+3×436=2253kJ,形成键时放出的能量是6×391=2346kJ,故放出的多,放出了能量为93kJ,该反应是放热反应,故答案为放热;
②由于该反应是可逆反应,实际反应放出的热量小于理论值,故Q1>2Q2,故选a;
(2)根据图像判断,减小的物质是反应物,增大的物质生成物,变化量之比是化学计量数之比,反应的A、B、C物质的量之比为(5-3): (2-1): (4-2)=2:1:2;且因为2min后各物质都存在,且物质的量不变,说明达到该反应是可逆反应,故方程式为:2A(g)+B(g) 2C(g);
(3)反应开始至2min时,B的平均反应速率 mol·L-1·min-1;
(4)a.速率没有说明正逆,不能判断是否达到平衡装置,a不符合题意;
b.容器体积和气体总质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡,b不符合题意;
c.不同物质的速率比值不等于系数比,正逆反应速率不相等,不能说明达到平衡,c不符合题意;
d.容器内各物质浓度保持不变,说明平衡不再移动,能作为平衡标志,故d符合题意;
故选答案d;
(5)根据速率的影响因素进行判断,降低温度时速率会减小,加入正催化剂会加快反应速率,减小容器容积相当于增大物质浓度反应速率加快,故选①;
(6)乙装置中铝失去电子发生氧化反应生成偏铝酸根离子,为负极,负极反应式为;
(7)丙装置中总反应为甲烷和氧气、氢氧化钾反应生成碳酸钾,反应消耗氢氧根离子,故溶液碱性减弱;
(8)甲装置中两电极质量相等,反应时铁极溶解生成亚铁离子,Pt极上铜离子得到电子析出铜单质,导线中转移0.3 mol电子时,铁极减小0.15mol铁,质量为8.4g,Pt极析出0.15mol铜,质量为9.6g,两电极质量相差18g。
17. 2NaCl(熔融)2Na + Cl2 ↑ 4NaCl + Ti 2NaHCO3Na2CO3 + H2O + CO2↑
【分析】氯化钠电解生成钠和氯气,钠和四氯化钛生成钛、和钾形成钾钠合金;食盐水电解生成氯气、氢气和氢氧化钠;氯化钠和水、氨气、二氧化碳生成碳酸氢钠,碳酸氢钠受热生成碳酸钠和水、二氧化碳;
【详解】氯化钠电解生成钠和氯气,2NaCl(熔融)2Na + Cl2 ↑;
钠和四氯化钛生成钛和氯化钠,4Na+TiCl4(熔融) 4NaCl + Ti;
碳酸氢钠受热生成碳酸钠和水、二氧化碳,2NaHCO3Na2CO3 + H2O + CO2↑;
18.(1)
(2)将晶体置于气体氛围中脱水
(3)化合反应、分解反应、复分解反应
(4)阳极:;阴极:
【详解】(1)海水中含有较多的,通过结晶、过滤得到的固体物质主要是;
(2)在水溶液中会发生水解:,将晶体置于气体氛围中脱水,可以抑制的水解,从而得到;
(3)上述工艺流程涉及到的①是化合反应,③④是复分解反应,⑤⑥⑦是分解反应;
(4)电解熔融的,阳极是氯离子失电子生成氯气:,阴极是镁离子得电子生成镁单质:。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习—电解池,共24页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习:电解池,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习:电解池(含答案),共22页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。












