

所属成套资源:2024届高三新高考化学大一轮专题练习 (83份)
2024届高三新高考化学大一轮专题练习:原电池(含答案)
展开这是一份2024届高三新高考化学大一轮专题练习:原电池(含答案),共20页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:原电池
一、单选题
1.(2023春·江西·高三校联考阶段练习)党的二十大报告中指出:要“加强污染物协同控制,基本消除重污染天气”。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保二位一体的结合,可以解决酸雨等环境污染问题,原理如图所示。下列说法不正确的是
A.该电池放电时电子流向:电极负载电极
B.电极附近发生的反应:
C.放电过程中若消耗,理论上可以消除
D.移向电极,电极附近减小
2.(2023·全国·统考高考真题)一种以和为电极、水溶液为电解质的电池,其示意图如下所示。放电时,可插入层间形成。下列说法错误的是
A.放电时为正极
B.放电时由负极向正极迁移
C.充电总反应:
D.充电阳极反应:
3.(2023·安徽马鞍山·统考三模)某新型电池,可将CO2气体转化为CO和H2,其原理如图所示。下列说法正确的是
A.电极A为原电池的正极,发生氧化反应
B.放电过程中,H+由A极区向B极区迁移
C.若电路中转移0.6mol电子,生成的CO和H2共0.3mol
D.B极区液体为纯甘油
4.(2023·广东·校联考模拟预测)硫化氢(H2S)是强烈的神经毒素,对黏膜有强烈的刺激作用。科研人员设计了如图装置,借助太阳能,将H2S再利用,变废为宝。下列叙述正确的是
A.b电极发生氧化反应
B.a电极区不可用NaOH溶液作电解质溶液
C.的迁移方向为b电极→a电极
D.每生成2g H2,负极区需消耗22.4 L H2S
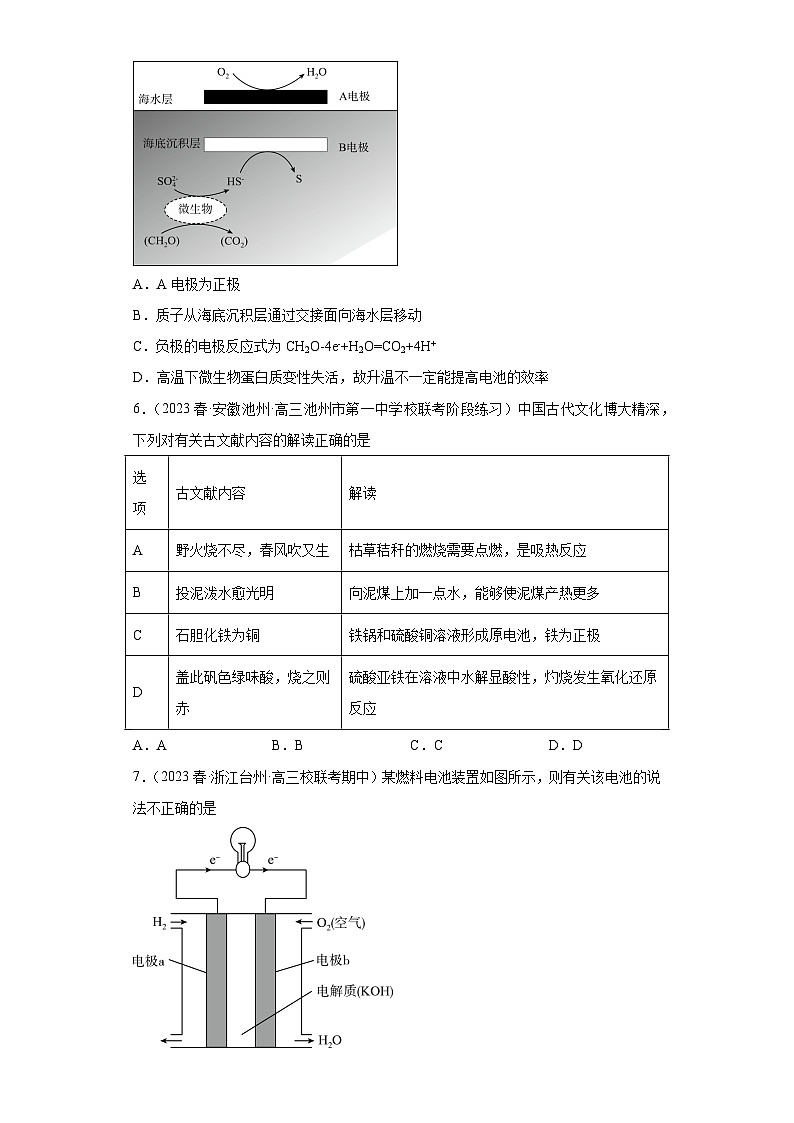
5.(2023春·四川南充·高三校考期中)我国科学家设计的“海泥电池”,既可用于深海水下仪器的电源补给,又有利于海洋环境污染治理,其中微生物代谢产物显酸性,电池工作原理如图所示。下列说法错误的是
A.A电极为正极
B.质子从海底沉积层通过交接面向海水层移动
C.负极的电极反应式为CH2O-4e-+H2O=CO2+4H+
D.高温下微生物蛋白质变性失活,故升温不一定能提高电池的效率
6.(2023春·安徽池州·高三池州市第一中学校联考阶段练习)中国古代文化博大精深,下列对有关古文献内容的解读正确的是
选项
古文献内容
解读
A
野火烧不尽,春风吹又生
枯草秸秆的燃烧需要点燃,是吸热反应
B
投泥泼水愈光明
向泥煤上加一点水,能够使泥煤产热更多
C
石胆化铁为铜
铁锅和硫酸铜溶液形成原电池,铁为正极
D
盖此矾色绿味酸,烧之则赤
硫酸亚铁在溶液中水解显酸性,灼烧发生氧化还原反应
A.A B.B C.C D.D
7.(2023春·浙江台州·高三校联考期中)某燃料电池装置如图所示,则有关该电池的说法不正确的是
A.根据电子移动方向,可知a极为电池的负极
B.该电池的总反应可表示为:2H2+O2=2H2O
C.b极发生的电极反应:O2+ 4e-+ 2H2O=4OH-
D.溶液中OH-由a极向b极移动
8.(2023春·湖北·高三校联考阶段练习)我国科研人员将脱除的反应与的制备反应相结合,实现协同转化。协同转化装置如图所示在电场作用下,双极膜中间层的解离为和,并向两极迁移。下列叙述错误的是
A.一段时间后,正极区域减小
B.将双极膜换成阳离子交换膜,该装置不能稳定、持续地工作
C.协同转化总反应为
D.当正极生成1 mol 时,负极区域的溶液质量增重98 g
9.(2023春·安徽阜阳·高三安徽省阜南实验中学校考阶段练习)如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸溶液
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A.A B.B C.C D.D
10.(2023·全国·高三专题练习)一种双膜二次电池放电时的工作原理如图所示,下列说法错误的是
A.充电时,极的电极反应式为
B.为阳离子交换膜,为阴离子交换膜
C.充电时的总反应:
D.放电时,每消耗(标准状况),理论上有电子通过用电器
11.(2023春·上海长宁·高三华东政法大学附属中学校考期中)铜锌原电池装置如图所示,下列分析不正确的是
A.使用盐桥可以清楚地揭示出电池中的化学反应
B.原电池工作时,Cu电极流出电子,发生氧化反应
C.原电池工作时,总反应为Zn+Cu2+=Zn2++Cu
D.原电池工作一段时间,右侧容器中的溶液增重
12.(2023春·重庆巫溪·高三巫溪县中学校校考阶段练习)一种高性价比的液流电池,其工作原理为在充放电过程中,在液泵推动下,电解液[KOH、K2Zn(OH)4]不断流动,发生以下反应:Zn+2NiOOH+2H2O+2OH-Zn(OH)+2Ni(OH)2,
下列说法错误的是
A.放电时,电极B发生还原反应
B.储液罐中KOH浓度减小时,OH-移向电极A
C.充电时,电极B的电极反应式: OH- + Ni(OH)2 - e- = NiOOH + H2O
D.放电时,电子由电极A经电解质溶液转移至电极B
二、多选题
13.(2023·山东·统考高考真题)利用热再生氨电池可实现电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
A.甲室电极为正极
B.隔膜为阳离子膜
C.电池总反应为:
D.扩散到乙室将对电池电动势产生影响
14.(2023春·海南海口·高三海南中学校考期中)新型镁-锂双离子二次电池的工作原理如图。下列关于该电池的说法正确的是
A.放电时,Li+通过离子交换膜向右移动
B.放电时,Li1-yFePO4/LiFePO4一极电极反应式为Li1-yFePO4+yLi+-ye-=LiFePO4
C.充电时,与电源的正极相连
D.充电时,导线上每通过0.4mole-,左室中溶液的质量减少2g
三、非选择题
15.(2023春·广东深圳·高三校联考期中)减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物,在生产生活中有重要意义。
Ⅰ.雾霾严重影响人们生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g)⇌N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是_______。
A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒容条件下,混合气体的密度保持不变
E.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
(2)在催化转化器中,汽车尾气中CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间变化如图所示。
①实验b从开始至平衡时的反应速率v(CO)=_______mol·L-1·min-1。
②实验a中NO的平衡转化率为_______。
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,工作原理如图所示。
(3)回答下列问题:
①该燃料电池中正极通入的物质是_______,负极发生的反应式为_______。
②电池工作时,OH-移向_______电极(填“a”或“b”)。
16.(2023春·江苏无锡·高三长春市解放大路学校校联考期中)某化学兴趣小组进行如图所示实验,以检验化学反应中的能量变化。
请回答下列问题:
(1)反应①的离子方程式是___________;反应②的化学方程式___________。
(2)②中的温度___________(填“升高”或“降低”)。反应___________(填“①”或“②”)的能量变化可用图表示。
(3)现有如下两个反应:
A.
B.
①A反应不能设计成原电池的原因是___________。
②利用B反应可设计成原电池,该电池负极的电极反应式为___________,可用作该电池正极材料的是___________(填字母)。
a.碳棒 b.铁片 c.铜片 d.铂棒
(4)用和组合形成的质子交换膜燃料电池的结构如图:
则d电极是燃料电池的___________(填“正极”或“负极”),此电极的电极反应式为___________。
17.(2023春·北京大兴·高三统考期中)回答下列问题。
(1)补齐物质及其用途的连线。
________________。
(2)化学电池的发明,是贮能和供能技术的巨大进步。
①上图所示装置中,片作___________(填“正极”或“负极”),片上发生反应的电极反应式为___________。
②上图所示装置可将___________(写离子反应方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是___________。
(3)镁、石墨、海水溶解氧可构成原电池,为水下小功率设备长时间供电,其结构示意图如下图所示。该原电池的总反应为:。
下列说法正确的是___________(填字母)。
a.石墨是电池的负极
b.发生氧化反应
c.当有参与反应时转移电子
18.(2023春·河南濮阳·高三濮阳外国语学校校考期中)依据原电池原理,请回答下列问题。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池属于___________(填“一次电池”或“二次电池”),锌锰电池的正极材料是___________,负极发生的电极反应式为___________。若反应消耗19.5g负极材料,则电池中转移电子的数目为___________。
(2)以Al、Mg为电极,可以组装如图所示原电池装置。
①若电解质溶液为稀硫酸,Mg上发生的电极反应式为___________。
②若电解质溶液为NaOH溶液,Al上发生的电极反应式为___________。
(3)微型锌银电池可用作电子仪器的电源,其电极分别是Ag/和Zn,电解质溶液为KOH溶液,电池总反应为。负极发生的电极反应式为___________,电池工作过程中,电解液中向___________(填“Ag/”或“Zn”)极迁移。
参考答案:
1.C
【分析】由图可知,Pt1电极上SO2发生失电子的氧化反应转化成H2SO4,Pt1电极为负极,Pt2电极为正极,Pt2电极上O2发生得电子的还原反应;据此作答。
【详解】A.根据分析,Pt1电极为负极,Pt2电极为正极,该电池放电时电子的流向为Pt1电极→负载→Pt2电极,A项正确;
B.Pt1电极上SO2发生失电子的氧化反应转化成H2SO4,电极反应式为SO2-2e-+2H2O=+4H+,B项正确;
C.Pt2电极的电极反应式为O2+4e-+4H+=2H2O,由于O2所处温度和压强未知,不能计算22.4LO2物质的量,从而无法计算消除SO2物质的量,C项错误;
D.阳离子H+移向正极(Pt2电极),Pt1电极上的电极反应式为SO2-2e-+2H2O=+4H+,Pt1电极上每消耗1molSO2生成4molH+和1mol,为平衡电荷,有2molH+通过质子交换膜移向Pt2电极,Pt1电极附近c(H+)增大,pH减小,D项正确;
答案选C。
2.C
【分析】由题中信息可知,该电池中Zn为负极、为正极,电池的总反应为。
【详解】A.由题信息可知,放电时,可插入层间形成,发生了还原反应,则放电时为正极,A说法正确;
B.Zn为负极,放电时Zn失去电子变为,阳离子向正极迁移,则放电时由负极向正极迁移,B说法正确;
C.电池在放电时的总反应为,则其在充电时的总反应为,C说法不正确;
D.充电阳极上被氧化为,则阳极的电极反应为,D说法正确;
综上所述,本题选C。
3.C
【分析】原电池中A电极是CO2气体转化为CO和H2,发生的反应为CO2+4H++4e-=CO+ H2+ H2O,因此A电极是作为原电池的正极,那么B电极观察反应物与生成物结构可知,去氢加氧属于是氧化反应,据此作答。
【详解】A.根据图可知,A电极中有CO2气体转化为CO和H2,因此发生的是还原反应,作为原电池的正极,故A错误;
B.在电极A发生的反应为CO2+4H++4e-=CO+ H2+ H2O,H+由B区向A区迁移,故B错误;
C.根据电极A的反应可知,转移4mole-时生成CO和H2共2mol,则转移0.6mol电子时生成CO和H2共0.3mol,故C正确;
D.B极区不仅含有甘油,还有其产物,是混合物,故D错误;
故答案选C。
4.B
【分析】根据工作原理图分析可知,b电极上H+获得电子生成氢气,则b作正极,电极反应式为2H++2e-=H2↑,因此a作负极,Fe2+失去电子,电极反应为Fe2+-e-=Fe3+,据此分析解答问题。
【详解】A.由分析可知,b作正极,电极反应式为2H++2e-=H2↑,则b电极发生还原反应,A错误;
B.由分析可知,a电极区反应为:Fe2+-e-=Fe3+,若用NaOH溶液作电解质溶液则生成Fe(OH)2、Fe(OH)3覆盖在电极a上,阻止反应继续进行,B正确;
C.由分析可知,a电极为负极,b电极为正极,故的迁移方向为负极a电极→正极b电极,C错误;
D.题干未告知H2S所处的状态是否为标准状况,故无法计算每生成2g H2,负极区需消耗H2S的体积,D错误;
故答案为:B。
5.C
【分析】由图可知,A极物质由氧气转化为水,化合价降低,所以A极是正极,B极是负极,据此解答。
【详解】A.由分析可知,A极是正极,B极是负极,故A正确;
B.由分析可知,A极是正极,B极是负极,质子带正电荷,放电时向正极移动,所以质子从海底沉积层通过交接面向海水层移动,故B正确;
C.CH2O在微生物作用下与硫酸根离子反应生成CO2和HS-,并不是在负极的电极反应,负极上HS-失去电子发生氧化反应生成硫单质,电极反应式为:HS--2e-=S↓+H+,故C错误;
D.微生物蛋白质高温条件下会失活,故升温不一定能提高电池的效率,故D正确;
故选C。
6.D
【详解】A.燃烧是放热反应,和反应条件无关,A错误;
B.碳和水蒸气反应是吸热,产生的CO和燃烧火焰明亮,但是总热量不变,B错误;
C.铁失电子发生氧化反应,为负极,C错误;
D.绿色的属于强酸弱碱盐,水解显酸性,火烧之后会转化为红色的氧化铁,发生氧化还原反应,D正确;
故选D。
7.D
【分析】从图看电极a为电子流出的极为负极,b为正极。
【详解】A.利用电子的移动方向判断,A项正确;
B.该电池为H2燃料电池,总反应为2H2+O2=2H2O,B项正确;
C.b极为正极O2发生还原反应O2+ 4e-+ 2H2O=4OH-,C项正确;
D.原电池中离子的移动方向:阳离子移向正极,阴离子移向负极,即OH-由b极移向a极,D项错误;
故选D。
8.A
【分析】由图示可知左侧电极亚硫酸根离子失电子生成硫酸根离子,左侧为负极,右侧电极上氧气得电子生成过氧化氢,右侧为正极,双极膜在电场作用下将水解离成氢离子和氢氧根离子,分别向正极和负极移动,据此分析解答。
【详解】A.正极区域反应:2H++O2+2e-=H2O2,消耗H+的量等于迁移过来H+的量,不变,故A错误;
B.由电极反应可知正极区消耗氢离子,负极区消耗氢氧根离子,双极膜通过解离水可向两级区分别提供氢氧根离子和氢离子,若换成阳离子交换膜,则无法向两极提供氢氧根离子和氢离子,使得装置不能稳定、持续工作,故B正确;
C.由图可知,二氧化硫和氧气最终转化为H2O2和,故协同转化总反应为,故C正确;
D.当正极生成1mol H2O2时,负极区域的溶液质量增重64g+2×17g =98g,故D正确;
故选:A。
9.C
【分析】电流计指针偏转,M棒变粗,N棒变细,说明M、N与池中液体构成了原电池。N棒变细,作负极,M棒变粗,说明溶液中的金属阳离子在M极上得到电子,生成金属单质,M变粗,M做原电池的正极。
【详解】A.如果是锌、铜、稀硫酸构成原电池,则电池总反应式为Zn+2H+=Zn2++H2↑,Zn作负极,M极变细,A项错误;
B.如果是铁、铜、稀盐酸构成原电池,电池总反应式为Fe+2H+= Fe2++H2↑,则铁是负极,铜棒M是不会变粗的,B项错误;
C.如果是银、锌、硝酸银溶液构成原电池,电池总反应式为Zn+2Ag+=Zn2++2Ag,则锌是负极,N棒变细,析出的银附在银上,M棒变粗,C项正确;
D.如果是锌、铁、硝酸铁溶液构成原电池,电池总反应式为Zn+2Fe3+=2Fe2++Zn2+,Zn作负极,M极变细,D项错误;
故选C。
10.B
【分析】由图可知,放电时Fe2+在M极失去电子生成Fe3+,则M是负极,Cl2在N极得到电子生成Cl-,则N极为正极,以此解答。
【详解】A.放电时Fe2+在M极失去电子生成Fe3+,M是负极,则充电时,Fe3+在M极得到电子生成Fe2+,电极方程式为:,故A正确;
B.放电时Fe2+在M极失去电子生成Fe3+,即FeCl2转化为FeCl3,NaCl溶液中的Cl-要通过X进入M极区,为阴离子交换膜;Cl2在N极得到电子生成Cl-,由电荷守恒可知,NaCl溶液中的Na+要通过Y进入N极区,Y为阳离子交换膜,故B错误;
C.放电时Fe2+在M极失去电子生成Fe3+,Cl2在N极得到电子生成Cl-,则充电时,FeCl3转化为FeCl2和Cl2,总反应:,故C正确;
D.放电时,Cl2在N极得到电子生成Cl-,电极方程式为:Cl2+2e-=2Cl-,标准状况下2.24L的物质的量为0.1mol,转移0.2mole-,理论上有电子通过用电器,故D正确;
故选B。
11.B
【分析】该原电池中锌为负极,铜为正极。
【详解】A.使用盐桥能使电池的正负极的反应分开,清楚电池中的化学反应,A正确;
B.原电池工作时,铜电极为正极,发生还原反应,B错误;
C.锌为负极,铜为正极,总反应为锌和硫酸铜反应生成硫酸锌和铜,反应为Zn+Cu2+=Zn2++Cu,C正确;
D.右侧溶液中铜离子得到电子生成铜,每转移2mol电子,有1mol铜析出,减少64克,有盐桥中的2mol钾离子进入溶液中,溶液质量增加78克,故溶液的质量增加78-64=14克,D正确;
故选B。
12.D
【分析】放电时电极A做负极,电极反应式为:Zn+4OH--2e-=,电极B做正极,电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH-,充电时则与放电相反,即A做阴极,电极反应为+2e-=Zn+4OH-,B做阳极,电极反应为Ni(OH)2+OH--e-=NiOOH+H2O。
【详解】A.由分析知,放电时电极B做正极,电极反应式为:NiOOH+H2O+e-= Ni(OH)2+OH-,发生还原反应,A正确;
B.根据总反应可知放电时消耗OH-,即储液罐中的KOH浓度减少时为原电池,原电池反应过程中电解质溶液中阴离子向负极移动,因此氢氧根离子向电极A移动, B正确;
C.充电时,电极B做阳极,电极反应式:Ni(OH)2+OH--e-= NiOOH+H2O,C正确;
D.在原电池中,电子不能通过电解质溶液,D错误;
故答案选D。
13.CD
【详解】A. 向甲室加入足量氨水后电池开始工作,则甲室电极溶解,变为铜离子与氨气形成,因此甲室电极为负极,故A错误;
B. 再原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正常进行,故B错误;
C. 左侧负极是,正极是,则电池总反应为:,故C正确;
D. 扩散到乙室会与铜离子反应生成,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,故D正确。
综上所述,答案为CD。
14.AD
【分析】从图中可以看出,Mg电极上,Mg-2e-=Mg2+,则Mg为负极,Li1-yFePO4为正极。
【详解】A.放电时,阳离子向正极移动,则Li+通过离子交换膜向右移动,A正确;
B.放电时,Li1-yFePO4/LiFePO4一极为正极,Li1-yFePO4得电子与Li+反应生成LiFePO4,电极反应式为Li1-yFePO4+yLi++ye-=LiFePO4,B错误;
C.放电时,Mg极为负极,则充电时,Mg极为阴极,与电源的负极相连,C错误;
D.充电时,Mg极为阴极发生反应:Mg2++2e-=Mg,导线上每通过0.4mole-,左室溶液中放电的Mg2+为0.2mol,质量为4.8g,同时阳极有0.4molLi+移入左室溶液中,Li+质量为0.4mol×7g/mol=2.8g,则左室中溶液的质量减少4.8g-2.8g=2g,D正确;
故选AD。
15.(1)BDE
(2) 2.5×10-4 60%
(3) 空气 N2H4+4OH--4e-=N2↑+4H2O a
【详解】(1)A.由反应方程式知当时反应达到平衡,故A不符合题意;
B.混合气体中的体积分数保持不变时,说明消耗的氮气和生成的氮气相等,反应达到平衡状态,故B符合题意;
C.由方程式知单位时间内断裂1个同时生成2个C=O,说明正逆反应速率相等,反应达到平衡,故C不符合题意;
D.由方程式知,反应有固体参加,恒温、恒容条件下,混合气体的密度保持不变时,混合气体的质量不再变化,说明反应达到平衡,故D符合题意;
E.由方程式知,反应前后气体的总物质的量不变,当混合气体的平均摩尔质量保持不变时,说明气体的总质量不再变化,反应达到了平衡,故E符合题意;
故答案为:BDE
(2)起始时充入0.4molCO、0.2molNO,发生,设转化的CO为nmol,则,由压强之比等于物质的量之比得,解得n=0.1mol,所以实验b从开始至平衡时的反应速率v(CO)=;
②设转化的NO为xmol,则,由压强之比等于物质的量之比得,解得x=0.12mol,实验a中NO的平衡转化率为;
(3)①肼—空气燃料电池中肼中氮元素为-2价升高到氮气中的0价,发生氧化反应,所以通入肼的一极为负极,电极反应式为,通入空气的一极为正极;
②根据①分析a极为负极,b极为正极,对于原电池来说,阴离子移向负极,所以电池工作时,移向a电极;
16.(1) 或者
(2) 降低 ①
(3) A反应不是氧化还原反应 ad
(4) 正极
【详解】(1)Al和HCl溶液发生反应生成AlCl3和H2,离子方程式为:;Ba(OH)2•8H2O与NH4Cl反应生成BaCl2、NH3和H2O,化学方程式为:或者。
(2)Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,②中的温度降低,图中反应物的总能量大于生成物的总能量,可以表示放热反应,Al与HCl反应是放热反应,所以①的能量变化可用图2表示。
(3)①自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;
②利用反应可设计成原电池,该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,可用作该电池正极材料的是碳棒或铂棒,故选ad;电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+。
(4)由电子移动的方向可知,d电极是燃料电池的正极,O2在正极得电子生成H2O,电极方程式为:4H++O2+4e-=2H2O。
17.(1)
(2) 负极 电流表指针发生偏转,铜片表面有气泡
(3)bc
【详解】(1)过氧化钠可用作供氧剂,二氧化硫可用于制硫酸,液氨汽化吸收大量的热可用作制冷剂,二氧化硅可用作光导纤维。
(2)①Zn的金属活动性强于Cu,故Zn片作负极,Cu为正极,电解质溶液为稀硫酸,则Cu上发生反应的电极方程式为2H++2e-=H2↑。
②上图装置中总反应为Zn+2H+=Zn2++H2↑,将该反应释放的能量直接转变为电能,电流计的指针发生偏转,铜片表面有气泡生成即可证明产生电能。
(3)a.根据总方程式可知,Mg失电子转化为Mg(OH)2,则镁电极为负极,石墨电极为正极,a错误;
b.Mg失电子生成Mg(OH)2,Mg为还原剂发生氧化反应,b正确;
c.石墨电极上发生反应为O2+4e-+2H2O=4OH-,当有1molO2参与反应,转移电子数为4mol,c正确;
故答案选bc。
18.(1) 一次电池 石墨 (或0.6)
(2)
(3) Zn
【详解】(1)锌锰干电池只能一次性使用,不能充电,属于一次电池,锌锰电池中锌较活泼,锌失去电子发生氧化反应为正极,石墨为正极;负极发生的电极反应式为;若反应消耗19.5g负极材料,反应锌0.3mol,则电池中转移电子0.6mol,电子数目为(或0.6);
(2)①若电解质溶液为稀硫酸,Mg失去电子发生氧化反应,为负极,发生的电极反应式为。
②若电解质溶液为NaOH溶液,镁不能和氢氧化钠反应,Al失去电子发生氧化反应,为负极,发生的电极反应式为;
(3)由总反应可知,锌失去电子发生氧化反应生成氢氧化锌,为负极,;原电池中阴离子向负极迁移,故电池工作过程中,电解液中向Zn极迁移。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习:原电池,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习—原电池,共25页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习—原电池(含答案),共23页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。












