
所属成套资源:2024届高三新高考化学大一轮专题练习 (83份)
2024届高三新高考化学大一轮专题练习:原电池
展开这是一份2024届高三新高考化学大一轮专题练习:原电池,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:原电池
一、单选题
1.(2023春·湖南长沙·高三雅礼中学校考期中)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。下列说法正确的是
A.该微生物燃料电池,负极为b
B.为保证该电池的供电速度,应在较高温度下工作
C.当电路中有0.5mol电子发生转移,则有1mol的通过质子交换膜
D.该电池正极电极反应式为
2.(2023春·四川乐山·高三四川省峨眉第二中学校校考阶段练习)Fe-Cu原电池的示意图如图,电池工作时,下列说法正确的是
A.Fe电极为正极
B.Cu电极上发生还原反应
C.移向Fe电极
D.外电路中电子的流动方向:Cu→导线→Fe
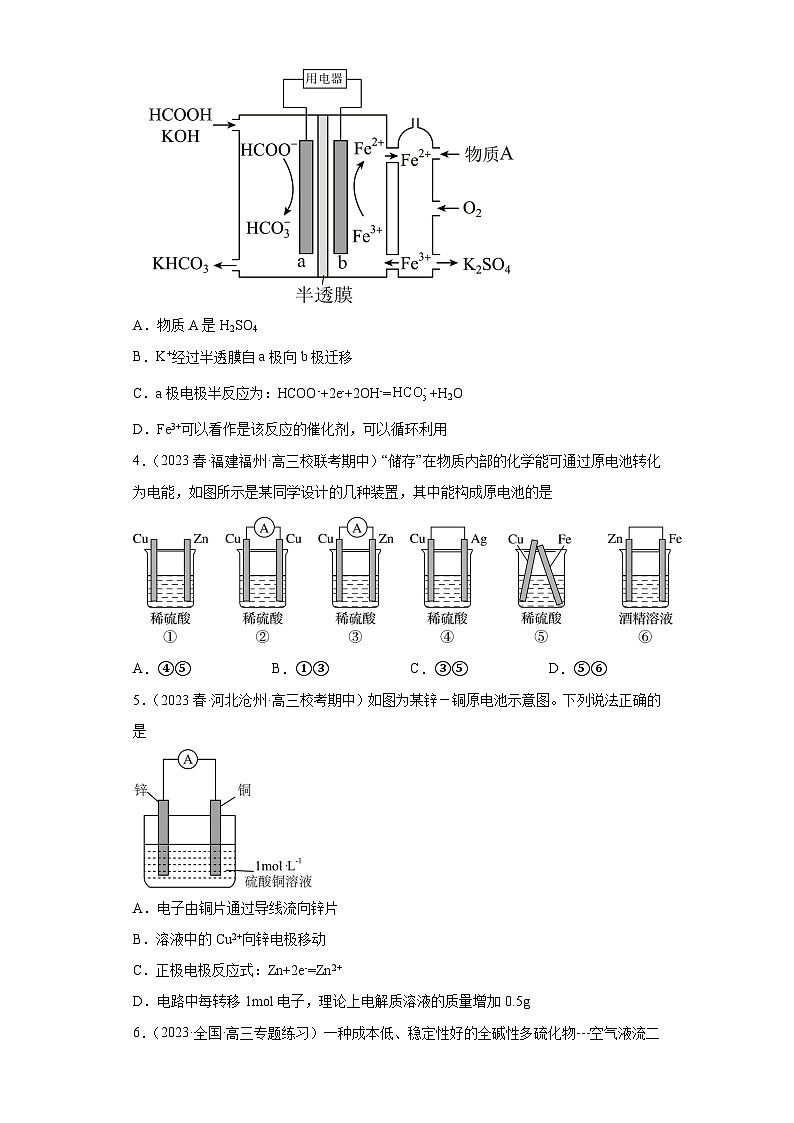
3.(2023·安徽宣城·统考二模)甲酸燃料电池工作原理如下图所示,已知该半透膜只允许K+通过。下列有关说法错误的是
A.物质A是H2SO4
B.K+经过半透膜自a极向b极迁移
C.a极电极半反应为:HCOO-+2e-+2OH-=+H2O
D.Fe3+可以看作是该反应的催化剂,可以循环利用
4.(2023春·福建福州·高三校联考期中)“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是
A.④⑤ B.①③ C.③⑤ D.⑤⑥
5.(2023春·河北沧州·高三校考期中)如图为某锌-铜原电池示意图。下列说法正确的是
A.电子由铜片通过导线流向锌片
B.溶液中的Cu2+向锌电极移动
C.正极电极反应式:Zn+2e-=Zn2+
D.电路中每转移1mol电子,理论上电解质溶液的质量增加0.5g
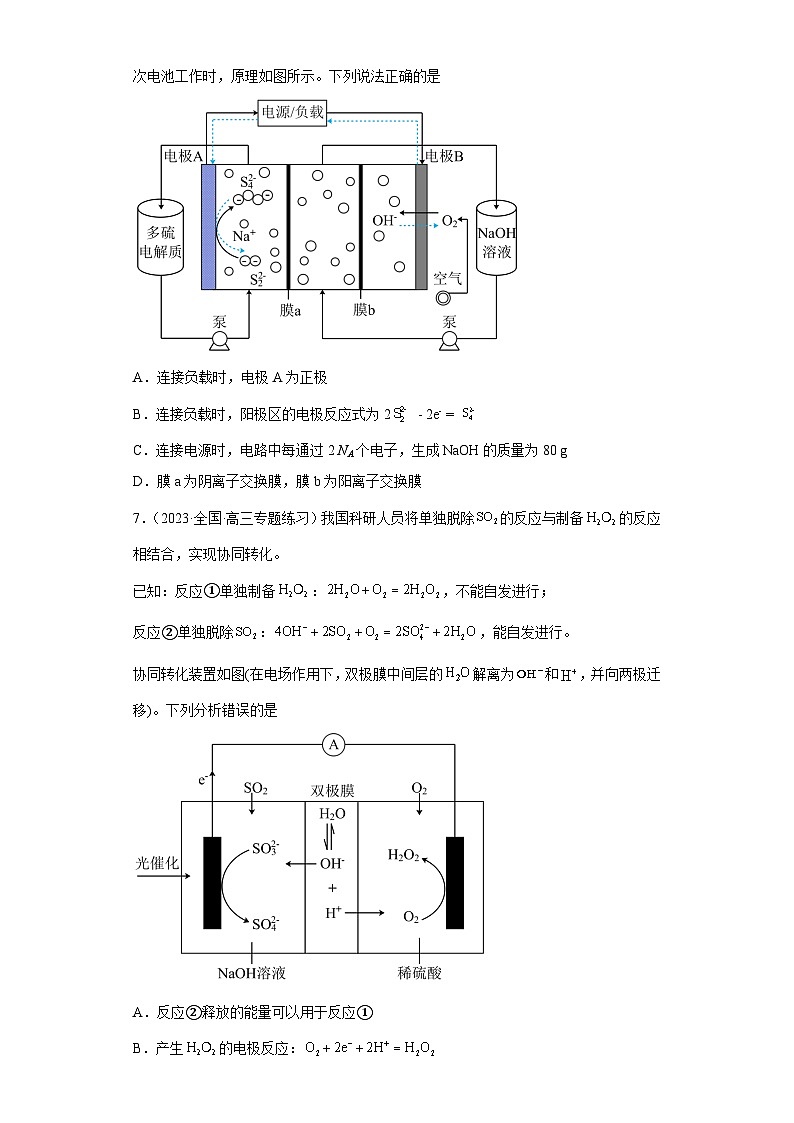
6.(2023·全国·高三专题练习)一种成本低、稳定性好的全碱性多硫化物---空气液流二次电池工作时,原理如图所示。下列说法正确的是
A.连接负载时,电极A为正极
B.连接负载时,阳极区的电极反应式为2 - 2e- =
C.连接电源时,电路中每通过2 NA个电子,生成NaOH的质量为80 g
D.膜a为阴离子交换膜,膜b为阳离子交换膜
7.(2023·全国·高三专题练习)我国科研人员将单独脱除的反应与制备的反应相结合,实现协同转化。
已知:反应①单独制备:,不能自发进行;
反应②单独脱除:,能自发进行。
协同转化装置如图(在电场作用下,双极膜中间层的解离为和,并向两极迁移)。下列分析错误的是
A.反应②释放的能量可以用于反应①
B.产生的电极反应:
C.当生成0.1 mol 时,负极区溶液质量增重9.8 g
D.协同转化总反应:
8.(2023·浙江金华·校联考模拟预测)一种在300℃下工作的新型锂——二硫化亚铁热电池的截面结构如图所示,LLZTO导体管只允许Li+通过。当用1.8V电压充电后,电池正极材料中S、Fe的原子个数比为1.02(不计Li2S,下同);2.3V电压充电后,S、Fe的原子个数比为2.01。下列说法不正确的是
A.Al2O3绝缘体隔离正负极,使化学能有效的转化为电能
B.电池工作时,负极发生反应:2Li+S2−−2e-=Li2S
C.电池正级材料的变化为FeS2FeSFe
D.电池总反应可表示为2xLi+FeS2xLi2S+FeS2−x
9.(2023春·江苏南通·高三校联考阶段练习)微生物电池的总反应为:C6H12O6+6O2=6CO2+6H2O,其工作原理如图所示。下列有关微生物电池的说法错误的是
A.放电时正极产生CO2气体
B.微生物所在电极区放电时发生氧化反应
C.电池工作时,质子移向O2所在电极
D.O2所在电极区发生反应为:O2+4H++4e-=2H2O
10.(2023春·广东广州·高三广东广雅中学校考阶段练习)一种气体报警器的结构如图所示,工作时被检测的气体在敏感电极上发生反应,传感器就会接收到电信号。常见的传感器(被检测气体/产物)有:、、等,下列说法中正确的是
A.上述气体被检测时,敏感电极均作电池正极
B.检测CO气体时,电解质溶液中的阳离子流向敏感电极
C.检测CH4气体时,对电极充入空气,该电极反应式可以为:
D.检测Cl2气体时,电流离开对电极流向传感器
11.(2023春·辽宁朝阳·高三凌源市实验中学校考阶段练习)已知在同一电池中,正极电势高于负极电势。Hg-Hg2SO4标准电极常用于测定其它电极的电势,测知Hg-Hg2SO4电极的电势高于Cu电极的电势。以下说法不正确的是
A.K2SO4溶液可用Na2SO4溶液代替
B.微孔瓷片起到阻隔离子通过的作用
C.Hg-Hg2SO4电极反应为Hg2SO4+2e-=2Hg+
D.若把Cu-CuSO4体系换作Zn-ZnSO4体系,电压表的示数变大
12.(2023·江苏南通·统考二模)卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石()中,与浓反应可制取HF;氯、溴主要存在于海水中,工业常通过电解NaCl饱和溶液制备,可用于制取漂白粉。卤水中可通过氧化、溶液吸收;BrCl能发生水解反应。易升华,一种二次电池正极界面反应机理如图所示。
下列化学反应表示正确的是
A.电池正极放电时的电极反应有:
B.电解饱和NaCl溶液:
C.BrCl与反应:
D.用溶液吸收:
13.(2023·广东·高三专题练习)我国科学家设计了一种新型的溴基液流可充电电池用于大规模储能,其放电时的工作原理如图所示。下列有关说法不正确的是
A.放电时,M为正极
B.放电时,N极发生的电极反应为Br-+2Cl--2e-=
C.充电时,每生成1molTiO2+,有2molH+穿过质子交换膜进入N极室
D.充电时,总反应为2Ti3+++2H2O=2TiO2++Br-+2Cl-+4H+
14.(2023·江西鹰潭·统考一模)利用垃圾假单胞菌株分解有机物的电化学原理如图所示。下列说法正确的是
A.电子流向:电极B→负载→电极A
B.若有机物为葡萄糖,处理0.25mol有机物,电路中转移电子6mol
C.电极A上的反应式为: X-4e- = Y +4H+
D.若B电极上消耗氧气22.4L, B电极区域溶液增重36g
二、非选择题
15.(2023·全国·高三专题练习)完成下列小题
(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:
正极为___________(填“A电极”或“B电极”),H+移动方向为由___________到___________(填“A”或“B”),写出A电极的电极反应式:___________。
(2)SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。
①a是直流电源的___________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为___________。
③用离子方程式表示吸收NO的原理___________。
(3)结合下图所示的电解装置可去除废水中的氨氮(次氯酸氧化能力强)。
①a极为___________。
②d极反应式为___________。
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5,VB2极发生的电极反应为___________。
16.(2023春·辽宁·高三校联考期中)燃料电池是利用燃料(如、CO、、、等)与反应从而将化学能转化为电能的装置。
(1)甲烷燃料电池(NaOH溶液作电解质溶液)的负极反应式为___________,正极反应式为___________,放电过程中溶液的pH___________(填“增大”“减小”或“不变”)。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下,下列有关说法正确的是___________。
a.电池工作时,向负极移动
b.电子由电极2经外电路流向电极1
c.电池总反应为
d.电极2发生的电极反应为
(3)铅酸蓄电池是常用的化学电源,其电极材料分别是Pb和,电解质溶液为稀硫酸,该电池工作时发生的总反应为。试回答下列问题。
①铅酸蓄电池的负极材料是___________,正极反应为___________。
②若有1mol电子从某电极流出,则参加反应的是___________mol,负极的质量变化是___________(填“增大”或“减小”)___________g。
17.(2023春·广东江门·高三江门市培英高级中学校考期中)化学电池在通信、交通及日常生活中有着广泛的应用。
(1)现有如下两个反应:A、;B、。
①根据两反应本质,判断能否设计成原电池。如果不能,说明其原因___________。
②如果可以,请在下面方框内画出原电池装置图,注明电极材料和电解质溶液等___________。
(2)中国科学院应用化学研究所在氢氧燃料电池技术方面获得新突破。氢氧燃料电池的工作原理如图所示。
①该电池工作时,b口通入的物质为___________。
②该电池负极的电极反应式为___________。
③工作一段时间后,当3.2g氢气完全反应生成时,有___________个电子转移。
18.(2023春·山东滨州·高三校考阶段练习)能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________(填字母)。
A.C(s)+H2O(g)=CO(g)+H2(g) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:
①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式___________,反应过程中溶液的酸性___________(填“变大”变小“或”不变“)。一段时间后,当在电池中放出1.68L(标准状况)气体时,电路中有___________个电子通过了导线(设NA为阿伏加德罗常数的值)。
②燃料电池是一种具有应用前景的绿色电源,氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:
a电极是___________极,将上图中的H2改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是___________。若线路中转移2mol电子,则该燃科电池理论上消耗的O2在标准状况下的体积为___________L。
参考答案:
1.D
【详解】A.该微生物燃料电池,b极通入氧气,氧气发生还原反应,则b为正极,故A错误;
B.为保证微生物的活性,该电池不能在较高温度下工作,故B错误;
C.根据电荷守恒,当电路中有0.5mol电子发生转移,则有0.5mol的通过质子交换膜,故C错误;
D.b极通入氧气,氧气发生还原反应,则b为正极,正极电极反应式为,故D正确;
选D。
2.B
【详解】A.Fe-Cu原电池中,Fe电极为负极,故A错误;
B.Fe-Cu原电池,Cu为正极,发生还原反应;故B正确;
C.Fe为负极,Cu为正极,正离子向正极移动,移向Cu电极,故C错误;
D.外电路中电子的流动方向:Fe→导线→Cu,故D错误;
故答案选B。
3.C
【分析】由图可知电池左边a为燃料HCOOH是负极,发生氧化反应;右边b为O2是正极,发生还原反应。
【详解】A.铁的两种离子存在环境为酸性,且生成物为K2SO4,故物质A为H2SO4,A正确,不符合题意;
B.阳离子K+由负极流向正极,B正确,不符合题意;
C.a极电极发生氧化反应,半反应为:HCOO-+2OH-=+H2O+2e-,C错误,符合题意;
D.Fe3+与Fe2+可以进行循环,可看作是该反应的催化剂,D正确,不符合题意。
故答案为:C。
4.C
【分析】构成原电池的基本条件是:自发的氧化还原反应、电极、电解质溶液、闭合回路。
【详解】A.④电极为铜、银,与电解质溶液稀硫酸均无氧化还原反应发生,无法形成原电池;⑤铜铁相连,可构成闭合回路,铁与稀硫酸可以发生自发的氧化还原反应,故可形成原电池,A错误;
B.①未形成闭合回路,不能构成原电池;③电极为锌、铜,锌与稀硫酸可发生氧化还原反应,且形成闭合回路,可以构成原电池,B错误;
C.③电极为锌、铜,锌与稀硫酸可发生氧化还原反应,且形成闭合回路,可以构成原电池;⑤铜铁相连,可构成闭合回路,铁与稀硫酸可以发生自发的氧化还原反应,故可形成原电池,C正确;
D.⑤铜铁相连,可构成闭合回路,铁与稀硫酸可以发生自发的氧化还原反应,故可形成原电池;⑥酒精为非电解质溶液,无法导电,无法构成闭合回路,故无法构成原电池,D错误;
故选C。
5.D
【分析】该原电池中Zn为负极失电子生成Zn2+,Cu为正极Cu2+得电子生成Cu。
【详解】A.Zn为负极,电子由Zn电极通过导线流向铜片,A错误;
B.溶液中的阳离子向正极移动,Cu2+向铜电极移动,B错误;
C.正极上Cu2+得电子生成Cu,电极反应式为Cu2++2e-=Cu,C错误;
D.电路中每转移1mol电子,负极区域电解质溶液中生成0.5molZn2+,正极区域电解质溶液中失去0.5molCu2+,则理论上电解质溶液的质量增加0.5g,D正确;
故答案选D。
6.B
【分析】该电池为碱性多硫化物---空气液流二次电池,所以放电时通入空气的一极为正极,即电极B为正极,电极A为负极,充电时电极B为阳极,电极A为阴极。
【详解】A.连接负载时为原电池,电极B为正极,A错误;
B.连接负载时为原电池,电极A为负极,发生氧化反应为阳极区,电极反应为2 - 2e- = ,B正确;
C.连接电源时为电解池,电极B反应为4OH--4e-=O2+2H2O,电极A反应为+ 2e- =2,不产生NaOH,C错误;
D.放电时,正极发生还原反应,反应为O2+2H2O+4e-=4OH-;负极发生氧化反应,反应为2 - 2e- = ;正极区氢氧根离子向左侧运动,离子交换膜b为阴离子交换膜;负极区钠离子向右侧运动,离子交换膜a为阳离子交换膜,D错误;
综上所述答案为B。
7.D
【分析】根据电子流向可知,左边电极为负极,电极反应式为SO2+4OH--2e-=SO+2H2O,右边电极为正极,电极反应式为O2+2H++2e-=H2O2。
【详解】A.反应②能自发进行,反应放出能量,反应①不能自发进行,需要吸收能量,反应②释放的能量可以用于反应①,故A正确;
B.由分析可知,O2在右侧电极得到电子生成H2O2,电极方程式为:,故B正确;
C.当正极生成0.1 mol 时,得到0.2mol电子,左边电极为负极,电极反应式为SO2+4OH--2e-=SO+2H2O,当得到0.2mol电子时,吸收0.1mol SO2,同时双极膜电离出0.2molOH-进入负极,负极区溶液质量增重0.1mol64g/mol+0.2mol17g/mol=9.8 g,故C正确;
D.负极电极反应式为SO2+4OH--2e-=SO+2H2O,正极电极反应为O2+2H++2e-=H2O2,协同转化总反应为: ,故D错误;
故选D。
8.B
【详解】A.为使化学能有效的转化为电能,需要用Al2O3绝缘体隔离正负极,故A正确;
B.根据LLZTO导体管只允许Li+通过,因此电池工作时,负极发生反应:Li−e-=Li+,故B错误;
C.根据用1.8V电压充电后,电池正极材料中S、Fe的原子个数比为1.02(不计Li2S,下同);2.3V电压充电后,S、Fe的原子个数比为2.01,说明电池正级材料的变化为FeS2FeSFe,故C正确;
D.根据在300℃下工作的新型锂——二硫化亚铁热电池,则电池总反应可表示为2xLi+FeS2xLi2S+FeS2−x,故D正确。
综上所述,答案为B。
9.A
【分析】葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O−24e−=6CO2+24H+,正极的电极反应式为O2+4e−+4H+═2H2O;原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区,以此解答该题。
【详解】A.据分析可知,放电时CO2气体在负极生成,故A错误;
B.微生物所在电极区为负极,发生氧化反应,故B正确;
C.据分析可知,负极上C6H12O6失电子,正极上O2得电子,质子通过交换膜从负极区移向正极区,故C正确;
D.正极上O2得电子和H+反应生成水,反应为:O2+4H++4e-=2H2O;故D正确;
故答案选A。
10.C
【详解】A.得到电子发生还原反应的电极为正极,上述气体CO中碳化合价升高,氯气化合价降低,部分气体中元素化合价上升,部分气体中元素化合价降低,因此被检测时,敏感电极不一定作电池正极,故A错误;
B.检测CO气体时,根据得到CO化合价升高,是原电池的负极,根据原电池“同性相吸”,则电解质溶液中的阳离子流向正极即对电极,故B错误;
C.检测CH4气体时,根据得到电解质溶液为碱性环境,对电极充入空气,该电极反应式可以为:,故C正确;
D.检测Cl2气体时,氯气得到电子生成氯离子,因此敏感电极为正极,电流从正极(敏感电极)流向负极(对电极),故D错误。
综上所述,答案为C。
11.B
【分析】Hg-Hg2SO4电极的电势高于Cu电极的电势,由Hg-Hg2SO4电极为正极,Cu电极为负极。
【详解】A.K2SO4溶液仅起增强导电性作用,所以可用Na2SO4溶液代替,A正确;
B.原电池工作时,溶液中发生离子的定向移动,所以微孔瓷片应允许离子通过,B不正确;
C.由分析可知,Hg-Hg2SO4为正极,则Hg2SO4得电子生成Hg等,电极反应为Hg2SO4+2e-=2Hg+,C正确;
D.若把Cu-CuSO4体系换作Zn-ZnSO4体系,由于Zn的失电子能力强于Cu,所以电势差增大,电压表的示数变大,D正确;
故选B。
12.A
【详解】A.由图示信息可知放电时正极转化有:、,电极反应有:,故A正确;
B.电解饱和NaCl溶液:,故B错误;
C.BrCl与反应:,故C错误;
D.溶于水生成HBr和HBrO,生成的酸与反应,吸收试剂过量,最终只生成碳酸氢钠:,故D错误;
故选:A。
13.C
【分析】从图中可以看出,放电时,M极TiO2+→Ti3+,Ti由+4价降低为+3价,则M极为正极,N极Br-→,Br元素由-1价升高到+1价,则N极为负极。
【详解】A.由分析可知,放电时,M为正极,A正确;
B.放电时,N极为负极,Br-失电子产物与电解质反应生成,发生的电极反应为Br-+2Cl--2e-=,B正确;
C.充电时,M极为阳极,发生反应Ti3+-e-+H2O=TiO2++2H+,依据电荷守恒,每生成1molTiO2+,有1molH+穿过质子交换膜进入N极室,C不正确;
D.由图中信息可知,充电时,Ti3+与反应生成TiO2+、Br-、Cl-等,总反应为2Ti3+++2H2O=2TiO2++Br-+2Cl-+4H+,D正确;
故选C。
14.B
【分析】由图可知,O2在电极B得电子生成H2O,则电极B为正极,电极方程式为:O2+4H++4e-=2H2O,电极A为负极,电极方程式为:X-2e- = Y +2H+,以此解答。
【详解】A.由题中信息可知该装置为原电池,A为负极,B为正极,电子由负极流出沿导线流入正极,所以电子流向:电极A→负载→电极B,A错误;
B.葡萄糖分子式C6H12O6,反应后生成CO2,C元素由0价升高到+4价,处理0.25mol有机物,电路中转移电子0.25mol×4×6=6mol,B正确;
C.由分析可知,电极A上的反应式为: X-2e- = Y +2H+,C错误;
D.未说明氧气是否处于标准状况,无法计算22.4L氧气的物质的量,D错误;
故选B。
15.(1) B电极 A B
(2) 负
(3) 负
(4)
【详解】(1)氧气得到电子发生还原反应为正极,故B电极为正极、A电极为负极,负极上二甲醚失去电子发生氧化反应生成二氧化碳和氢离子,;原电池中阳离子向正极迁移,故H+移动方向为由A到B;
(2)①由图可知,左侧亚硫酸氢根离子得到电子发生还原生成,为阴极区,则与其相连的a是直流电源的负极、b为正极。
②已知电解池的阴极室中溶液的pH在4~7之间为酸性,阴极区亚硫酸氢根离子得到电子发生还原生成,电极反应为。
③NO和发生氧化还原反应生成氮气和亚硫酸氢根离子,氮元素化合价由+2变为0、硫元素化合价由+3变为+4,结合电子守恒可知,反应为;
(3)图所示的电解装置可去除废水中的氨氮(次氯酸氧化能力强),根据题意可知,d极氯离子失去电子反应氧化反应生成次氯酸:,次氯酸将氨氮氧化而除去,d极为阳极,c为阴极,与阴极相连的a为负极;
①由分析可知,a极为负极。
②由分析可知,d极反应式为;
(4)由图可知,空气通入的a极为正极,氧气得到电子发生还原反应,则VB2极为负极,VB2失去电子在碱性条件下发生氧化反应生成B2O3、V2O5,反应为。
16.(1) O2+4e-+2H2O=4OH- 减小
(2)c
(3) Pb 1 增大 48
【详解】(1)甲烷燃料电池(NaOH溶液作电解质溶液)中,物质在负极失去电子化合价升高,所以负极反应式为,物质在正极得到电子化合价降低,所以正极反应式为,该燃料电池的总反应方程式为,生成水,溶剂增加,c(OH-)减小,所以放电过程中溶液的pH减小
(2)由图可知,电极1中N元素化合价升高,所以电极1为负极,则电极2为正极;
a.原电池中阳离子向正极移动,故a错误;
b.原电池外电路中电子由负极流向正极,所以应是故由电极1经外电路流向电极2,故b错误;
c.该液氨-液氧燃料电池的总反应为,故c正确;
d.电极2中O2得电子,化合价降低,且电解质溶液显碱性,所以电极反应为,故d错误;
故选c。
(3)化学电源中负极失去电子,化合价升高,正极得到电子,化合价降低;
①负极材料应为Pb,正极材料应为PbO2,反应为;
②根据总反应方程式可知2mol H2SO4~2mol e-,所以有1mol电子从某电极流出,则参加反应的是1mol;
负极反应式为,则有1mol电子流出时,负极增加了0.5mol ,质量为,所以负极的质量变化是增大48g。
17.(1) A为中和反应,不是氧化还原反应,不能设计成原电池
(2) 氢气 3.2NA
【详解】(1)①自发的氧化还原反应可以设计成原电池;A为中和反应,不是氧化还原反应,不能设计成原电池;B为自发的氧化还原反应,可以设计成原电池;
②B为自发的氧化还原反应,可以设计成原电池;反应中铜失去电子发生氧化反应,为负极,银离子在正极得到电子发生还原反应生成银单质,装置可以为: ;
(2)①原电池中阳离子向正极迁移,则右侧电解为正极、左侧为负极;该电池工作时,b口通入的物质为氢气,氢气失去电子发生氧化反应生成氢离子,。
②该电池负极的电极反应式为。
③根据反应,工作一段时间后,当3.2g氢气(为1.6mol)完全反应生成时,转移电子3.2mol,有3.2NA个电子转移。
18.(1)C
(2) 2H ++2e- =H2↑ 变小 0.15NA 负 11.2
【详解】(1)设计原电池需要反应发生的是氧化还原反应,原电池的反应通常是放热反应,比较分析可知A为吸热反应,B为复分解反应,C为放热反应是氧化还原反应,所以C符合原电池设计原理的要求,故答案为C;
(2)若A为Zn片,B为石墨棒电解质溶液为稀硫酸,则Zn作负极,石墨作正极,正极的电极反应式为2H ++2e- =H2↑;反应过程中消耗H +,H +浓度降低,溶液酸性变小;当在电池中放出1.68L(标准状况)气体时,生成H2的物质的量为=0.075mol,根据2H ++2e- =H2↑可知,转移0.15mol电子,则电路中有0.15NA个电子通过了导线;
在碱性氢氧燃料电池中,通入燃料H2的电极a为负极;将上图中的H2改为甲醇就构成了碱性甲醇燃料电池,a电极上甲醇失去电子被氧化,在碱性环境中变为,故发生的电极反应式是;正极电极反应式为,根据电极反应可知,若线路中转移2mol电子,则该燃科电池理论上消耗的O2在标准状况下的体积为L。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习—原电池,共25页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习—原电池,共20页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习 原电池,共20页。试卷主要包含了多选题,单选题,非选择题等内容,欢迎下载使用。












