




第17讲 铝、镁及其化合物-2024年高考化学大一轮复习课件(新教材)
展开
这是一份第17讲 铝、镁及其化合物-2024年高考化学大一轮复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合等内容,欢迎下载使用。
1.了解镁、铝及其重要化合物的存在、性质和用途。2.掌握工业提取铝、镁的一般方法。
考点一 铝及其化合物
考点二 镁 海水提镁
考点一 铝 及 其 化 合 物
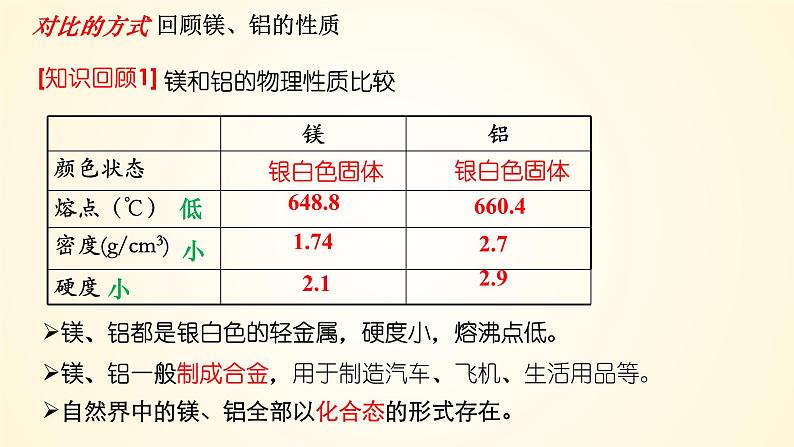
镁、铝都是银白色的轻金属,硬度小,熔沸点低。
镁、铝一般制成合金,用于制造汽车、飞机、生活用品等。
自然界中的镁、铝全部以化合态的形式存在。
对比的方式 回顾镁、铝的性质
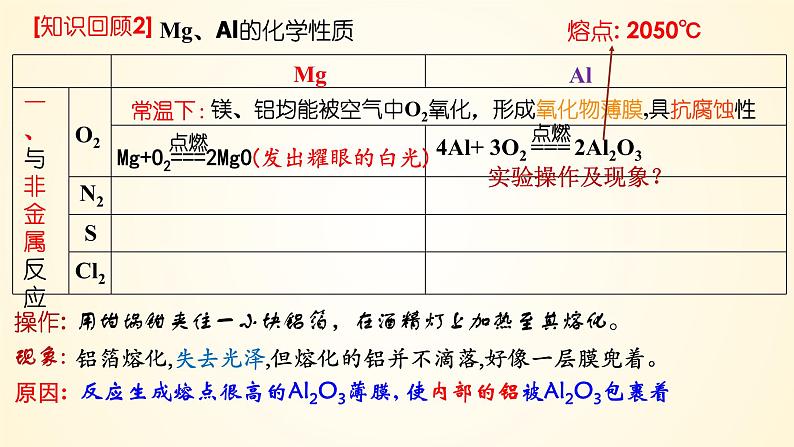
镁、铝均能被空气中O2氧化,形成氧化物薄膜,具抗腐蚀性
用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化。
铝箔熔化,失去光泽,但熔化的铝并不滴落,好像一层膜兜着。
反应生成熔点很高的Al2O3薄膜, 使内部的铝被Al2O3包裹着
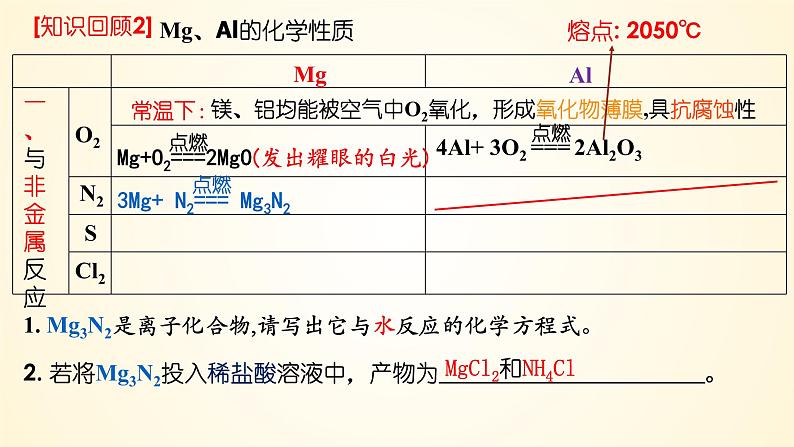
1. Mg3N2是离子化合物,请写出它与水反应的化学方程式。
2. 若将Mg3N2投入稀盐酸溶液中,产物为 。
MgCl2和NH4Cl
注意:Al2S3只在干态下生成,遇水发生双水解
Al2S3 + 6H2O = 2Al(OH)3↓+ 3H2S↑
除氧化膜后可与沸水微弱反应
铝和金属氧化物在高温下剧烈反应生成另一种金属,并放出大量热的化学反应。
2Al+6H2O=2Al(OH)3+3H2↑
镁着火不能用干粉灭火器和泡沫灭火器灭火
知识回顾: 铝热反应
剧烈反应,发出强光,纸漏斗被烧穿,沙子上落有红热的铁珠
2.镁条的作用是什么?3.氯酸钾的作用是什么?
(如Fe2O3 、V2O5、Cr2O3 、MnO2等)
1.引发该铝热反应的操作为 。
在铝热剂上加少量KClO3,插上镁条,并将其点燃
试写出铝分别与Fe3O4、MnO2、Cr2O3、V2O5发生的铝热反应
铝热反应在生产上的应用①用于焊接钢轨等;②冶炼铁、钒、铬、锰、镍等熔点高的金属。
说明: 铝只能与排在金属活动性顺序其后的金属氧化物反应。铝不能与MgO反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
在冷浓硝酸、浓硫酸中“钝化”,加热时反应,无H2生成
Mg+2H+=Mg2++H2↑
2Al+6H+=2Al3++3H2↑
2Al+2H2O+2OH- =2AlO2- + 3H2↑
Mg+Cu2+ = Mg2++Cu
2Al+3Cu2+ = 2Al3++3Cu
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
此反应中,还原剂是 ,氧化剂是 。
思考与讨论1:铝与强碱溶液反应的实质是?
该反应还原剂、氧化剂分别是何物质?
① 2Al + 6H2O = 2Al(OH)3 + 3H2↑
② 2Al(OH)3 + 2NaOH = 2NaAlO2 +4H2O
总: 2Al+ 6H2O + 2NaOH = 2NaAlO2 + 3H2↑+ 4H2O
请用“双线桥法”表示该反应中的电子转移情况!
1、电解质溶液为稀硫酸
2、电解质溶液为NaOH(aq)
2Al +8OH- - 6e- = 2AlO2-+4H2O
6H2O + 6e- = 6OH- +3H2↑
2Al +2OH- +6H2O= 2AlO2- + 3H2↑ +4H2O
Mg — 2e- = Mg 2+
思考与讨论2:思考下列装置是否构成原电池,能构成则写出其中的电极反应及总反应式。
注意:正、负极的判断受电解质溶液的影响,“较活泼金属”不一定做负极
1、下列关于铝的叙述中,不正确的是( )A.铝是地壳中含量最多的金属元素B.在常温下,铝不能与氧气发生反应C.铝是一种比较活泼的金属,在空气中易受腐蚀D.在化学反应中,铝容易失去电子,是还原剂E.铝箔在空气中受热可以熔化,且发生剧烈的燃烧F.铝既能与盐酸反应,又能与NaOH溶液反应,都能置换出H2
2、某无色溶液中放入铝片后有氢气产生,则下列离子在该溶液中一定不能大量存在的是( )A.Na+ B.Mg2+ C.OH- D.HCO3-
3. 将相同质量的镁条分别在①O2 ②空气 ③N2 ④CO2中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是( )A.②<①<③<④ B.④=①=②=③ C.③<②<①<④ D.③<①<②<④
② 以MgO为主(少量Mg3N2和微量C)
解析:假设镁条为1ml,则燃烧后所得固体产物分别为:
4.由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的H2在标准状况下为11.2L,则混合物中一定含有的金属是( )
A、锌 B、铁 C、铝 D、镁
“平均电子摩尔质量法”
解析:根据反应生成11.2L标况下的H2
反应中转移1mle—
∴金属混合物10g,需转移电子1mle-
5.用铝热法还原下列化合物,制得金属各1摩尔,消耗铝最少的是( ) A.MnO2 B.WO3 C. Fe3O4 D.Cr2O3 E.Fe2O3
反应的实质:铝失e—,氧化物得e—生成金属单质
KAl(SO4)2·12H2O
(1)物理性质:白色固体,难溶于水,有很高的熔点
氧化铝的天然产物俗称刚玉
(含少量铬元素的刚玉)
(含少量的铁和钛元素的刚玉)
(耐火坩埚、耐火管、耐高温的实验仪器等)
Al2O3+6H+ = 2Al3++3H2O
Al2O3+2OH- = 2AlO2-+H2O
白色难溶于水的离子化合物,高熔点,可作耐火材料
MgO + 2H+ = Mg2+ + H2O
②冶炼Al: .
(1)物理性质白色胶状不溶于水的固体,有较强的 性。
Al(OH)3+3H+ = Al3++3H2O
Al(OH)3+ OH— = AlO2— +2H2O
②受热分解: 。
只能存在于中性或弱酸性弱碱性环境中
AlO2-+H++H2O
可以吸附水中的悬浮物和各种色素
①向铝盐中加入氨水,离子方程式为 。②NaAlO2溶液中通入足量CO2,离子方程式为。③NaAlO2溶液与AlCl3溶液混合: 。
(3)制备Al(OH)3
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
AlO2—+CO2+2H2O = Al(OH)3↓+HCO3 —
3AlO2—+Al3++6H2O = 4Al(OH)3↓
AlO2—+CO2+ H2O
= Al(OH)3↓+ CO32 —
(反应实质: AlO2—和Al3+发生双水解反应)
既可以与强酸反应,又能与强碱溶液反应的物质有:
Al Al2O3 Al(OH)3
如:NaHCO3 NaHSO3 NaHS Na2HPO4等
如:(NH4)2CO3 (NH4)2SO3 CH3COONH4等
2.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成ZnNH342+ 。
Zn+ 2NaOH=Na2ZnO2+H2
2)写出锌和氢氧化钠溶液反应的化学方程式。
回答下列问题:1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 。
3)试解释在实验室不适宜用可溶性锌盐与氨水反应制备ZnOH2的原因。
可溶性锌盐与氨水反应产生的ZnOH2可溶于过量氨水中,生成 ZnNH342+ ,氨水的用量不易控制。
①可与碱(OH-、氨水等)反应
,与AlO2—、CO32—(HCO3—)、SO32—(HSO3—)、 S2- (HS—)、ClO—等发生双水解
② Al3+水解呈酸性
①与比偏铝酸更强的酸性物质(H+、CO2、HCO3—等)反应
②AlO2-水解呈碱性,与所有弱碱阳离子发生双水解反应。
(Mg2+、Al3+、Zn2+、Fe2+、Fe3+、Cu2+、Ag+、NH4+等)
熟练掌握下列反应的离子方程式:
AlCl3 + NaAlO2
NaAlO2 + NaHCO3
AlCl3 + NaHCO3
它是无色晶体,可溶于水,水溶液pH 7。
(2)明矾的化学式为 ,
Al(OH)3胶体吸附水中杂质形成沉淀而净水
(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
或 K2SO4·Al2 (SO4)3·24H2O
明矾可以净水,其净水的原理是。
3)KAl(SO4)2·12H2O
1.下列化合物的俗称与化学式不对应的是A.绿矾——FeSO4·7H2OB.芒硝——Na2SO4·10H2OC.明矾——Al2(SO4)3·12H2OD.胆矾——CuSO4·5H2O
2.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
3.下列除去杂质的方法不正确的是( )A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al3+C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
含铝杂质的提纯方法归类利用Al、Al2O3、Al(OH)3可溶于强碱的特性,可除去许多物质中的含铝杂质,如:①Mg(Al):加足量NaOH溶液;②Fe2O3(Al2O3):加足量NaOH溶液;③Mg(OH)2[Al(OH)3]:加足量NaOH溶液;④Mg2+(Al3+):加过量NaOH溶液,过滤,再加酸充分溶解。
5.下列离子方程式书写正确的是( )A.向氯化铝溶液中通入过量氨气: 4NH3+Al3++2H2O = AlO2— +4NH4+B.将铝片打磨后置于NaOH溶液中: 2Al+2OH- = 2 AlO2— +H2↑C.向明矾溶液中加入过量的Ba(OH)2溶液: Al3++2SO42—+2Ba2++4OH-=2BaSO4↓+AlO2—+2H2OD.向NaAlO2溶液中通入足量CO2: 2AlO2—+CO2+3H2O=2Al(OH)3↓+ CO32—
6.讨论: 下列反应离子方程式
明矾[KAl(SO4)2·12H2O]溶液中加入Ba(OH)2溶液
①至Al3+恰好完全沉淀
②至SO42—恰好完全沉淀
2 : 3
2Al3++ SO42—
+3Ba2++6OH-
1 : 2
问:此时Al元素以什么形式存在?
Al3++2SO42—
+2Ba2++4OH-
+AlO2—+ 2H2O
写出上述转化的离子方程式。
4. Al3+、Al(OH)3、AlO2—之间的转化关系
① Al3++3NH3·H2O = Al(OH)3↓+3NH4+
Al3+——→Al(OH)3↓
② 3AlO2—+Al3++6H2O = 4Al(OH)3↓
③ Al3++3OH- = Al(OH)3↓
(2) Al(OH)3+3H+ = Al3++3H2O
Al3+ ↔ AlO2—
(3)Al3++4OH- = AlO2—+2H2O
(4)AlO 2— +4H+ = Al3++2H2O
AlO2— ——→Al(OH)3↓
② AlO2—+ H2O + H+= Al(OH)3↓
① AlO2—+CO2+2H2O = Al(OH)3↓+HCO3—
或 2AlO2—+CO2+3H2O = 2Al(OH)3↓+CO32—
(6) Al(OH)3+ OH— = AlO2—+2H2O
5.与Al(OH)3沉淀生成有关的图像分析
(1)把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量
①Al3++3OH- = Al(OH)3↓
产生白色沉淀→沉淀逐渐增多→最多→逐渐减少→消失
②Al(OH)3+ OH— = AlO2—+2H2O
换: 往HCl、AlCl3的混合溶液中逐滴加NaOH溶液,图像如何?
n[Al(OH)3]=
3<
相关课件
这是一份新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析),共60页。PPT课件主要包含了内容索引,铝及其化合物,铝单质,必备知识,Al2O3+,AlOH3,方案二酸溶法,关键能力,FeOH3,镁海水提镁等内容,欢迎下载使用。
这是一份第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共35页。PPT课件主要包含了复习目标,铝及其化合物,考点一,必备知识,易错辨析,专项突破,归纳提升,镁海水提镁,考点二,特别提醒等内容,欢迎下载使用。
这是一份高考化学一轮复习课件8 铝、镁及其化合物(含解析),共44页。PPT课件主要包含了镁及其化合物,铝的性质,铝的结构和存在,第三周期第ⅢA族,金属铝的物理性质,银白色,金属铝的化学性质,形成致密的氧化膜,铝的用途,补充铝热反应等内容,欢迎下载使用。









