





所属成套资源:2024届高考化学一轮总复习课件(44份)
2024届高考化学一轮总复习第三章金属及其化合物第二节铁及其化合物课件
展开
这是一份2024届高考化学一轮总复习第三章金属及其化合物第二节铁及其化合物课件,共60页。PPT课件主要包含了目标导航,FeCl2,④稀盐酸,白色沉淀迅速变为灰,绿色最终变为红褐色,4①③④,铁的物理性质,1位置与结构,示意图为,2铁的化学性质等内容,欢迎下载使用。
[自主测评]1.易错易混辨析(正确的画“√”,错误的画“×”)。(1)Fe 在足量 Cl2 中燃烧生成 FeCl3 ,在少量 Cl2 中燃烧生成
(2)Fe 分别与氯气、盐酸反应得到相同的氯化物。(
(3)FeCl3 可与铜发生置换反应。(
(4)除去 FeCl2 溶液中的 FeCl3,除杂试剂为铁粉。(
(5)向 X 溶液中滴加几滴新制氯水,振荡,再加入少量 KSCN
溶液,溶液变为红色,则 X 溶液中一定含有 Fe2+。(
(6)氢氧化铁与 HI 溶液仅发生中和反应。(
错因:氢氧化铁与 HI 溶液中的H+发生中和反应,生
答案:(1)× 错因:Fe 在 Cl2 中燃烧只生成 FeCl3。
(2)×成 FeCl2。(3)×
错因:Fe 在 Cl2 中燃烧生成 FeCl3,Fe 与盐酸反应生错因:置换反应是单质与化合物反应生成新的单质与
化合物。(4)√(5)× 错因:溶液中可能含有 Fe3+。
成的Fe3+再与I-发生反应:2Fe3++2I-===2Fe2++I2。
化的颜色变化。实验时必须使用铁屑和6ml·L-1的硫酸,其他试
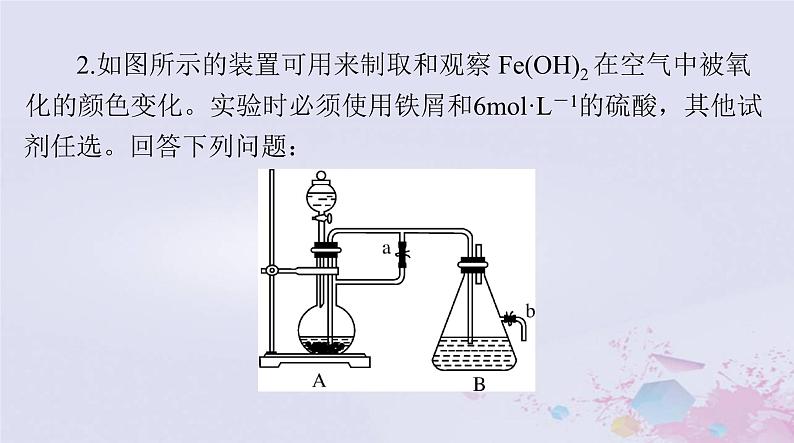
2.如图所示的装置可用来制取和观察 Fe(OH)2 在空气中被氧
剂任选。回答下列问题:
(1)B 中盛有一定量的 NaOH 溶液,A 中应预先加入的药品是________。实验开始时先将止水夹 a________(填“打开”或“关闭”)。
(2)简述生成 Fe(OH)2 的操作过程_______________________________________________________________________________。(3)实验完毕,打开 b 处止水夹,放入一部分空气,此时 B 瓶中发生的反应为___________________________________,现象:_______________________________________________________。
(4)知识拓展,下列物质中,能与铁单质反应且产物中铁元素的化合价为+2 价的是________(填序号)。
①氯化铁溶液 ②氯气 ③硫酸铜溶液
答案:(1)铁屑 打开(2)从B上口收集H2,验纯,H2纯净后关闭止水夹 a,将FeSO4溶液压入B中进行反应
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
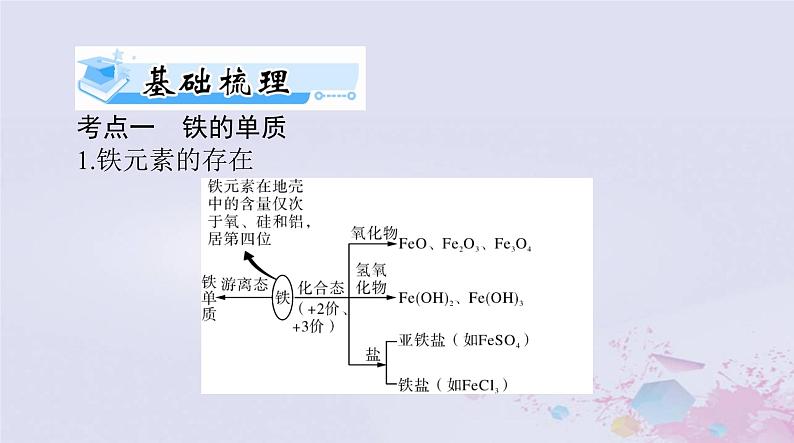
考点一 铁的单质1.铁元素的存在
3.从原子结构角度认识铁的化学性质
铁元素在元素周期表中处于第四周期第____族,其原子结构
,最外层有 2 个电子,在反应中易______电子,
故铁单质的化学性质活泼,有较强的______性,主要化合价为+2价和+3 价。
常温下,铁与水不反应,在高温下,铁与水蒸气反应:_____________________________________。
③与酸的反应(写出离子方程式)
Fe+2H+===Fe2++H2↑
3Fe+8H++2NO3 ===3Fe2++2NO↑+4H2O
④与某些盐的反应(写出离子方程式)
铁与 CuSO4 溶液反应:________________________(湿法炼铜的原理),铁与 FeCl3 溶液的反应:_______________________。
铁是变价金属元素,与弱氧化剂(如 S、HCl、FeCl3、CuSO4、
I2 等)反应时被氧化为Fe2+,铁与强氧化剂[如Cl2、Br2、稀HNO3
(过量)、浓H2SO4(加热)等]反应时被氧化为Fe3+。
Fe+Cu2+===Fe2++Cu
Fe+2Fe3+===3Fe2+
1.铁的三种氧化物的性质
FeO+2H+===Fe2++H2O
Fe2O3+6H+==2Fe3++3H2O
2.铁的两种氢氧化物的性质
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
2Fe(OH)3 Fe2O3+3H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
3.铁盐(1)氧化性:含有Fe3+的溶液,呈黄色,Fe3+具有较强的氧化性,________________________、________________________。(2)特性:含有 Fe3+的溶液滴加 KSCN 溶液时,溶液变成____
色,常利用该特征现象检验溶液中是否含有Fe3+。
可与Cu、I-等还原性物质发生反应,离子方程式分别为
2Fe3++Cu===Cu2++2Fe2+
2Fe3++2I-===2Fe2++I2
(1)含有 Fe2+的溶液,呈_____色。(2)亚铁盐中 Fe 元素显+2 价,处于中间价态,因此亚铁盐既
有氧化性,又有还原性。
2Fe2++Cl2===
①强还原性:Fe2+与 Cl2 反应的离子方程式为_______________
____________________。
②弱氧化性:Fe2+与 Zn 反应的离子方程式为_______________
________________。
(1)盐溶液的配制与保存
考向1 铁的单质、氧化物和氢氧化物的性质与应用1.(原创题)铁是日常生产、生活中使用最广泛的金属。下列关
于铁及其化合物的说法不正确的是(
A.钢铁厂中炽热的铁水注入模具前,必须进行充分的干燥处理B.常温下,铁与浓硫酸不反应,故常温下常用铁质容器储运浓硫酸
C.在空气中,Fe(OH)2 易被氧化成 Fe(OH)3,说明 Fe(OH)3 更
D.维生素 C 具有还原性,与 FeSO4 补血剂一起服用,效果更好解析:铁与水蒸气反应生成 H2,易引发爆炸,故必须充分干燥,A 正确;常温下,铁在浓硫酸中钝化,表面生成致密氧化膜,阻止内层铁与浓硫酸继续反应,B 错误;维生素 C 具有还原性,可防止 FeSO4 被氧化,D 正确。
2.(2022 年无锡第一次调研)铁及其化合物在生产、生活中应用
广泛。下列铁及其化合物的性质与用途具有对应关系的是(A.Fe 有导电性,可用于湿法炼铜B.FeCl3 有氧化性,可用于净水C.Fe2O3 呈红棕色,可用于制作颜料D.K2FeO4 易溶于水,可用于杀菌消毒
解析:铁可用于湿法炼铜,是因为铁的还原性大于铜:Fe+Cu2+===Fe2++Cu,与 Fe 有导电性无关,A 错误;FeCl3 可用于净水,是因为 FeCl3 水解形成氢氧化铁胶体,吸附水中的悬浮杂质,与 FeCl3 的氧化性无关,B 错误;Fe2O3 呈红棕色,可用于制作红色颜料,C 正确;K2FeO4 可用于杀菌消毒,是因为 K2FeO4 具有强氧化性,与 K2FeO4 的溶解性无关,D 错误。
考向2 Fe2+、Fe3+的性质及检验3.(教材改编题)某实验小组同学为了检验某 FeCl3 溶液中是否
含有 FeCl2,设计了如下实验方案,其中最合理的是(
A.加入适量铜粉,观察溶液是否变蓝B.先滴加氯水,再滴加 KSCN 溶液,观察溶液是否变红C.滴加酸性 KMnO4 溶液,观察溶液是否褪色D.滴加 K3[Fe(CN)6]溶液,观察是否生成蓝色沉淀
B错误;Fe2+、Cl-都能被酸性KMnO4溶液氧化,使溶液褪色,不
解析:铜粉可与 FeCl3 溶液反应但不能与FeCl2 反应,无法证明FeCl2的存在,A错误;先滴加氯水,可将FeCl2 氧化生成 FeCl3,因本身含有 FeCl3,滴加 KSCN 溶液,不能判断是否含有 FeCl2,
能判断是否含有 FeCl2,C 错误;若 FeCl3 溶液中含有 FeCl2,滴加K3[Fe(CN)6]溶液(黄色),反应生成蓝色沉淀,实验现象最明显,该方案最合理,D 正确。
4.(2022 年天津滨海七校联考)下列离子的检验方法合理的是
A.向某溶液中滴入 KSCN 溶液呈红色,说明不含 Fe2+B.向某溶液中通入 Cl2,然后再加入 KSCN 溶液变红色,说明原溶液中含有 Fe2+C.向某溶液中加入 NaOH 溶液,得红褐色沉淀,说明溶液中含有 Fe3+D.向某溶液中加入 NaOH 溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有 Fe2+,不含有 Mg2+
错误;Fe3+与OH-生成红褐色的Fe(OH)3沉淀,检验方法合理,C
解析:KSCN 溶液不能直接检验 Fe2+的存在,不确定 Fe2+是否存在,检验方法不合理,A 错误;Fe3+干扰 Fe2+的检验,若原溶液中含有 Fe3+且不含 Fe2+,也会产生相同现象,检验方法不合理,B
正确;Mg(OH)2 为白色沉淀,易被红褐色沉淀掩盖,无法确定原溶液中是否含有 Mg2+,检验方法不合理,D 错误。
[方法技巧] Fe2+、Fe3+的检验方法①Fe3+的检验
考向3 “铁三角”的转化及应用5.(2021 年广东卷)部分含铁物质的分类与相应化合价关系如
图所示。下列推断不合理的是(
A.a 可与 e 反应生成 bB.b 既可被氧化,也可被还原C.可将 e 加入浓碱液中制得 d 的胶体D.可存在 b→c→d→e→b 的循环转化关系
6.(2021 年菏泽期末)为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确
解析:FeCl2 溶液中通入 Cl2,Fe2+被氧化为 Fe3+,溶液变成棕黄色,Fe2+作还原剂,表现还原性,A 错误;FeCl2 溶液中加入锌片,Zn 将 Fe2+还原为 Fe,溶液变成无色,Fe2+作氧化剂,表现氧化性,B 错误;FeCl3 溶液中加入铁粉,发生反应:2Fe3++Fe ===3Fe2+,Fe作还原剂,表现还原性,C正确;FeCl3溶液中加入铜粉,发生反应:2Fe3++Cu===2Fe2++Cu2+,溶液由棕黄色变为蓝色,Fe3+作氧化剂,表现氧化性,D 错误。
基于“价类二维图”认识铁及其化合物的转化
(1)横向转化体现了铁元素同种价态不同类别物质(氧化物、碱、
(2)纵向转化体现了铁元素不同价态同种类别物质之间的转
化,主要体现物质的氧化性和还原性。
(3)斜向转化体现了铁元素不同价态、不同类别物质之间的转
考向4 实验室制备氢氧化亚铁7.(2022 年天津河东区期末)某同学欲利用图示装置制取能较长时间存在的 Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加
热煮沸。下列分析正确的是(
A.X 可以是稀硫酸或 NaOH 溶液
B.实验开始时应先关闭止水夹 a、打开 b,再向烧瓶中加入 XC.反应一段时间后可在烧瓶中观察到白色沉淀
D.反应结束后若关闭 b 及分液漏斗活塞,则 Fe(OH)2 可较长时
解析:Fe 与 NaOH 溶液不发生反应,X 只能是稀硫酸等酸溶液,A 错误;实验开始时应先打开止水夹 a、b,向烧瓶中加入 X利用生成的氢气将装置内的空气排出,然后关闭 a,B 错误;利用氢气产生的压强将亚铁盐溶液排入锥形瓶中,NaOH 与亚铁盐溶液反应生成 Fe(OH)2,在锥形瓶中观察到白色沉淀,C 错误;反应结束后若关闭 b 及分液漏斗活塞,装置内空气及溶液中氧气均已除去,则 Fe(OH)2 可较长时间存在,D 正确。
8.(2021 年唐山市区县联考) 在下图中,能较长时间观察到
Fe(OH)2 白色沉淀的是(
解析:①先滴加稀硫酸,铁粉与稀硫酸反应生成 H2,利用产生的 H2 排出装置内空气,再滴加 NaOH 溶液,反应生成的白色沉淀Fe(OH)2 可长时间存在,正确;②先打开弹簧夹,利用铁粉与稀硫酸反应产生的 H2 排出装置内的空气,再关闭弹簧夹,装置内气体压强增大,将左侧试管中生成的 FeSO4 溶液压入右管,反应生成白色沉淀 Fe(OH)2可长时间存在,正确;③未采取措施,NaOH溶液与FeSO4溶液生成 Fe(OH)2,迅速被氧化,不能长时间观察到白色沉淀,错误;④苯隔绝空气,利用长胶头滴管将NaOH 溶液加入FeSO4 溶液中,反应生成白色沉淀Fe(OH)2 可长时间存在,正确。
[方法技巧] 实验室制备Fe(OH)2 的两种方法
Fe(OH)2 具有强还原性,极易被空气中的氧气氧化为Fe(OH)3,因此实验室在制备Fe(OH)2 时,要注意隔绝空气。常采取以下方法:
1.下列关于铁及其化合物的说法正确的是(
A.FeS2 在沸腾炉中与 O2 反应主要生成 SO3(2020 年浙江 7 月选考)B.Mg 加入过量 FeCl3 溶液中可得 Fe(2020 年浙江 7 月选考)C.钢铁在潮湿空气中生锈主要是发生了电化学腐蚀(2020 年浙江 7 月选考)D.室温下,Fe与浓H2SO4 反应生成 FeSO4(2020 年江苏卷)
解析:FeS2 在沸腾炉中与 O2 发生的反应为 4FeS2+11O2
2Fe2O3+8SO2,产物主要是 SO2,A 错误;Mg 加入 FeCl3 溶液中,Mg 具有较强的还原性,先与 Fe3+反应,生成 Mg2+和 Fe2+,若 Mg 过量,Mg 与 Fe2+继续反应生成 Mg2+和 Fe,但由于反应中FeCl3 过量,所以不会生成 Fe,B 错误;钢铁在潮湿的空气中,铁和碳、水膜形成原电池,发生电化学腐蚀,腐蚀速率更快,C 正确;室温下,铁在浓硫酸中发生钝化,D 错误。
2.(2022年浙江6月选考)关于化合物 FeO(OCH3)的性质,下列
A.与稀盐酸反应生成 FeCl3、CH3OH、H2OB.隔绝空气加热分解生成 FeO、CO2、H2OC.溶于氢碘酸(HI),再加 CCl4 萃取,有机层呈紫红色D.在空气中,与 SiO2 高温反应能生成 Fe2(SiO3)3
解析:化合物 FeO(OCH3)中 Fe 元素的化合价为+3 价,CH3O-
带一个单位负电荷。由分析可知,化合物 FeO(OCH3)中 Fe 元素的化合价为+3 价,故其与稀盐酸反应生成 FeCl3、CH3OH、H2O,反应原理为 FeO(OCH3)+3HCl===FeCl3+H2O+CH3OH,A 不合题意;化合物 FeO(OCH3)中 Fe 元素的化合价为+3 价,C 元素的化合价为-2 价,若隔绝空气加热分解生成 FeO、CO2、H2O,则得失电子总数不相等,不符合氧化还原反应规律,即不可能生成FeO、CO2、H2O,B 符合题意;化合物 FeO(OCH3)中 Fe 元素的化
合价为+3价,故其溶于氢碘酸(HI)生成的Fe3+能将I-氧化为I2,
反应原理为2FeO(OCH3)+6HI===2FeI2+I2+2H2O+2CH3OH,再加 CCl4 萃取,有机层呈紫红色,C 不合题意;化合物 FeO(OCH3)在空气中高温将生成 Fe2O3、CO2 和 H2O,Fe2O3 为碱性氧化物,SiO2 为酸性氧化物,故化合物 FeO(OCH3)与 SiO2 高温反应能生成Fe2(SiO3)3,D 不合题意。
3.(2021 年湖南卷)下列说法正确的是(
A.糖类、蛋白质均属于天然有机高分子化合物B.FeO 粉末在空气中受热,迅速被氧化成 Fe3O4C.SO2 可漂白纸浆,不可用于杀菌、消毒D.镀锌铁皮的镀层破损后,铁皮会加速腐蚀
解析:糖类分为单糖、二糖和多糖,其中属于多糖的淀粉、纤维素的相对分子质量上万,属于天然高分子化合物,蛋白质也属于天然有机高分子化合物,而单糖和二糖相对分子质量较小,不属于天然高分子化合物,A 错误;氧化亚铁具有较强的还原性,在空气中受热容易被氧气氧化为稳定的四氧化三铁,B 正确;二氧化硫除了具有漂白作用,可漂白纸浆、毛和丝等,还可用于杀菌消毒,例如,在葡萄酒酿制过程中可适当添加二氧化硫,起到杀菌、抗氧化作用,C 错误;镀锌的铁皮镀层破损后构成原电池,锌作负极,铁作正极被保护,铁皮不易被腐蚀,D 错误。
4.(2019 年全国Ⅰ卷)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________
(2)步骤②需要加热的目的是______________________,温度保持 80~95 ℃,采用的合适加热方式是____________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为________(填标号)。
(3)步骤③中选用足量的 H2O2,理由是________________。分批加入 H2O2,同时为了________,溶液要保持 pH 小于 0.5。(4)步骤⑤的具体实验操作有______________________,经干
燥得到硫酸铁铵晶体样品。
发生的反应为2Fe2++H2O2+2H+===2Fe3++2H2O,从生成物看,
解析:(2)铁与稀硫酸反应时加热,可提高反应速率。温度低于水的沸点,可以用热水浴加热,受热均匀且便于控制。含少量硫化物的铁屑与稀硫酸反应有 H2S 生成,氢气不与碱溶液反应,而硫化氢能与碱溶液反应,且 H2S 在水中溶解度小,故氢气中混有的硫化氢用烧碱溶液除去,又因为硫化氢与碱反应较快,容易引起倒吸,C 装置倒置漏斗能防倒吸。(3)铁与稀硫酸反应生成硫酸亚铁和氢气,加入足量双氧水的目的是将 Fe2+全部氧化为 Fe3+,
相关课件
这是一份2024届高考化学一轮复习 第三章 金属及其化合物 第2讲 铁及其化合物课件PPT,共48页。PPT课件主要包含了二铁的氧化物,磁性氧化铁,红棕色,FeOH3↓,答案D,答案A,答案C等内容,欢迎下载使用。
这是一份2024年高考化学一轮复习第三章第二节铁及其化合物课件,共60页。PPT课件主要包含了目标导航,FeCl2,④稀盐酸,白色沉淀迅速变为灰,绿色最终变为红褐色,4①③④,铁的物理性质,1位置与结构,示意图为,2铁的化学性质等内容,欢迎下载使用。
这是一份人教版高考化学一轮总复习课时质量评价10铁及其化合物课件,共37页。









