




所属成套资源:2024届高考化学一轮总复习课件(44份)
2024届高考化学一轮总复习第一章物质及其变化第三节氧化还原反应课件
展开这是一份2024届高考化学一轮总复习第一章物质及其变化第三节氧化还原反应课件,共60页。PPT课件主要包含了答案1×,KMnO4,NO↑+4H2O,答案D,答案B,答案C,氧的固定,答案12∶7,答案A等内容,欢迎下载使用。
[ 自主测评 ]1.易错易混辨析(正确的画“√”,错误的画“×”)。(1)有单质参加或有单质生成的化学反应一定是氧化还原反
(2)水做还原剂时,产物中一般有O2。(
(3)HCl 中 Cl 为-1 价,故 HCl 只能被氧化。(
加入淀粉后溶液变成蓝色,则氧化性:Cl2>I2。(
(4)向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,
错因:同素异形体的相互转化,没有元素化合
价的变化,不属于氧化还原反应。(2)√
错因:HCl 由氢和氯两种元素组成,H 元素的化合价
可以降低被还原,Cl 元素的化合价可以升高被氧化。(4)√
2.标出下列反应中化合价变化元素的化合价,并用双线桥法表
示电子转移的方向和数目:
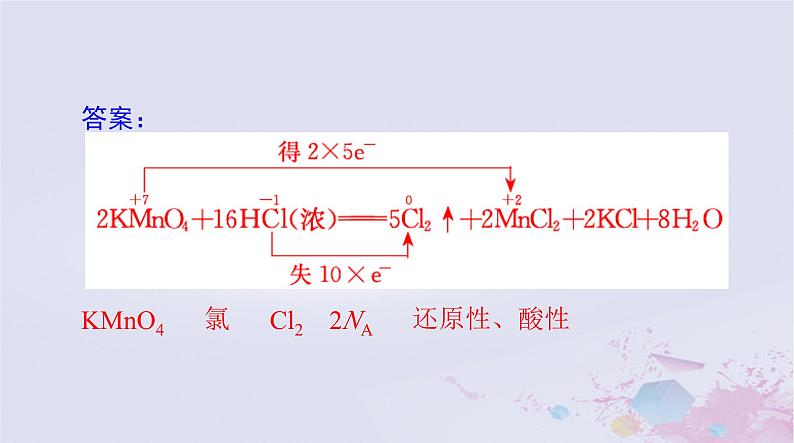
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+ 2KCl+8H2O
上述反应中________是氧化剂,________元素被氧化,氧化产物是________,生成 1 ml Cl2 时转移电子数目为________,盐酸表现的性质是________。
Cl2 2NA
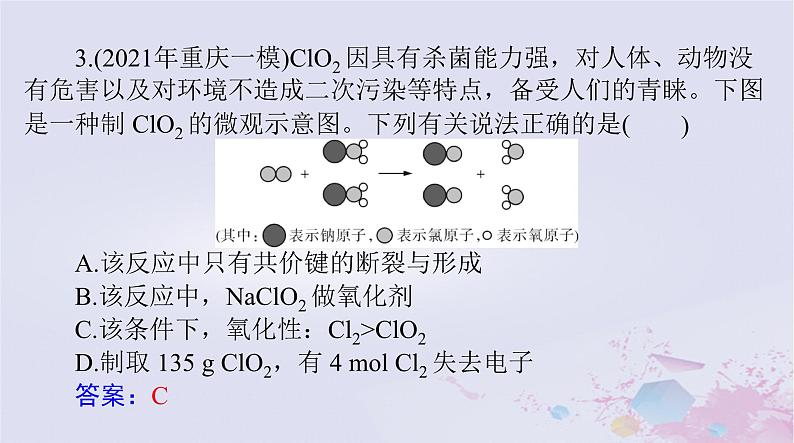
3.(2021年重庆一模)ClO2 因具有杀菌能力强,对人体、动物没有危害以及对环境不造成二次污染等特点,备受人们的青睐。下图
是一种制 ClO2 的微观示意图。下列有关说法正确的是(A.该反应中只有共价键的断裂与形成B.该反应中,NaClO2 做氧化剂C.该条件下,氧化性:Cl2>ClO2D.制取 135 g ClO2,有 4 ml Cl2 失去电子答案:C
考点一 氧化还原反应
1.氧化还原反应及其概念间的关系(1)本质和特征
2.电子转移的表示方法
(1)双线桥法:标变价―→画箭头―→标得失―→定数目。
如Cu与稀硝酸反应中电
子转移的方向和数目_____________________________________。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”“失去”字样。如Cu与稀硝酸反应中电子转移的方向和数目_______________________________
_______________________。
===3Cu(NO3)2+
3.常见的氧化剂和还原剂(1)常见氧化剂
常见氧化剂包括某些非金属单质、含高价态元素的化合物、
常见还原剂包括活泼金属单质、非金属阴离子、含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。例如:
考点二 物质的氧化性、还原性强弱比较1.依据反应原理
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
2.依据金属、非金属的活动性顺序
3.依据反应条件及反应的剧烈程度反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、有无催化剂和反应物浓度大小等。例如:
根据 2Na+2H2O===2NaOH+H2↑,Mg+2H2O+H2↑,可以推知还原性:Na>Mg。
4.依据产物中元素价态的高低(1)相同条件下不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例如:
根据 2Fe+3Cl2
2FeCl3,Fe+S
FeS,可以推知氧化性:
Cl2>S。(2)相同条件下不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如:根据 Cu+2Fe3+===Cu2++2Fe2+,3Zn+2Fe3+===3Zn2++2Fe,可以推知还原性:Zn>Cu。
考点三 氧化还原反应的计算1.电子守恒法计算的原理
氧化剂得电子总数=还原剂失电子总数2.电子守恒法计算的流程
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。(2)找准一个原子或离子得失电子数(注意化学式中粒子的个
(3)根据题中物质的物质的量和得失电子守恒列出等式。n( 氧化剂)×变价原子个数×化合价变化值( 高价-低价) =n(还原剂)×变价原子个数×化合价变化值(高价-低价)。
考点四 氧化还原反应方程式的书写与配平1.氧化还原反应方程式配平的基本原则
2.氧化还原反应方程式配平的一般步骤
考向1 氧化还原反应的基本概念及联系1.(2021 年浙江 1 月选考)关于反应 8NH3+6NO2===7N2+
12H2O,下列说法正确的是(
A.NH3 中 H 元素被氧化B.NO2 在反应过程中失去电子C.还原剂与氧化剂的物质的量之比为 3∶4D.氧化产物与还原产物的质量之比为 4∶3
解析:NH3 中 H 元素化合价不变,未被氧化,A 错误;NO2中 N 元素化合价降低,在反应中得到电子,B错误;还原剂是NH3,氧化剂是NO2 ,二者的物质的量之比为8∶6 =4∶3 ,C 错误;NH3→N2 发生氧化反应,NO2→N2 发生还原反应,则氧化产物与还原产物的质量之比为 4∶3,D 正确。
2.(2020 年北京卷)下列物质的应用中,利用了氧化还原反应的
)A.用石灰乳脱除烟气中的 SO2B.用明矾[KAl(SO4)2·12H2O]处理污水C.用盐酸去除铁锈(主要成分 Fe2O3·xH2O)D.用“84”消毒液(有效成分 NaClO)杀灭细菌
解析:SO2 是酸性氧化物,用石灰乳脱除烟气中的 SO2 时,SO2与 Ca(OH)2 反应生成 CaSO3,各元素均未变价,不涉及氧化还原反应,A 错误;明矾[KAl(SO4)2·12H2O]溶于水中,电离出的 Al3+发生水解生成 Al(OH)3 胶体,可吸附污水中的固体颗粒物,各元素均未变价,不涉及氧化还原反应,B 错误;用盐酸去除铁锈(主要成分Fe2O3·xH2O),发生反应:6HCl+Fe2O3·xH2O===2FeCl3+(3+x)H2O,没有元素化合价的变化,不涉及氧化还原反应,C 错误;“84”消毒液的有效成分是 NaClO,具有强氧化性,能使蛋白质发生变性从而杀死细菌病毒,杀菌消毒的过程利用了氧化还原反应,D 正确。
考向2 物质的氧化性和还原性的比较
解析:反应③中Mn元素由+7价降低到+2价,MnCl2是还原产物,A错误;氧化还原反应中,氧化性:氧化剂>氧化产物;据①~④分别可得氧化性:Cl2>I2、Br2>Fe3+、KMnO4>Cl2、Cl2>Br2,综合可得氧化性:KMnO4>Cl2>Br2>Fe3+>I2,B正确;据①可得氧化性:Cl2>I2,无法推理得到Cl2+FeBr2===FeCl2+Br2,C错误;反应③中,有1 ml KMnO4参与反应,同时消耗8 ml HCl,但只有5 ml HCl被氧化,D错误。
解析:根据氧化性:氧化剂>氧化产物,据①~③分别可得,氧化性:K2Cr2O7>Cl2、HCl>CrCl2、KMnO4>Cl2,①中使用浓盐酸,③中使用稀盐酸,则氧化性:KMnO4>K2Cr2O7,A 错误;反应③中,氧化剂是 KMnO4,还原剂是 HCl,根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为1∶5,B 错误;②中Cr与稀盐酸反应生成 H2,向金属 Cr 中滴入浓硝酸无明显变化,可能是发生了钝化,C 错误;由于氧化性:KMnO4>K2Cr2O7,向 Cr2(SO4)3 溶液中滴入酸性 KMnO4 溶液,可发生氧化还原反应,Cr3+ 被氧化为
[方法技巧]立足“两个规律”,巧解物质的氧化性和还原性相关试题(1)熟记性质强弱的两个规律。①氧化性:氧化剂>氧化产物;②还原性:还原剂>还原产物。
(3)利用“假设法”判断氧化还原反应能否发生。假设选项中反应能够发生,依据该反应判断氧化性(或还原性)的强弱,再与题干中物质的氧化性(或还原性)对照,若其强弱顺序一致,则此反应能够发生,否则,不能发生。
考向3 氧化还原反应概念和转移电子的有关计算6.(2020 年北京卷节选)MnO2 是重要的化工原料,由软锰矿制备 MnO2 的一种工艺流程如图:
[资料]软锰矿的主要成分为 MnO2,主要杂质有Al2O3 和SiO2。
7.(2022 年天津河西区期末)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2 碱性悬浊液(含有 KI)混合,反应生成 MnO(OH)2,实现氧的固定。
答案:(1)2Mn(OH)2+O2===2MnO(OH)2(2)蓝色刚好褪去 80ab
对于过程相对复杂的氧化还原反应的计算,如连续反应或多个反应并列发生,可以通过分析反应前后,“始态”“终态”涉及的所有物质,找出所有“始态”物质到“终态”物质中化合价发生变化的元素,根据电子得失守恒列式求解,简化解题步骤。
考向4 氧化还原反应方程式的书写与配平
答案:(1)1 2 4 1 1 3
(2)1 2 4 2 1 2
9.(1)(2017 年全国Ⅲ卷节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 FeO·Cr2O3,还含有硅、
步骤①的主要反应为 FeO·Cr2O3+Na2CO3+NaNO3
Na2CrO4+Fe2O3+CO2↑+NaNO2。上述反应配平后 FeO·Cr2O3 与NaNO3 的系数比为______。
(2)(2014 年福建卷节选)工业上,通过如下转化可制得 KClO3
(2)1 3 1 3 H2↑
(3)1 6 6 1 6 3
[归纳提升](1)“缺项”配平
对于化学反应方程式,所缺物质往往是酸、碱或水。
(2)价态归中,互不交叉
含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,而不会出现交叉现象。例如,不同价态硫元素之间不会出现 H2S 转化为 SO2,而H2SO4 转化为 S 的情况。
(3)价态歧化同一元素发生氧化还原反应生成不同价态的物质时,该元素的价态变化一定遵循“中间价态→高价态+低价态”,不会出现“一边倒”的现象,即生成物中该元素的价态不能都比中间价态
高或都比中间价态低。例如,
(4)根据信息“四步”书写氧化还原反应方程式
1.(2022 年浙江 6 月选考)关于反应 Na2S2O3+H2SO4===Na2SO4
+S↓+SO2↑+H2O,下列说法正确的是(
A.H2SO4 发生还原反应B.Na2S2O3 既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为 2∶1D.1 ml Na2S2O3 发生反应,转移 4 ml 电子
解析:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,该反应的本质是硫代硫酸根离子在酸性条件下发生歧化反应生成硫和二氧化硫,化合价发生变化的只有 S 元素,硫酸的作用是提供酸性环境。H2SO4 转化为硫酸钠和水,其中所含元素的化合价均未发生变化,故其没有发生还原反应,A 错误;Na2S2O3 中的 S 元素的化合价为+2 价,其发生歧化反应生成 S(0 价)和 SO2(+4 价),故其既是氧化剂又是还原剂,B 正确;该反应的氧化产物是 SO2,还原产物为 S,氧化产物与还原产物的物质的量之比为 1∶1,C 错误;根据其中 S 元素的化合价变化情况可知,1 ml Na2S2O3 发生反应,转移 2 ml 电子,D 错误。
3.(2021 年广东卷)化学创造美好生活。下列生产活动中,没有
运用相应化学原理的是(
解析:聚乙烯是一种无毒的塑料,是最常见的食品包装袋材料之一,用聚乙烯塑料制作食品包装袋与燃烧生成二氧化碳和水无关,A符合题意;溴离子具有还原性,能与氯气反应生成溴单质,镁离子具有弱氧化性,能用电解熔融氯化镁的方法制得镁,利用海水制取溴和镁与单质,与溴离子可被氧化、镁离子可被还原有关,B 不符合题意;氢氟酸能与二氧化硅反应,常用来刻蚀石英制作艺术品,用氢氟酸刻蚀石英制作艺术品,与氢氟酸能与二氧化硅反应有关,C 不符合题意;钢铁在潮湿的空气中易发生吸氧腐蚀,在护栏上涂油漆可以隔绝钢铁与潮湿空气接触,防止钢铁腐蚀,公园的钢铁护栏涂刷多彩油漆防锈,与钢铁与潮湿的空气隔绝可防止腐蚀有关,D 不符合题意。
4.(2021 年浙江6月选考)关于反应 K2H3IO6+9HI===2KI+4I2
+6H2O,下列说法正确的是(
A.K2H3IO6 发生氧化反应B.KI 是还原产物C.生成 12.7 g I2 时,转移 0.1 ml 电子D.还原剂与氧化剂的物质的量之比为 7∶1
相关课件
这是一份2024届高考化学一轮复习 第一章 物质及其变化 第4讲 氧化还原反应课件PPT,共57页。PPT课件主要包含了浓硫酸,mol,答案C,答案D,物质得到电子,物质失去电子,氧化性,还原性,答案B,答案A等内容,欢迎下载使用。
这是一份2024版新教材高考化学全程一轮总复习第一章物质及其变化第4讲氧化还原反应课件,共60页。PPT课件主要包含了化合价,有关概念及联系,浓硫酸,mol,SO2,Mn2+,Cr3+,Fe3+,H2O,答案C等内容,欢迎下载使用。
这是一份2024年高考化学一轮复习第一章第三节氧化还原反应课件,共60页。PPT课件主要包含了答案1×,KMnO4,NO↑+4H2O,答案D,答案B,答案C,氧的固定,答案12∶7,答案A等内容,欢迎下载使用。












