

云南省大理白族自治州2022-2023学年高二化学下学期期末试题(Word版附解析)
展开
这是一份云南省大理白族自治州2022-2023学年高二化学下学期期末试题(Word版附解析),共24页。试卷主要包含了 下列说法正确的是等内容,欢迎下载使用。
2022~2023学年下学期大理州普通高中质量监测
高二化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Cl-35.5 Fe-56 Cu-64 Zn-65 I-127
第Ⅰ卷(选择题,共44分)
一、选择题(本大题共22小题,每小题2分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的,错选、多选均不得分)
1. 化学与生产生活密切相关,下列说法正确的是
A. 光导纤维的主要成分是二氧化硅
B. 矿物油溅在衣物上可用热的纯碱溶液去除
C. 垃圾填埋和焚烧可以减少对环境的污染
D. 利用丁达尔效应可检测气溶胶中的冠状病毒
【答案】A
【解析】
【详解】A.制造光导纤维的主要成分是二氧化硅,利用二氧化硅晶体对光的全反射,故A正确;
B.矿物油属于烃,不与纯碱反应,也不溶于纯碱溶液,因此矿物油溅在衣服上不能用热的纯碱溶液去除,故B错误;
C.垃圾填埋:垃圾中的重金属离子等有毒物质会污染土壤或地下水,焚烧垃圾:会产生有毒的气体,污染大气,垃圾填埋和焚烧不可以减少对环境的污染,故C错误;
D.丁达尔效应只能区分胶体与其他分散系,不能检测冠状病毒,故D错误;
答案为A。
2. 下列化学用语或图示表达正确的是
A. 基态Cr价层电子轨道表示式:
B. 氯化氢的电子式:
C. 丙烯球棍模型:
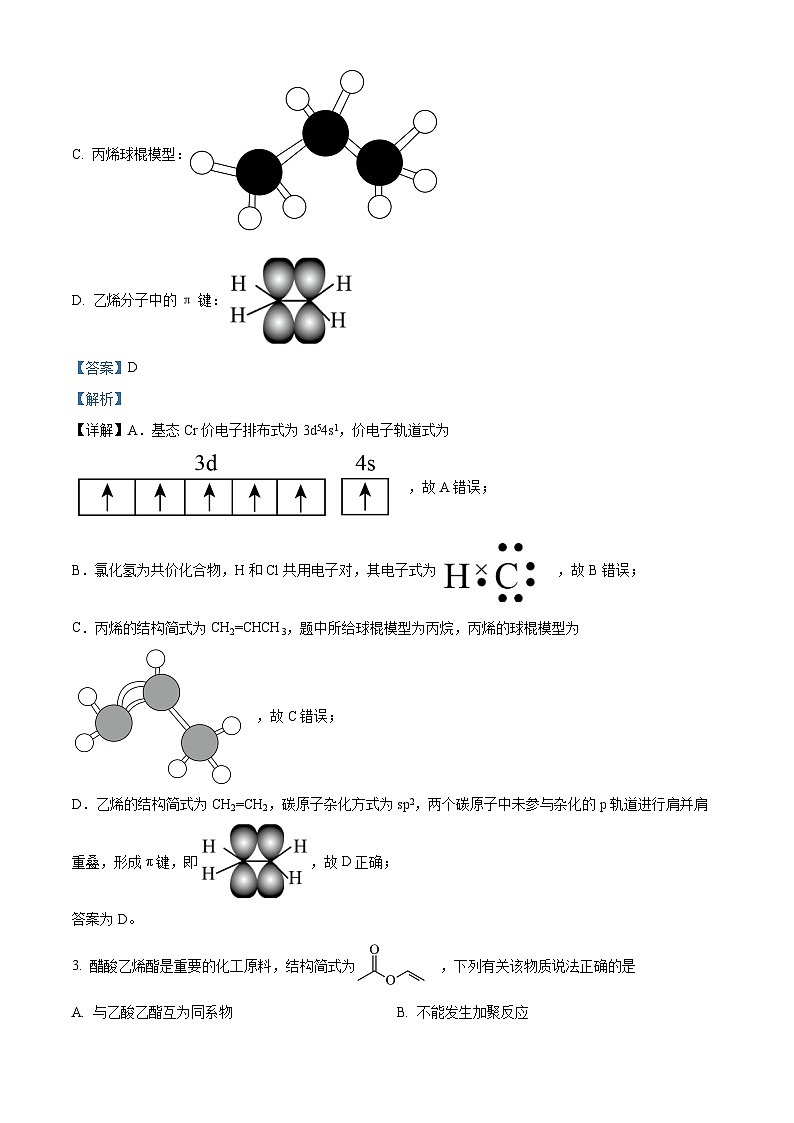
D. 乙烯分子中的π键:
【答案】D
【解析】
【详解】A.基态Cr价电子排布式为3d54s1,价电子轨道式为 ,故A错误;
B.氯化氢为共价化合物,H和Cl共用电子对,其电子式为 ,故B错误;
C.丙烯的结构简式为CH2=CHCH3,题中所给球棍模型为丙烷,丙烯的球棍模型为 ,故C错误;
D.乙烯的结构简式为CH2=CH2,碳原子杂化方式为sp2,两个碳原子中未参与杂化的p轨道进行肩并肩重叠,形成π键,即,故D正确;
答案为D。
3. 醋酸乙烯酯是重要的化工原料,结构简式为 ,下列有关该物质说法正确的是
A. 与乙酸乙酯互为同系物 B. 不能发生加聚反应
C. 该物质能与NaOH溶液反应 D. 所有原子均处于同一平面
【答案】C
【解析】
【详解】A.同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物;与乙酸乙酯结构不同,不互为同系物,A错误;
B.分子中含有碳碳双键,能发生加聚反应,B错误;
C.分子含有酯基,该物质能与NaOH溶液反应发生碱性水解,C正确;
D.分子含有饱和碳原子,为四面体形结构,所有原子不会处于同一平面,D错误;
故选C。
4. 某元素基态原子价电子排布式为,下列说法不正确的是
A. 该原子位于周期表p区
B. 该元素的最高正价为+4价
C. 该基态原子中存在两个未成对电子
D. 该元素最简单氢化物的空间构型是V形
【答案】B
【解析】
【详解】A.该元素的价电子排布式为3s23p4,最后一个电子填充在p能级,因此该元素位于周期表p区,故A说法正确;
B.根据价电子排布式为3s23p4,最大能层是3,推出该元素位于第三周期,最外层有6个电子,即属于ⅥA族,该元素为S,最高正价为+6价,故B说法错误;
C.基态硫原子的价电子轨道式为,存在两个未成对电子,故C说法正确;
D.该元素最简单氢化物为H2S,中心原子S有2个σ键,2个孤电子对,空间构型为V形,故D说法正确;
答案为B。
5. 为有效保护环境,可以利用反应 减少汽车有害尾气排放,实现汽车尾气净化。下列措施能提高恒容容器中该反应NO转化率的是
A. 升高温度 B. 充入一定量的
C. 分离出部分氮气 D. 通入稀有气体
【答案】C
【解析】
【分析】该反应为气体体积减小的放热反应,要使NO的转化率增大,需使平衡正向移动。
【详解】A.升高温度,平衡逆向移动,NO的转化率减小,A不符合题意;
B.充入一定量的CO2,增大生成物浓度,平衡逆向移动,NO的转化率减小,B不符合题意;
C.分离出部分氮气,减小生成物浓度,平衡正向移动,NO的转化率增大,C符合题意;
D.恒容容器中通入稀有气体,体系中各组分浓度不变,平衡不移动,D不符合题意;
故选C。
6. 下列说法正确的是
A. 和一定互为同系物 B. 的名称是1,2-二氯乙烷
C. 乙烯和异戊二烯互为同系物 D. 甲苯和苯都能使酸性高锰酸钾溶液褪色
【答案】B
【解析】
【详解】A.若C3H6为环丙烷, C2H4为乙烯,则二者结构不相似,不互为同系物,A错误;
B.卤代烃ClCH2CH2Cl采用系统命名法命名为1,2-二氯乙烷,B正确;
C.乙烯和异戊二烯中所含碳碳双键个数不同,二者结构不相似,不互为同系物,C错误;
D.苯不能使酸性高锰酸钾溶液褪色,D错误;
故选B。
7. 下列实验设计能达到实验目的的是
选项
实验目的
实验设计
A
证明非金属性Br>I
比较等浓度HI和HBr溶液的酸性
B
检验溶液中的
向溶液中加入酸化的,产生白色沉淀
C
除去中混有的
将混合气体通入饱和溶液
D
验证干燥是否具有漂白作用
将通入品红溶液,观察溶液是否褪色
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.证明非金属性Br>I,应比较二者最高价氧化物对应水化物HBrO4和HIO4的酸性,A不符合题意;
B.向溶液中加入HNO3酸化的BaCl2,产生白色沉淀,不能说明溶液中含有SO,因为若溶液中含有Ag+,也会有白色沉淀产生,且亚硫酸根离子能被硝酸氧化遇到钡离子也会产生硫酸钡沉淀,B不符合题意;
C.将混合气体通入饱和NaHCO3溶液中,SO2被NaHCO3溶液吸收反应生成CO2,而CO2不和NaHCO3溶液反应,能达到除杂的目的,C符合题意;
D.将Cl2通入品红溶液中,Cl2接触到水会生成次氯酸,不能验证干燥Cl2是否具有漂白作用,D不符合题意;
故选C。
8. 下列各组离子,在指定条件的溶液中能大量共存的是
A. 某无色澄清溶液中:、、、
B. 常温下,由水电离出的浓度为: mol/L,的溶液:、、、
C. 溶液中浓度为1 mol/L的溶液:、、、
D. 常温下,的溶液:、、、
【答案】D
【解析】
【详解】A.MnO溶液显紫色,在无色溶液中不能大量共存,A不选;
B.常温下由水电离出的 c水(H+ )=1×10−10mol/L,说明水的电离受到抑制,该溶液可能为酸溶液也可能为碱溶液,若为酸溶液,H+和CO不能大量共存,若为碱溶液,OH-和NH不能大量共存,B不选;
C.ClO-具有强氧化性,能将Fe2+氧化为Fe3+,不能大量共存,C不选;
D.c(H+)>c(OH-),溶液显酸性,Cu2+、Ca2+、NO、Cl-、H+五种离子相互间不反应,能大量共存,D选;
故选D。
9. 能正确表示下列反应的离子方程式的是
A. 铝溶解在NaOH溶液中:
B. 的水解:
C. 溶于硝酸反应:
D. 向氢氧化镁固体中滴加硫酸铁溶液:
【答案】D
【解析】
【详解】A.铝与氢氧化钠溶液发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,其离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑,故A错误;
B.HCO发生水解:HCO+H2OH2CO3+OH-,故B错误;
C.Fe3O4与硝酸发生氧化还原反应,如与稀硝酸反应:3Fe3O4+28H++NO=9Fe3++NO↑+14H2O,故C错误;
D.利用反应向着更难溶的方向进行,氢氧化铁比氢氧化镁难溶,向氢氧化镁固体中滴加硫酸铁溶液,发生3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,故D正确;
答案为D。
10. 短周期主族元素X、Y、Z、Q、W原子序数依次增大,X的一种核素常用于测定文物的年代,Z的一种单质常用来消毒杀菌,Q最外层有2个电子,W和Y同族。下列说法不正确的是
A. 第一电离能:X>Y>Z B. 简单氢化物的沸点:Y>W
C. 最高价氧化物对应水化物的酸性:Y>X D. X、Y、Z的最简单氢化物的杂化方式均为杂化
【答案】A
【解析】
【分析】短周期主族元素X、Y、Z、Q、W原子序数依次增大,X的一种核素常用于测定文物的年代,则X为C;Z的一种单质常用来消毒杀菌,该物质为O3,则Z为O,Y为N;Q最外层有2个电子,则Q为Mg;W和Y同族,则W为P;综上所述,X、Y、Z、Q、W分别为C、N、O、Mg、P,据此分析解答。
详解】A.同周期元素,第一电离能随着原子序数递增而呈增大趋势,但N元素2p能级轨道半充满,比较稳定,第一电离能大于相邻元素,则第一电离能:N>O>C,A错误;
B.NH3存在分子间氢键,PH3不能形成分子间氢键,因此简单氢化物的沸点:NH3>PH3,B正确;
C.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:N>C,则其最高价氧化物对应水化物的酸性:HNO3>H2CO3,C正确;
D.X、Y、Z的最简单氢化物分别为CH4、NH3、H2O,其杂化方式均为 sp3杂化,D正确;
故选A。
11. 下列说法不正确的是
A. 干冰和固体融化时,克服的作用力相同
B. 氯化铯晶体中,每个周围紧邻8个
C. 不能作为配合物的配体
D. 离子化合物中可以存在非极性共价键
【答案】A
【解析】
【详解】A.干冰为分子晶体,微粒间存在范德华力,二氧化硅为共价晶体,微粒间存在共价键,熔化干冰破坏范德华力,熔化二氧化硅破坏共价键,故A说法错误;
B.氯化铯晶胞图为 ,每个Cs+周围紧邻8个Cl-,故B说法正确;
C.配体需要提供孤电子对,NH中心N原子没有孤电子对,因此NH不能作为配合物的配体,故C说法正确;
D.离子化合物中可以存在非极性共价键,如Na2O2,其电子式为 ,存在非极性共价键,故D说法正确;
答案为A。
12. 如图为等量和反应生成的微观示意图。下列说法正确的是
A. a>b
B. 过程I断开化学键,放出热量
C. 、、HCl中均只存在共价键
D. HCl具有的能量低于和具有的能量
【答案】C
【解析】
【详解】A.H2(g)和Cl2(g)化合生成HCl(g)为放热反应,则断裂化学键吸收的akJ能量小于形成化学键放出的bkJ能量,即a
相关试卷
这是一份云南省曲靖市民族中学2022-2023学年高二化学下学期期末考试试题(Word版附答案),共14页。试卷主要包含了本卷主要考查内容,下列化学用语或说法正确的是,下列物质中能发生水解的是,下列说法正确的是等内容,欢迎下载使用。
这是一份云南省昆明市2022-2023学年高二化学下学期期末试题(Word版附解析),共20页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
这是一份云南省大理白族自治州2022-2023学年高二下学期期末质量监测化学试卷(PDF版含答案),文件包含2022-2023学年下学期大理州普通高中质量监测高二化学试卷pdf、20222023学年下学期大理州普通高中质量监测高二化学-答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。









