






还剩13页未读,
继续阅读
人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液授课课件ppt
展开
这是一份人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液授课课件ppt,共21页。PPT课件主要包含了物质的量,0mol,液体体积的度量仪器,存储器,温度和容积,刻度线,000mL,玻璃棒引流,用食指按住瓶塞另一,nB减小等内容,欢迎下载使用。
实验目的:1.练习容量瓶的使用方法。2.练习配制一定物质的量浓度的溶液。3.加深对物质的量浓度概念的认识。
一、知识梳理,夯实基础
一、基础知识1.一种或几种物质分散到另一种物质里,形成______的、______的混合物,叫做溶液。能溶解其他物质的物质叫做______,被溶解的物质叫做溶质。2.物质的量浓度表示单位体积的溶液里所含溶质 B 的_________,符号为______。100 mL 1.0 ml/L NaCl溶液表示在 1 L _______中,含有的溶质是________。
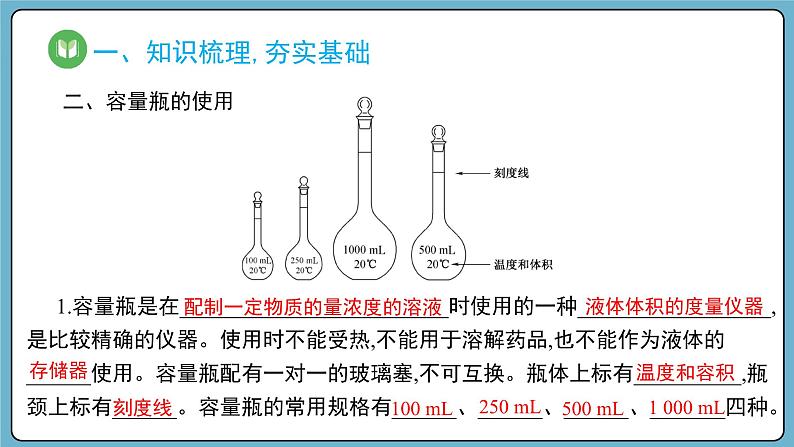
1.容量瓶是在_________________________时使用的一种__________________,是比较精确的仪器。使用时不能受热,不能用于溶解药品,也不能作为液体的 ______使用。容量瓶配有一对一的玻璃塞,不可互换。瓶体上标有__________,瓶颈上标有______。容量瓶的常用规格有______、______、______、_______四种。
配制一定物质的量浓度的溶液
2.容量瓶的使用方法(1)检验容量瓶是否漏液的方法是_____________________________________________________________________________________________________________________________________。(2)向容量瓶中加液体时要用___________。(3)容量瓶中溶液的定容方法是____________________________________ ___________________________________________________________。(4)将定容后的容量瓶中的液体混合均匀的方法是___________________———————————————。
往容量瓶中加入一定量的水,盖好并按住
瓶塞,另一只手托住瓶底,把瓶倒立,观察是否有水漏出;如果不漏水,再将瓶塞旋转180°后盖好,倒立,再检查是否有水漏出
将蒸馏水注入容量瓶,当液面离容量瓶颈刻
度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切
只手托住瓶底,反复上下颠倒数次
三、托盘天平的使用在配制一定物质的量浓度的溶液时,应使用分析天平或电子天平(用于精确称量的仪器),但在中学阶段可用托盘天平代替。使用托盘天平时的注意事项:①先调零,使天平平衡;②称量时,_____________________;③样品不能直接放在托盘上,应____________________________________________;④砝码要从大到小依次放,称量完毕后要将__________________________。
样品放在左盘,砝码放在右盘
在托盘上各放一张质量相同的称量纸,再将药品放在称量纸上
砝码由大到小放回砝码盒,游码复原
容量瓶、托盘天平、量筒、烧杯、玻璃棒使用时的注意事项。
1.容量瓶(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释。(2)不能作为反应容器或长期贮存溶液的容器,不能用来加热。(3)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。(4)选用容量瓶的原则———“大而近”,如需配制 90 mL 溶液,应选用 100 mL 的容量瓶。(5)选用容量瓶时应指明其规格。(6)往容量瓶中转移液体时,要用玻璃棒引流,玻璃棒末端应在容量瓶刻度线以下。
2.托盘天平(1)使用前调零。(2)药品不能直接放在托盘上。(3)左物右码,先大后小。(4)读数至小数点后 1 位。(5)用托盘天平称量,物体和砝码放反时,不一定有误差。若没有用到游码,则无误差;若用到游码,则按照“药品的质量=砝码的质量-游码的质量”来计算。
3.量筒(1)不能作为反应容器。(2)不能将浓溶液直接在量筒中稀释。(3)倒出量取的液体后不必洗涤量筒。4.烧杯(1)用于溶解固体或稀释浓溶液。(2)将溶液注入容量瓶后,必须将烧杯洗涤 2~3 次,洗涤液也注入容量瓶。5.玻璃棒(1)在溶液配制中的作用是搅拌、引流。(2)搅拌时勿触碰烧杯内壁,引流时注意玻璃棒下端应在刻度线以下。
二、分组实验,提升能力
配制 100 mL 1.00 ml/L NaCl溶液。用固体试剂配制溶液的基本步骤:
1.在溶解溶质时一般会有放热或吸热的现象,需要等液体恢复到室温才能转移入容量瓶中,为什么?
因为容量瓶的刻度线所指示的体积是在指定温度下的数据,只有在该温度下使用才能保证所配制溶液浓度的准确性。
2.将烧杯中的溶液注入容量瓶后,要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,这样操作的原因是什么?
确保溶质完全转移到容量瓶中。
3.如果在读数时,俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了? 如果在读数时,仰视容量瓶上的刻度线呢?
俯视容量瓶的刻度线时,读数偏高,液体的实际体积<读数,配成的溶液中溶质的实际浓度>要求的浓度。仰视容量瓶的刻度线时,读数偏低,液体的实际体积>读数,配成的溶液中溶质的实际浓度<要求的浓度。
三、配制一定物质的量浓度溶液时的误差分析
依据 cB=nBV ,分析实验过程中 nB、V 的变化情况,若nB 减小,则 cB 偏低,若 nB 增大,则 cB偏高;若V 增大,则 cB 偏低,则V 减小,则 cB 偏高。
以配制某浓度的NaOH溶液为例,判断cB 误差的具体情况分析。
本节课通过小组实验实操了“用固体试剂配制一定物质的量浓度的溶液”的基本步骤。容量瓶的使用,溶液配制过程中溶解、移液、定容的正确操作,以及实验误差分析是重要的考点。
1.实验室里需配制 480 mL 0.1 ml·L-1的硫酸铜溶液,以下操作正确的是 ( )A.称取 7.680 g 硫酸铜,加入 500 mL 水B.称取 12.000 g 胆矾配成 500 mL 溶液C.称取 12.500 g 胆矾配成 500 mL 溶液D.称取 8.000 g 硫酸铜,加入 500 mL 水
2.从 200 mL 6.0 ml·L-1Fe2(SO4)3 溶液中取出 10 mL 稀释至200 mL ,则稀释后溶液中SO42-的物质的量浓度是 ( ) ml· L-1 ml·L- ml· L-1 ml· L-1
3.取 100 mL 0.3 ml/L 的硝酸和 300 mL 0.25 ml/L 的硫酸注入500 mL 的容量瓶中,加水稀释至刻度线,该混合溶液中H+ 的物质的量浓度是 ( ) ml/L ml/LC.0.2 ml/L D.0.4 ml/L
4.下列说法正确的是 ( )A.将 5.85 g NaCl固体溶于 1 L 水,所得NaCl溶液物质的量浓度为0.1ml/LB.配制 480 mL 0.2 ml/L NaOH 溶液,需称量NaOH固体的质量为3.84 gC.质量分数为98%的浓硫酸与等体积水混合后,硫酸的质量分数大于49%D.定容后摇匀,发现液面低于刻度线,又补加少量水,重新达到刻度线
5.配制 400 mL 0.100 ml/L 的KCl溶液,下列说法正确的是 ( )
A.上述实验步骤的正确顺序为④①②③B.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用C.实验中需称量 2.98 g KCl固体D.定容时,若仰视容量瓶的刻度线,会使配得的KCl溶液浓度偏低
实验目的:1.练习容量瓶的使用方法。2.练习配制一定物质的量浓度的溶液。3.加深对物质的量浓度概念的认识。
一、知识梳理,夯实基础
一、基础知识1.一种或几种物质分散到另一种物质里,形成______的、______的混合物,叫做溶液。能溶解其他物质的物质叫做______,被溶解的物质叫做溶质。2.物质的量浓度表示单位体积的溶液里所含溶质 B 的_________,符号为______。100 mL 1.0 ml/L NaCl溶液表示在 1 L _______中,含有的溶质是________。
1.容量瓶是在_________________________时使用的一种__________________,是比较精确的仪器。使用时不能受热,不能用于溶解药品,也不能作为液体的 ______使用。容量瓶配有一对一的玻璃塞,不可互换。瓶体上标有__________,瓶颈上标有______。容量瓶的常用规格有______、______、______、_______四种。
配制一定物质的量浓度的溶液
2.容量瓶的使用方法(1)检验容量瓶是否漏液的方法是_____________________________________________________________________________________________________________________________________。(2)向容量瓶中加液体时要用___________。(3)容量瓶中溶液的定容方法是____________________________________ ___________________________________________________________。(4)将定容后的容量瓶中的液体混合均匀的方法是___________________———————————————。
往容量瓶中加入一定量的水,盖好并按住
瓶塞,另一只手托住瓶底,把瓶倒立,观察是否有水漏出;如果不漏水,再将瓶塞旋转180°后盖好,倒立,再检查是否有水漏出
将蒸馏水注入容量瓶,当液面离容量瓶颈刻
度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切
只手托住瓶底,反复上下颠倒数次
三、托盘天平的使用在配制一定物质的量浓度的溶液时,应使用分析天平或电子天平(用于精确称量的仪器),但在中学阶段可用托盘天平代替。使用托盘天平时的注意事项:①先调零,使天平平衡;②称量时,_____________________;③样品不能直接放在托盘上,应____________________________________________;④砝码要从大到小依次放,称量完毕后要将__________________________。
样品放在左盘,砝码放在右盘
在托盘上各放一张质量相同的称量纸,再将药品放在称量纸上
砝码由大到小放回砝码盒,游码复原
容量瓶、托盘天平、量筒、烧杯、玻璃棒使用时的注意事项。
1.容量瓶(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释。(2)不能作为反应容器或长期贮存溶液的容器,不能用来加热。(3)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。(4)选用容量瓶的原则———“大而近”,如需配制 90 mL 溶液,应选用 100 mL 的容量瓶。(5)选用容量瓶时应指明其规格。(6)往容量瓶中转移液体时,要用玻璃棒引流,玻璃棒末端应在容量瓶刻度线以下。
2.托盘天平(1)使用前调零。(2)药品不能直接放在托盘上。(3)左物右码,先大后小。(4)读数至小数点后 1 位。(5)用托盘天平称量,物体和砝码放反时,不一定有误差。若没有用到游码,则无误差;若用到游码,则按照“药品的质量=砝码的质量-游码的质量”来计算。
3.量筒(1)不能作为反应容器。(2)不能将浓溶液直接在量筒中稀释。(3)倒出量取的液体后不必洗涤量筒。4.烧杯(1)用于溶解固体或稀释浓溶液。(2)将溶液注入容量瓶后,必须将烧杯洗涤 2~3 次,洗涤液也注入容量瓶。5.玻璃棒(1)在溶液配制中的作用是搅拌、引流。(2)搅拌时勿触碰烧杯内壁,引流时注意玻璃棒下端应在刻度线以下。
二、分组实验,提升能力
配制 100 mL 1.00 ml/L NaCl溶液。用固体试剂配制溶液的基本步骤:
1.在溶解溶质时一般会有放热或吸热的现象,需要等液体恢复到室温才能转移入容量瓶中,为什么?
因为容量瓶的刻度线所指示的体积是在指定温度下的数据,只有在该温度下使用才能保证所配制溶液浓度的准确性。
2.将烧杯中的溶液注入容量瓶后,要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,这样操作的原因是什么?
确保溶质完全转移到容量瓶中。
3.如果在读数时,俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了? 如果在读数时,仰视容量瓶上的刻度线呢?
俯视容量瓶的刻度线时,读数偏高,液体的实际体积<读数,配成的溶液中溶质的实际浓度>要求的浓度。仰视容量瓶的刻度线时,读数偏低,液体的实际体积>读数,配成的溶液中溶质的实际浓度<要求的浓度。
三、配制一定物质的量浓度溶液时的误差分析
依据 cB=nBV ,分析实验过程中 nB、V 的变化情况,若nB 减小,则 cB 偏低,若 nB 增大,则 cB偏高;若V 增大,则 cB 偏低,则V 减小,则 cB 偏高。
以配制某浓度的NaOH溶液为例,判断cB 误差的具体情况分析。
本节课通过小组实验实操了“用固体试剂配制一定物质的量浓度的溶液”的基本步骤。容量瓶的使用,溶液配制过程中溶解、移液、定容的正确操作,以及实验误差分析是重要的考点。
1.实验室里需配制 480 mL 0.1 ml·L-1的硫酸铜溶液,以下操作正确的是 ( )A.称取 7.680 g 硫酸铜,加入 500 mL 水B.称取 12.000 g 胆矾配成 500 mL 溶液C.称取 12.500 g 胆矾配成 500 mL 溶液D.称取 8.000 g 硫酸铜,加入 500 mL 水
2.从 200 mL 6.0 ml·L-1Fe2(SO4)3 溶液中取出 10 mL 稀释至200 mL ,则稀释后溶液中SO42-的物质的量浓度是 ( ) ml· L-1 ml·L- ml· L-1 ml· L-1
3.取 100 mL 0.3 ml/L 的硝酸和 300 mL 0.25 ml/L 的硫酸注入500 mL 的容量瓶中,加水稀释至刻度线,该混合溶液中H+ 的物质的量浓度是 ( ) ml/L ml/LC.0.2 ml/L D.0.4 ml/L
4.下列说法正确的是 ( )A.将 5.85 g NaCl固体溶于 1 L 水,所得NaCl溶液物质的量浓度为0.1ml/LB.配制 480 mL 0.2 ml/L NaOH 溶液,需称量NaOH固体的质量为3.84 gC.质量分数为98%的浓硫酸与等体积水混合后,硫酸的质量分数大于49%D.定容后摇匀,发现液面低于刻度线,又补加少量水,重新达到刻度线
5.配制 400 mL 0.100 ml/L 的KCl溶液,下列说法正确的是 ( )
A.上述实验步骤的正确顺序为④①②③B.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用C.实验中需称量 2.98 g KCl固体D.定容时,若仰视容量瓶的刻度线,会使配得的KCl溶液浓度偏低













