



人教版 (2019)必修 第一册第一节 钠及其化合物教学ppt课件
展开松软的面包和蛋糕、酥脆的饼干深受人们的欢迎,而它们之所以那么松软或酥脆,是因为在制作的过程中用了膨松剂。
酵头 用酵头发酵是我国传统的馒头制作方法。酵头是前一次发面蒸馒头时留下的一小团面,由于里面有很多酵母菌等微生物,再次发面时可用来使面团发酵。酵头的发酵原理是:面团在酵母菌以及一定种类和数量的其他微生物的共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团内部形成海绵状结构,变得疏松;为减轻酸味、改善口感,常在面团中加入碱性物质(如Na2CO3溶液,俗称碱水,或NaHCO3溶液)中和乳酸、醋酸等,这个过程也会产生二氧化碳,使面团变得更加松软。不过,若碳酸钠加入的量过多,会使蒸出的馒头发黄、带有碱味。酵头属于膨松剂中的生物膨松剂。
一、碳酸钠和碳酸氢钠的物理性质
[实验探究]碳酸钠和碳酸氢钠的物理性质
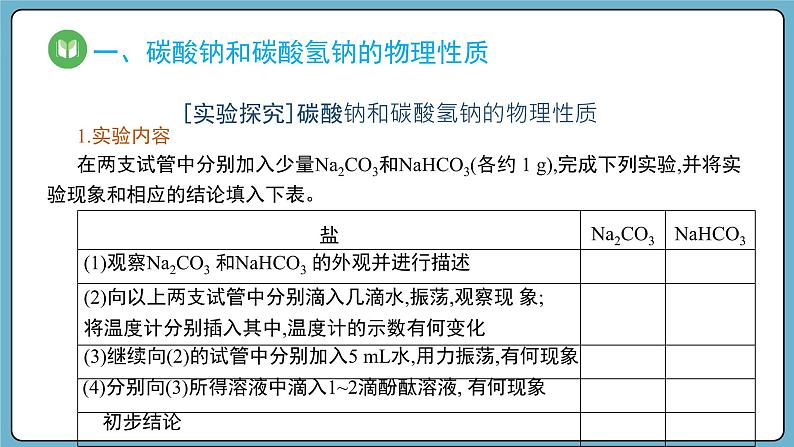
1.实验内容在两支试管中分别加入少量Na2CO3和NaHCO3(各约 1 g),完成下列实验,并将实验现象和相应的结论填入下表。
(1)观察Na2CO3 和NaHCO3 的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现 象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液, 有何现象
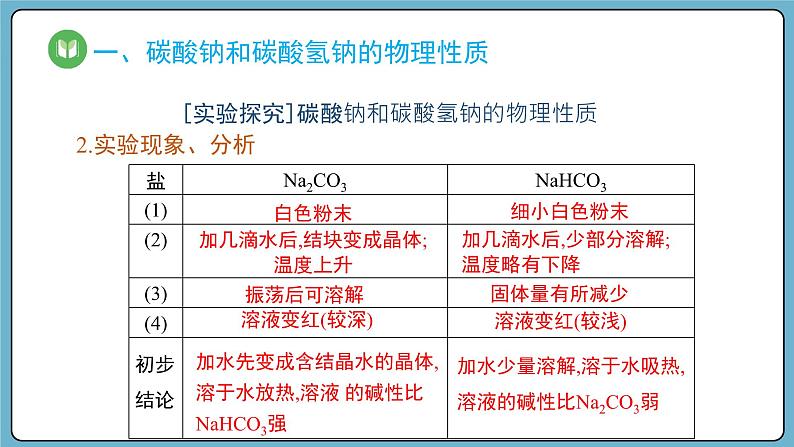
加水少量溶解,溶于水吸热,溶液的碱性比Na2CO3弱
加几滴水后,结块变成晶体;温度上升
加几滴水后,少部分溶解;温度略有下降
加水先变成含结晶水的晶体,溶于水放热,溶液 的碱性比 NaHCO3强
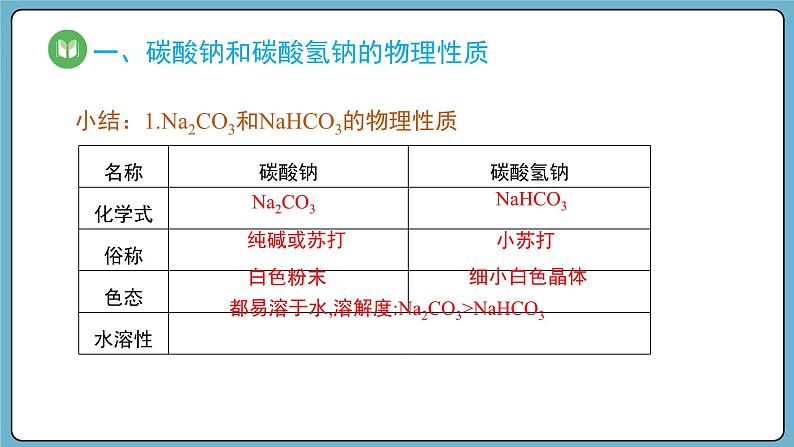
小结:1.Na2CO3和NaHCO3的物理性质
都易溶于水,溶解度:Na2CO3>NaHCO3
2.Na2CO3和NaHCO3的主要用途
二、碳酸钠和碳酸氢钠的化学性质
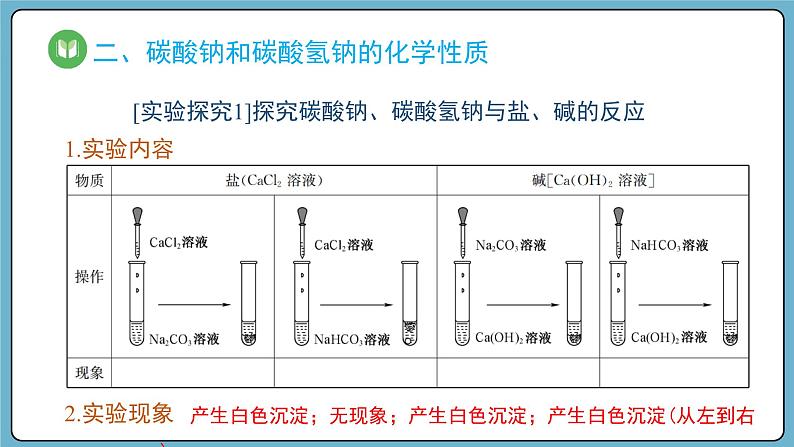
[实验探究1]探究碳酸钠、碳酸氢钠与盐、碱的反应
产生白色沉淀;无现象;产生白色沉淀;产生白色沉淀(从左到右)
[实验探究2]探究碳酸钠和碳酸氢钠的热稳定性
1.实验内容 如下图所示,加热装有 Na2CO3 和 NaHCO3 固体的试管,观察现象,比较 Na2CO3 和 NaHCO3 的热稳定性。
小试管中棉花球变蓝色,B烧杯中澄清石灰水变浑浊;A烧杯中有少量气泡冒出,且A烧杯中澄清石灰水不变浑浊
Na2CO3 受热不分解; 由此可知,热稳定性:Na2CO3>NaHCO3
[实验探究3]碳酸钠、碳酸氢钠与盐酸反应的比较
在两支试管中分别加入 3 mL 稀盐酸,将两个各装有少量等质量的 Na2CO3、NaHCO3 粉末的小气球分别套在两支试管的管口;将气球内的 Na2CO3 和 NaHCO3 固体同 时倒入试管中,观察现象
两个气球均膨胀;NaHCO3 与盐酸混合比Na2CO3与盐酸混合气球膨胀得快且大
小结:1.Na2CO3、NaHCO3 的比较
1.Na2CO3、NaHCO3 的比较
3.碳酸钠与盐酸反应,滴加顺序不同,反应现象不同。
4.HCO3− 在强酸或强碱溶液中均不能存在;Ca2+ 与 HCO3−只能共存于极稀的溶液中。 5.在书写 NaHCO3 与Ca(OH)2 反应的化学方程式时,将量少的物质的系数定为1,再配 平其他物质的系数(以少定多的原则)。
6.碳酸钠、碳酸氢钠的鉴别方法
立即产生气体的是NaHCO3;开始不产生气体,滴加一会儿才产生气体的是Na2CO3
有气体产生的是NaHCO3;无变化的是Na2CO3
分别逐滴加入盐酸,是否立即产生气泡
分别加入同浓度的盐酸中时,生成气体的剧烈程度不同
生成气体剧烈的是NaHCO3;相对不剧烈 的是 Na2CO3
[易错提醒]Na2CO3溶液和NaHCO3溶液不能用Ba(OH)2或Ca(OH)2 溶液鉴别,因为两者与Ba(OH)2、Ca(OH)2溶液反应均产生白色沉淀。
7.碳酸钠、碳酸氢钠的除杂方法
加入适量的 NaOH溶液
[问题思考1]工业上以水、食盐、氨气和二氧化碳为原料,先制备碳酸氢钠,然后再加热碳酸氢 钠得到碳酸钠固体。你知道其中的制备原理吗? (已知:溶解度———NH3 为700,CO2 为 1 )
1.“侯氏制碱法”的原料、原理和生产流程
[问题思考1]节日的焰火五颜六色,你知道其中的奥妙吗? 实验室我们该如何鉴别 NaCl、KCl 这两种无色溶液呢?
[实验探究]《焰色实验》
1.实验内容 把熔嵌在玻璃棒上的铂丝(或用光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼 烧,至与原来的火焰颜色相同时为止。用铂丝(或铁丝)蘸取碳酸钠溶液,在外焰上灼烧,观察火焰的颜色。 将铂丝(或铁丝)用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,再蘸取碳酸钾溶液做同样的实验,此时要透过蓝色钴玻璃观察火焰的颜色。
2.实验注意事项焰色试验最好使用煤气灯,因为煤气灯的火焰颜色是淡蓝色的,这样有助于观察火焰颜色的变化;观察钾元素的焰色时,要透过蓝色的钴玻璃观察,其中钴玻璃的作用是滤去样品中可能含有的钠元素所发出的黄光。
3.焰色试验的定义很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,由此可判断试样所含的 金属元素,化学上把这样的定性分析操作称为焰色试验。
5.焰色试验的注意事项 (1)焰色试验是元素的性质,焰色试验产生的火焰颜色与元素的存在状态无关。 (2)焰色试验属于物理变化,不属于化学变化。 (3)因为铂丝灼烧时火焰没有特殊颜色,因此常用铂丝作为焰色试验的载体,其他金属,如 光洁无锈的铁丝或镍、铬、钨丝等灼烧时火焰也没有特殊颜色,也可以用作焰色试验的载体。 (4)洗涤铂丝或铁丝时用稀盐酸,不能用稀 HNO3 和稀 H2SO4。 (5)进行钾元素的焰色试验时,为了滤去黄色的光,避免碳酸钾中所含的微量钠盐造成干 扰,需要透过蓝色钴玻璃片观察,火焰呈紫色。
6.一些金属元素的焰色
7.焰色试验的应用(1)检验金属元素的存在,如:鉴别 NaCl和 KCl溶液。(2)利用焰色反应制节日烟花。
8. 焰色试验的易错点(1)焰色试验是物理变化而不是化学变化。(2)焰色试验是金属元素的性质,不是物质的性质。 (3)并不是所有的金属元素都能发生焰色试验,如 Fe 无焰色试验。(4)在中学化学实验中要求掌握钠、钾的焰色试验,对于 K+ 的焰色试验必须透过蓝色钴 玻璃进行观察,以防止 Na+ 对其造成干扰。
一、Na2CO3、NaHCO3的共性 1.都能与酸反应放出CO2。 2.都跟石灰水或氢氧化钡溶液反应生成白色沉淀。 3.水溶液均呈碱性。 4.焰色试验均呈黄色
二、Na2CO3、NaHCO3的差异 1.热稳定性不同:Na2CO3 加热不分解;NaHCO3 受热分解:
2.溶解度不同:Na2CO3溶解度大于NaHCO3。
二、Na2CO3、NaHCO3的差异
1. 下面有关 Na2CO3 与 NaHCO3 的性质比较的说 法中错误的是 ( ) A.相同浓度的溶液的碱性: Na2CO3 >NaHCO3 B.同 一 条 件 下 在 水 中 的 溶 解 度: Na2CO3 > NaHCO3 C.与 同 浓 度 的 盐 酸 反 应 放 出 气 泡 的 速 率: NaHCO3< Na2CO3 D.热稳定性:NaHCO3
3.节日燃放的五彩缤纷的烟花,都与“焰色试验”相关。下列说法正确的是 ( ) A.焰色试验均应透过蓝色钴玻璃观察 B.NaCl与 Na2CO3 在灼烧时火焰颜色相同 C.焰色试验是化学变化 D.所有金属及其化合物在灼烧时火焰均有颜色
4.“侯氏制碱法”是我国化工专家侯德榜为世界制 碱工业作出的突出贡献。某实验小组模拟“侯氏制碱 法”的工艺流程如图:
下列有关说法正确的是 ( ) A.A气体是 NH3,B气体是CO2 B.第Ⅲ步得到晶体是 Na2CO3·10H2O C.第Ⅳ步操作用到的主要仪器是酒精灯、蒸发皿、 玻璃棒 D.在整个流程中可循环利用的物质只有 NH3
人教版 (2019)必修 第一册第一节 钠及其化合物教学ppt课件: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学ppt课件,共37页。PPT课件主要包含了素养要求,碳酸钠和碳酸氢钠,焰色试验,课堂检测等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt,共23页。PPT课件主要包含了夯基提能·一遍过,浅红色,制玻璃,焙制糕点,答案B,答案D,小苏打,焰色试验等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt,文件包含第1课时初步认识比热容pptx、加热水和煤油mp4、比较水沙石的比热容mp4、比较金属的比热熔冰mp4、水和煤油的吸热能力对比mp4、水和煤油的吸热能力对比swf等6份课件配套教学资源,其中PPT共23页, 欢迎下载使用。












