


所属成套资源:2023永州一中高二下学期开学考试及答案(九科)
2023永州一中高二下学期开学考试化学试题含答案
展开
这是一份2023永州一中高二下学期开学考试化学试题含答案,文件包含湖南省永州市第一中学2022-2023学年高二下学期开学考试化学试题docx、湖南省永州市第一中学2022-2023学年高二下学期开学考试化学参考答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
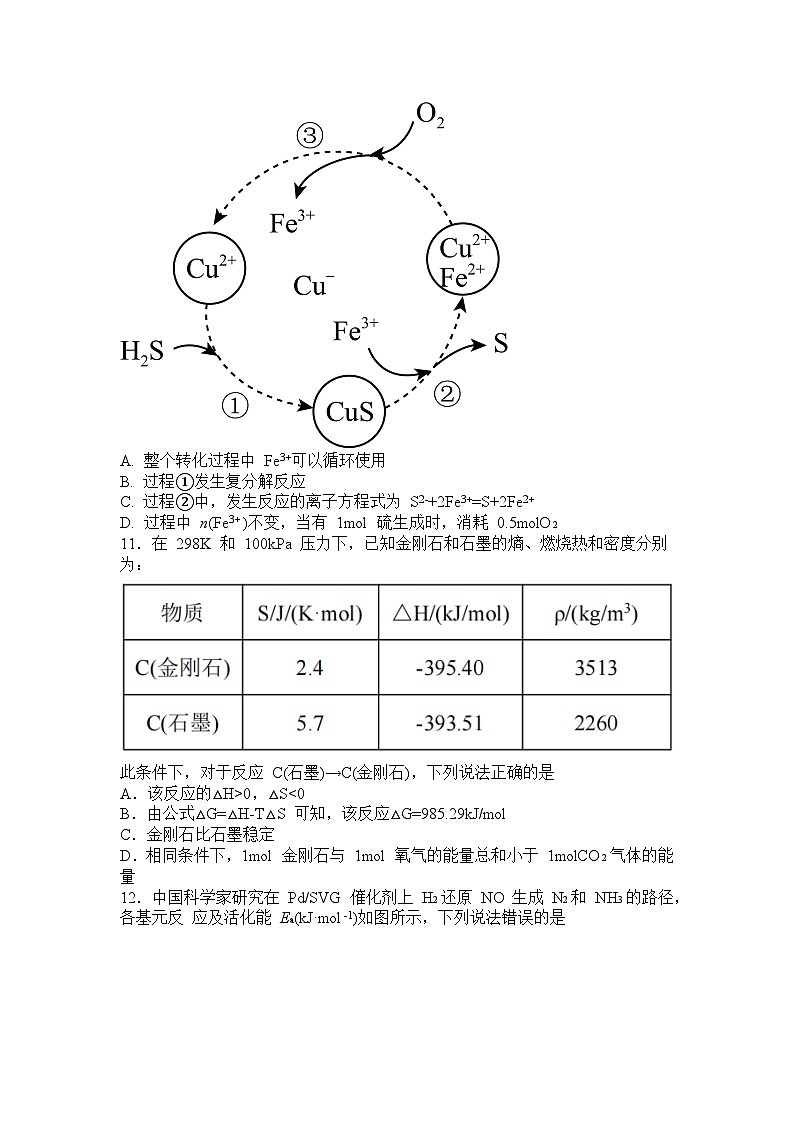
永州市一中2023年下期高二入学考试化学试卷考生注意: 1、本科目试卷共8页。时量:75分钟,满分:100分。答题前,考生务必将自己的姓名、班级、考室号、座位号填入相应位置内 2、客观题请用2B铅笔填涂在答题卡上,主观题用黑色的签字笔书写在答题卡上。考试结束时,只交答题卡,试题卷请妥善保管。 3、可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56 Cu-64 一、选择题:(本题共 14 个小题,每小题 3 分,共 42 分。每小题只有一项符合题意) 1.分类是化学学习的重要方法,下列有关物质的分类,正确的是 A. 化合物:BaCl2、Ca(OH)2、HNO3、HD B. 碱性氧化物:CaO、CuO、Na2O、Fe3O4 C. 混合物:漂白粉、冰水混合物、氯水、赤铁矿 D. 同素异形体:C60、金刚石、石墨、碳纳米管 2.下列关于化学反应速率的说法正确的是 A.升高温度可降低化学反应的活化能,提高活化分子百分数,加快化学反应速率 B.反应物浓度增大,单位体积内活化分子数增多,有效碰撞的几率增加,反应速率增大 C.在相同温度下,两个相同的容器中分别充入相同物质的量的 F2和 Cl2,让它们与等量的氢气反应,反应速率相同 D.有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快 3.在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明反应: A(s)+2B(g)C(g)+D(g)已达到平衡状态的是 ①混合气体的压强 ②混合气体的密度 ③B 的物质的量浓度 ④气体的总物质的量 ⑤混合气体总质量 A.②③⑤ B.①②③ C.②③④ D.①③④⑤ 4.用 NA表示阿伏加德罗常数的值,下列叙述中正确的是 A. 0.1mol 的 11B 中,含有的中子数为 1.1NA B. 标准状况下,2.24LN2和 O2的混合气体中分子总数为 0.2NA C. 1molCl2与足量 Fe 反应,转移的电子数为 3NA D. 25℃、1.01×105Pa 时,22gCO2中含有的原子数为 1.5NA 5.在 1 200 ℃时,天然气脱硫工艺中会发生下列反应: ①H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2 ③H2S(g)+O2(g)===S(g)+H2O(g) ΔH3 2S(g)===S2(g) ΔH4,则ΔH4的正确表达式为 A.ΔH4=(3ΔH3-ΔH1-ΔH2) B.ΔH4=(ΔH1+ΔH2-3ΔH3) C.ΔH4=(ΔH1+ΔH2-3ΔH3) D.ΔH4=(ΔH1-ΔH2-3ΔH3) 6.能正确表示下列化学反应的离子方程式是 A.将 NaHSO4溶液滴入 Ba(OH)2溶液中至溶液呈中性: 2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O B. 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42- =BaSO4↓ C. 向澄清石灰水中通入足量 CO2:2OH- +CO2+Ca2+=CaCO3↓+H2O D. 用 FeCl3溶液腐蚀覆铜板制作电路板:Fe3++Cu=Fe2++Cu2+ 7.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2 (g) +O2(g) = H2O (l) △H =-285.8 kJ/mol CO(g) +O2(g) = CO2(g) △H =-283 kJ/mol C8H18 (l) +O2(g) = 8CO2(g) + 9H2O (l) △H =-5518 kJ/mol CH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H =-890.3 kJ/mol 相同质量的 H2、CO、C8H18、CH4完全燃烧时,放出热量最多的是 A.H2 (g) B.CO(g) C.C8H18 (l) D.CH4 (g) 8.海水中溴元素以 Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:下列说法错误的是 A.步骤①、④说明氧化性:Cl2>Br2 B.步骤②的空气吹出是利用了溴单质易挥发的特点 C.步骤③中氧化产物和还原产物的物质的量之比为 1:1 D.步骤⑤蒸馏过程中,温度过高可能会降低产品的纯度 9.苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显作用的健康食品。苹果醋是这种饮料的主要酸性物质,苹果酸的结构简式为。下列相关说法不正确的是 A.苹果酸在一定条件下能发生催化氧化反应、酯化反应 B.1mol 苹果酸与足量 NaHCO3溶液反应消耗 2molNaHCO3 C.1mol 苹果酸与足量 Na 反应生成 33.6LH2(标准状况下) D.1mol 苹果酸分别和足量 Na 或 NaOH 反应消耗两者物质的量相等 10.将 H2S 和空气的混合气体通入 FeCl3、FeCl2和 CuCl2的混合溶液中回收 S,其转化如图所示(CuS 不溶于水)。下列说法错误的是 A. 整个转化过程中 Fe3+可以循环使用 B. 过程①发生复分解反应 C. 过程②中,发生反应的离子方程式为 S2-+2Fe3+=S+2Fe2+ D. 过程中 n(Fe3+ )不变,当有 1mol 硫生成时,消耗 0.5molO2 11.在 298K 和 100kPa 压力下,已知金刚石和石墨的熵、燃烧热和密度分别为: 此条件下,对于反应 C(石墨)→C(金刚石),下列说法正确的是 A.该反应的△H>0,△S<0 B.由公式△G=△H-T△S 可知,该反应△G=985.29kJ/mol C.金刚石比石墨稳定 D.相同条件下,1mol 金刚石与 1mol 氧气的能量总和小于 1molCO2气体的能量 12.中国科学家研究在 Pd/SVG 催化剂上 H2还原 NO 生成 N2和 NH3的路径,各基元反 应及活化能 Ea(kJ·mol-1)如图所示,下列说法错误的是 A.生成 NH3的各基元反应中,N 元素均被还原 B.在 Pd/SVG 催化剂上,NO 更容易被 H2还原为 NH3 C.决定NO生成NH3速率的基元反应为NH2NO→NHNOH D.生成 NH3的总反应方程式为 2NO+5H22NH3+2H2O 13.已知常温下,N2(g)和 H2(g)生成 2mol NH3(g)放出 92.4 kJ 热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入 1 molN2和 3 mol H2,达到平衡时放出热量 Q1kJ。②向密闭容器乙中通入 0.5 mol N2和 1.5 mol H2,达到平衡时放出热量 Q2kJ。则下列关系式正确的是 A.Q1=2Q2=92.4 B.92.4 >Ql>2Q2 C.92.4=Q1>2Q2 D.92.4 >Q1=2Q2 14.已知反应 N2O4(g)2NO2(g) ΔH>0 的平衡体系中,物质的总质量(m 总)与总物质的量(n 总)之比 M(M=)在不同温度下随压强的变化曲线如图。下列说法正确的是 A.温度:T1<T2 B.当 M=69 g·mol-1时,n(NO2)∶n(N2O4)=1∶1 C.反应速率:vb<va D.平衡常数:K(a)=K(b)<K(c) 二、非选择题:(本题包括 4 道题,共 58 分) 15.(16 分)实验室用 50 mL 0.50mol/L 盐酸、50mL 0.55 mol/LNaOH 溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题: (1)图中实验装置中尚缺少的玻璃仪器是____________________________。 (2)请填写表中的空白________________________。 (3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_____[盐酸和 NaOH溶液的密度按 1g/cm3计算,反应后混合溶液的比热容(c)按 4.18J/(g·℃)计算]. (4)如改用 60 mL0.50moI/L 的盐酸与 50 mL 0.55mol/L 的 NaOH 溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。 (5)若用等体积等物质的量浓度的 CH3COOH 代替盐酸进行上述实验,生成 1 mol H2O(l)时,所测得的中和反应的反应热的绝对值(|ΔH|)将________(填“偏大”“偏小”或“无影响”),判断的理由是_____________________________________。 (6)上述实验结果数值与 57.3 相比有偏差,产生偏差的原因可能是(填字母)______。 A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.量取盐酸时仰视读数 D.大烧杯的盖扳中间小孔太大 16.(12 分)工业上利用硫铁矿烧渣(主要成分为 Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下: 试回答下列问题: (1)滤液 X 中含有的金属阳离子是 (填离子符号)。 (2)①步骤Ⅱ加入过量铁粉的目的是将 。 ②步骤Ⅲ中最好选用 (填字母)调节溶液的 pH。 a.次氯酸钙 b.氨水 c.氢氧化钠溶液 d.高锰酸钾溶液 (3)①步骤Ⅳ加入 NH4HCO3时的离子方程式: 。 ②步骤Ⅳ中 FeCO3沉淀完全后,溶液中含有少量 Fe2+,检验 Fe2+的方法是 。 (4)在空气中煅烧 a g FeCO3得到 b g 产品氧化铁,则 FeCO3的纯度为 。 17.(12 分)氮元素及其化合物知识是中学化学中非常重要的部分,某校学习兴趣小组同学开展了以下研究:某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将 NO 氧化成 NO2,而稀硝酸不能氧化 NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。 可选药品:浓硝酸、3mol/L 稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。 已知:氢氧化钠溶液不与NO反应,与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。 (1)实验应避免有害气体排放到空气中,装置③、⑥中盛放的药品依次是 、 。 (2)装置①中发生反应的化学方程式是 。 (3)该小组得出的结论所依据的实验现象是 。 (4)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下 4 个实验来判断两种看法是否正确。这些方案中可行的是 (填字母)。 A.加热该绿色溶液,观察颜色变化 B.加水稀释该绿色溶液,观察颜色变化 C.向该绿色溶液中通入氮气,观察颜色变化 D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 (5)利用下图所示的实验装置模拟工业生产制备少量硝酸。 欲使氨气尽可能完全转化为硝酸,理论上 n(NH3):n(O2)的最佳比例为 。 18.(18 分)二甲醚(DME)被誉为“21 世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下: ①CO(g)+2H2(g)CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1 ②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2 ③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3 回答下列问题: (1)反应 3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的ΔH=________kJ·mol-1;该反应的平衡常数 K=________(用 K1、K2、K3表示)。随温度的升高,该反应的平衡常数 K 的变化趋势是________(填增大、减小、或不变) (2)下列措施中,能提高(1)中 CH3OCH3产率的有________(填字母)。 A.使用过量的CO B.升高温度 C.增大压强 (3)一定温度下,将 0.2 mol CO 和 0.1 mol H2O(g)通入 2 L 恒容密闭容器中,发生反应③,5 min 后达到化学平衡,平衡后测得 H2的体积分数为 0.1。则 0~5 min 内v(H2O)=________,CO 的转化率为________,向上述平衡体系中再充入 0.2 mol CO 和 0.1 mol H2O(g),再次达到平衡时,H2的体积分数________0.1(填大于、小于、或等于) (4)将合成气以=2 通入 1 L 的反应器中,一定条件下发生反应:4H2(g)+ 2CO(g)CH3OCH3(g)+H2O(g) ΔH,其中 CO 的平衡转化率随温度、压强 的变化关系如图 1 所示,下列说法正确的是______(填字母)。 A.ΔH<0 B.p1>p2>p3 C.若在 p3和 316 ℃时,起始时=3,则平衡时,α(CO)小于 50% (5)采用一种新型的催化剂(主要成分是 Cu-Mn 的合金),利用 CO 和 H2制备二甲醚(DME)。观察图 2,当约为______时最有利于二甲醚的合成。 {#{QQABIYqQgggAQAIAARhCUQEwCgEQkBEAAAgOhAAEoAAAyAFABAA=}#}
相关试卷
这是一份2024永州一中高二下学期3月月考化学试题含答案,文件包含湖南省永州市第一中学2023-2024学年高二下学期3月月考化学试题docx、湖南省永州市第一中学2023-2024学年高二下学期3月月考化学试题答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份2024永州一中高二下学期开学考试化学试题含解析,文件包含湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题原卷版docx、湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题含解析docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
这是一份2024永州一中高二下学期开学考试化学试题含解析,文件包含湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题原卷版docx、湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题含解析docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。








