






开学第一课 高二化学 第一课 走进化学反应原理(人教版2019 选择性必修一)课件PPT
展开化学研究的核心问题是化学反应。
化学反应是怎样发生的?为什么有的反应快、有的反应慢?它遵循怎样的规律?如何控制化学反应为人所用?
——这就是学习化学反应原理的目的
化学中最有创造性的工作是设计和创造新的分子。
化学家们通常是利用已发现的原理来进行设计并实现这个过程,如果对化学原理的理解不够清楚则无法做到。
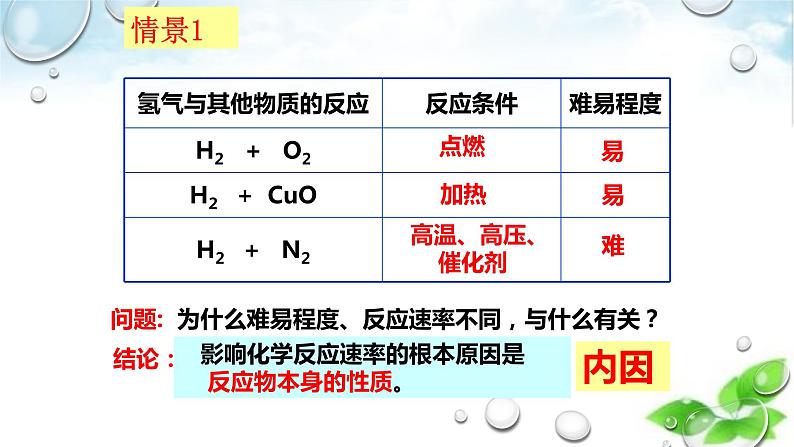
问题: 为什么难易程度、反应速率不同,与什么有关?
影响化学反应速率的根本原因是 反应物本身的性质。
将H2 +O2混合,在室温条件下可以稳定存在数百年,但点燃后却会发生剧烈的爆炸反应,而且只要配比相当,可以完全转化成生成物。这说明了什么?
不同的外界条件都能够改变化学反应的速率。
而H2+N2即使在高温、高压、催化剂的条件下反应也不能完全转化为生成物,这又说明了什么?
有些反应是有一定限度的
H2 +O2混合,只要配比相当,点燃可以完全转化成生成物;
综上:化学反应看似十分复杂,其实是有规律 可循,这正是化学的精髓和魅力所在。
化学能与热能、电能的转化
第一章 化学反应的热效应
第二章 化学反应速率和化学平衡
第三章 水溶液中的离子反应与平衡
第四章 化学反应与电能
合理简化的概念模型是学习和研究化学反应原理的基础。
从物质结构变化上看,化学反应的过程,其实是怎样的一个过程?
旧的(反应物分子内)化学键断裂、新的(生成物分子内)化学键形成的过程。
分子、原子处于高速的运动状态中,反应物分子不断发生碰撞,可能导致化学键的断裂,形成新化学键,从而产生新的分子,发生了化学反应。
是不是所有的碰撞都能发生化学反应呢?
能够导致化学键断裂,引起分子间的化学反应的碰撞。
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充要条件
某一化学反应的速率大小与单位时间、单位体积内有效碰撞的次数有关
为什么有的碰撞可以发生反应,而有的不能发生反应?与哪些因素有关系?
①反应物分子具有较高的能量
②发生碰撞的分子有适合的取向
1. 什么是活化分子?
具有较高能量,能够发生有效碰撞的分子。
活化分子高出反应物分子平均能量的部分。
发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关。
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应?
活化能与反应热有关吗?
有没有活化能为0的反应?
测定:活化能是决定化学反应难易的关键。不同的化学反应,活化能差别很大。一个具体的反应,活化能的值只能通过实验方法测得。
获得:加热、光照、核辐射、摩擦、外加磁场。
有,例如:H+和OH-的中和反应,Cl-和Ag+的沉淀反应。还有原子间的反应,这些反应的活化能几乎为零。
3.活化能的测定与获得
催化剂在我们技术改造和生产中起关键作用,它主要作用是改变化学反应速率。
例如:MnO2对H2O2分解反应的催化;合成氨中Fe触媒的催化,酶对生命过程的催化等。
归 纳 总 结
一个反应要发生一般要经历哪些过程?
下列说法错误的是A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应B.发生有效碰撞的分子一定是活化分子C.活化分子间的碰撞一定是有效碰撞D.活化分子间每次碰撞都发生化学反应E.能发生有效碰撞的分子必须具有较高的能量F.活化能指活化分子多出反应物分子能量的那部分能量G.催化剂能使不起反应的物质间发生反应
解 释 问 题
2、为什么可燃物有氧气参与,还必须达到着火点才能燃烧?
3、试想一下为什么催化剂能提高反应速率?
1.活化能的作用是什么?与我们前面学过的哪部分能量相等?
作用:使化学键断裂。即,断开化学键需要吸收的能量。
提供反应物分子变成活化分子所需的能量。
催化剂可以改变活化能的大小。
【开学第一课】人教版(2019)高一化学必修第一册--开学第一课 课件: 这是一份必修 第一册全册综合集体备课ppt课件,共20页。PPT课件主要包含了什么是化学,化学的内涵,化学与生活的联系,对病毒的防护,高中化学课程,初高中化学差异,2能力要求不同,课堂要求,1课堂要求,2课堂纪律等内容,欢迎下载使用。
化学选择性必修1第二节 电解池优秀课件ppt: 这是一份化学选择性必修1第二节 电解池优秀课件ppt,共20页。PPT课件主要包含了电解原理等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡试讲课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡试讲课ppt课件,共17页。PPT课件主要包含了学习目标,解题思路,ct图像,nt图像,各类图象的归纳小结,浓度-时间图,先拐先平数值大,T2>T1,升温左移,ΔH<0等内容,欢迎下载使用。












