

河南省南阳市2021-2022学年高三上学期期中考试化学【试卷+答案】
展开
这是一份河南省南阳市2021-2022学年高三上学期期中考试化学【试卷+答案】,共13页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。
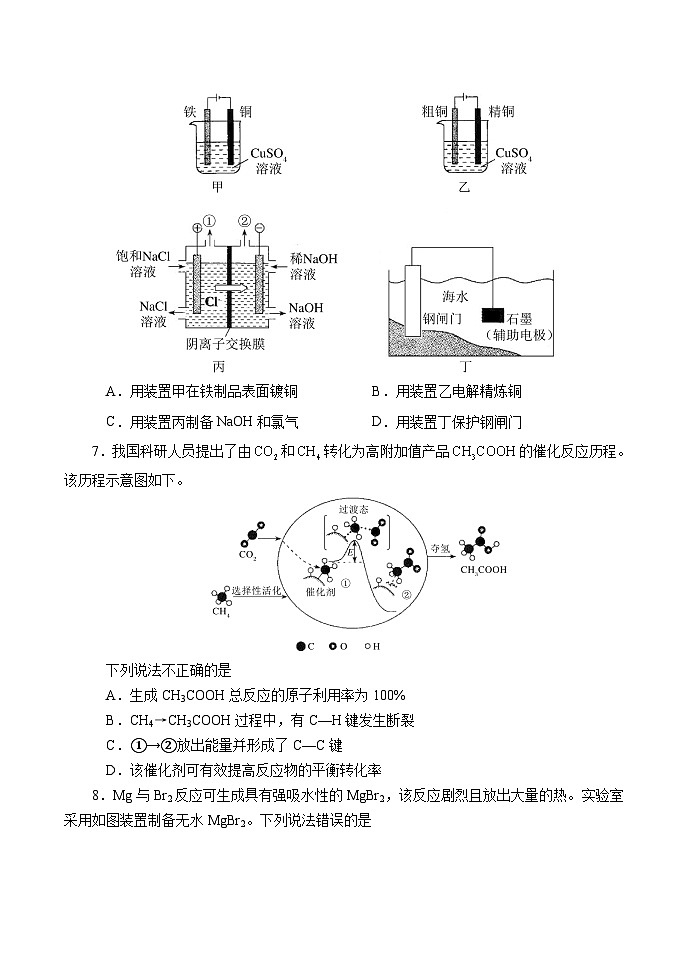
南阳市2021年秋期高中三年级期中质量评估化 学 试 题注意事项:1.本试卷分第I卷(选择题)和第II卷(非选择题)。满分100分,考试时间90分钟。答题前务必将自己的姓名、准考证号填写在答题卡规定的位置。2.答选择题时,必须用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。3.答非选择题时,必须用0.5mm黑色签字笔,将答案书写在答题卡规定的位置上。4.所有题目必须在答题卡上作答,在试题卷上答题无效。5.可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Ba 137 第Ⅰ卷 选择题(共48分)一、选择题(本题包括16小题,每题3分,共48分,每小题只有一个选项符合题意)1.下列选项错误的是A.乙二醇溶液可用作汽车防冻液B.聚乙炔可导电,可用作防静电材料C.氧化钙可用作食品干燥剂D.风能发电,粮食酿酒,石油裂化都有利于实现“碳达峰、碳中和”2.下列表示正确的是A.分子的球棍模型 B.氨基的电子式:C.乙酸乙酯和葡萄糖的实验式都为D.对苯二甲醛的结构简式:3.下列有关实验现象及结论等叙述正确的有①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,说明X具有碱性②将HClO3滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,非金属性:C > B⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质A.0条 B.1条 C.2条 D.3条4.甲、乙、丙三种不同的物质中均含有同一种元素,反应④为置换反应,往乙溶液中滴加KSCN溶液,乙溶液变为血红色。它们之间的转化关系如图所示(部分反应物及生成物已略去)。下列说法错误的是A.反应①、②可能为化合反应B.反应④的另一反应物可以为离子化合物的水溶液C.甲为金属单质,也可能为非金属单质D.若甲为金属单质,甲、乙、丙中的相同元素化合价不同5.根据下列实验操作,实验现象和所得出的结论都正确的是 选项实验操作实验现象结论A在FeCl3溶液中加入KI溶液,再加入苯,振荡下层呈紫色Fe3+的氧化性比I2强B向PbO2中滴入浓盐酸生成黄绿色气体PbO2具有还原性 C向溶液X中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口石蕊试纸不变蓝不能确定溶液X中是否存在NH4+D取久置的Na2O2粉末,向其中滴加过量的稀盐酸产生无色气体Na2O2没有变质6.下列电化学装置正确且能达到目的的是A.用装置甲在铁制品表面镀铜 B.用装置乙电解精炼铜C.用装置丙制备NaOH和氯气 D.用装置丁保护钢闸门7.我国科研人员提出了由和转化为高附加值产品的催化反应历程。该历程示意图如下。下列说法不正确的是A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C—H键发生断裂C.①→②放出能量并形成了C—C键D.该催化剂可有效提高反应物的平衡转化率8.Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量的热。实验室采用如图装置制备无水MgBr2。下列说法错误的是A.a为冷却水进水口B.装置A的作用是吸收水蒸气和挥发出的溴蒸气C.实验时需缓慢通入N2,防止反应过于剧烈D.不能用干燥空气代替N2,因为副产物MgO会阻碍反应的进行9.短周期元素W、X、Y、Z的原子序数依次增大,浙江大学研究团队以aY2X3·bZX2(固态物质,a,b为系数)为载体,利用纳米颗粒催化气态单质、合成,其原理如下图所示。下列说法错误的是A.元素主要化合价(最高正价):Z>Y B.地壳中元素含量:X>Z>YC.、均具有较高熔点 D.与形成的化合物只含极性键10.实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:已知:碘的熔点为113℃,但固态的碘可以不经过熔化直接升华。下列说法错误的是A.操作①和③中的有机相从分液漏斗下端放出B.操作②中发生反应的离子方程式为2IO3- +5SO32-+2H+=I2+5SO42-十H2OC.操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶D.操作⑤可用如图所示的水浴装置进行11.在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应。已知:①半反应式:②五种物质:、、、、KI③(未配平)下列判断错误的是A.①中半反应在原电池中可作为负极反应B.②中五种物质中能使①顺利发生的物质为C.是反应③的一个半反应D.几种物质的氧化性强弱顺序为MnO4->Fe3+>Cu2+12.以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法错误的是A.放电过程中,K+均向正极移动B.放电过程中,N2H4—O2燃料电池的KOH物质的量不变,(CH3)2NNH2—O2燃料电池的KOH物质的量减小C.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大D.消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L13.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是A.常温下,中性溶液中,、、、I-能大量共存B.向FeI2的溶液中通入少量氯气充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-D.向溶液中滴加少量氯水,再加入溶液振荡,静置,有机层呈橙色14.β-苯基丙烯醛(结构简式如丁所示)可用于水果保鲜或食用香料,合成路线如图。下列说法正确的是A.甲与乙互为同系物B.反应①为取代反应,反应②为消去反应C.甲,乙,丙,丁四种物质都既有氧化性又有还原性D.丙和丁互为同分异构体15.在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g),发生反应:2X(g)+Y(g)3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是A.该反应为吸热反应B.升高温度,平衡右移,正反应速率减小,逆反应速率增大C.Q点时Z的体积分数最大D.W,M两点Y的正反应速率相等16.运载火箭“太空发射系统”于2018年执行首次飞行任务,其所需燃料为高能火箭燃料肼()。该物质燃烧过程中的能量变化如图所示。已知:化学键N—NO=ONNO—HN—H键能/(kJ·mol-1)159498943460a下列判断不正确的是A.表中的a=389B.图示中的△H3=+2249kJ·mol-1C.H-O比H-N稳定D.在氧气中燃烧的热化学方程式为第II卷 非选择题(共52分)二、非选择题(本题共5小题,共52分)17.(12分)研究氮、碳及其化合物的资源化利用具有重要的意义。(1)过渡金属催化还原氮气合成氨具有巨大前景。催化过程一般有吸附-解离-反应-脱附等过程,图示为和在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
氨气的脱附是过程______(填“吸热”或“放热”),合成氨的热化学方程式为___________;若将2.0 mol和6.0 mol通入体积为1L的密闭容器中,分别在和温度下进行反应。曲线A表示温度下的变化,曲线B表示温度下的变化,温度下反应到a点恰好达到平衡。①温度______(填“>”“<”或“=”下同)T2。T1温度下恰好平衡时,曲线B上的点为b(m,n),则m______12,n______2;②T2温度下,若某时刻,容器内气体的压强为起始时的80%,则此时v(正)______ v(逆) (填“>”“<”或“=”)。(2)以焦炭为原料,在高温下与水蒸气反应可制得水煤气,涉及反应如下:a.b.c.CO(g)+H2O(g)三个反应的平衡常数随温度变化的关系如图所示,则表示的曲线分别是_______、_______、_______。(3)在Cu-ZnO催化下,同时发生如下反应①、②,是解决温室效应和能源短缺的重要手段。①②在容积不变的密闭容器中,保持温度不变,充入一定量的和,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示: CO2H2CH3OHCOH2O总压强/KPa起始/mol0.50.9000P0平衡/mol n 0.3p若容器内反应①、②均达到平衡时,,反应①的平衡常数=___。(用含p的式子表示) 18.(8分)下图中X、Y、Z为单质,其它为化合物,它们之间存在如下转化关系(部分产物已略去)。已知,G溶液中滴加KSCN溶液显血红色,Z单质是航空工业常用的金属材料。回答下列问题:(1)A物质的化学式为 ,组成单质Z的元素在周期表中的位置是 。(2)一定条件下,Z的氢化物与水反应的化学方程式为 。 (3)A和D的稀溶液反应的现象为 。 (4)标况下,将Y和NO2混合充满于烧瓶中,再将烧瓶倒扣水槽中,最后水充满了烧瓶。则烧瓶中D的物质的量浓度为 。 19.(10分)Cl2O又称为次氯酸酐,是强氧化剂,易溶于水且与水反应,受热时容易燃烧、高浓度时容易爆炸。其熔沸点分别为-116℃和3.8℃;Cl2的沸点是-34.6℃。现利用HgO和Cl2以及以下装置制备Cl2O:回答下列问题:(1)仪器A的名称:___________。用酸性高锰酸钾制备Cl2应采用气体发生装置:___________(填“甲”或“乙”)(2)写出HgO和Cl2制备Cl2O的化学方程式:___________。(3)通入干燥空气的目的是___________。(4)实验装置⑤存在一些不足,请指出___________。(5)要想进一步分离得到Cl2O,采用的操作方法是:___________。20.(12分)元素铬(Cr)在自然界主要以+3价和+6价存在。(1)工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________;② “水浸Ⅰ”要获得“浸出液”的操作是___________。已知“浸出液”的主要成分为Na2CrO4,则Cr2O3在高温焙烧时反应的化学方程式为___________;③若向“滤液”中加入盐酸酸化的氯化钡溶液有白色沉淀生成,则操作Ⅱ发生反应的离子方程式为___________。(2)含有Cr2O的废水毒性较大,某工厂为了使废水的排放达标,进行如下处理:Cr2OCr3+、Fe3+Cr(OH)3、Fe(OH)3该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为___________;(3)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO+2H+Cr2O+H2O)。①阳极的电极反应式为___________;②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则生成重铬酸钠的物质的量为___________mol。(10分)298 K时,将20 mL 3mol·L−1 Na3AsO3、20 mL 3mol·L−1 I2和20 mL NaOH溶液混合,发生反应:(aq)+I2(aq)+2OH−(aq)(aq)+2I−(aq)+ H2O(l)。溶液中c()与反应时间(t)的关系如图所示。(1)下列可判断反应达到平衡的是__________(填标号)。a.溶液的pH不再变化b.v(I−)=2v()c.c()/c()不再变化d.c(I−)=2y mol·L−1(2)①tm时,v正_____ v逆(填“大于”“小于”或“等于”),理由是______________②tm时v逆______tn时v逆(填“大于”“小于”或“等于”),理由是__________(3)若平衡时[OH-]=1mol·L-1,则该反应的平衡常数K为___________。(用y表示) 高三期中考试化学参考答案1--5 DBBCC 6-10 BDBDC11-15 CDCCC 16 A17 【共12分】(1)吸热;(1分)(2分)①>; <;< ②>(各1分,共4分)(2)c; b;d(各1分,共3分)(3)(2分)18 【共8分】(1)Fe3O4 (1分) 第三周期ⅢA族;(1分) (2)AlH3+3H2O=Al(OH)3↓+3H2↑(2分)(3)粉末减少,有气体产生,该气体遇空气变红棕色,且溶液由无色变为棕黄色(2分)(4)0.036 mol.L-1(2分)19.【共10分】(1)分液漏斗(1分) 甲 (1分) (2) HgO+2Cl2= HgCl2+Cl2O (2分) (3)稀释高浓度的Cl2O,防止爆炸(2分)(4) ⑤后应该加一个装有无水氯化钙(能吸收水蒸气)的干燥管 (2分) (5)蒸馏 (2分)20.【共12分】(1)① 将铬铁矿粉碎(或其他合理措施) (1分) ② 过滤 (1分) 2Cr2O3+4Na2CO3+3O24Na2CrO4+4CO2 (2分) ③ 8CrO+3S2-+20H2O=8Cr(OH)3↓+3SO+16OH-(2分)(2) Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O(2分)(3) ① 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O) (2分) ② (2分)21.【共10分】(1)acd (2分)(2)①大于 (1分) tm时,反应正在向右进行,(v正逐渐减小,v逆逐渐增大,达平衡时二者相等 )此时v正大于v逆 (2分)②小于 (1分) tm时生成物离子浓度小于tn时生成物离子浓度,故tm时的v逆小于tn时的v逆(2分)(3)4y3/(1-y)2 mol-1.L(2分)
相关试卷
这是一份河南省南阳市2023-2024学年高三上学期11月期中考试化学试题及答案,共13页。
这是一份河南省洛阳市2021-2022学年高三上学期期中考试化学【试卷+答案】,共9页。
这是一份河南省南阳市2022-2023学年高三上学期1月期末化学答案,共3页。









