











所属成套资源:2024年高考化学一轮复习课件含练习及讲义(鲁科版2019)
第7章 第43讲 化学反应速率 工业合成氨
展开
这是一份第7章 第43讲 化学反应速率 工业合成氨,文件包含第7章第43讲化学反应速率工业合成氨pptx、第7章第43练化学反应速率工业合成氨docx、第7章第43讲化学反应速率工业合成氨docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第43讲
化学反应速率 工业合成氨
1.了解化学反应速率的概念和定量表示方法。2.了解反应活化能的概念。3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释 其一般规律。4.了解化学反应速率的调控在生活、生产和科学研究领域中的重要作用。
复习目标
内容索引
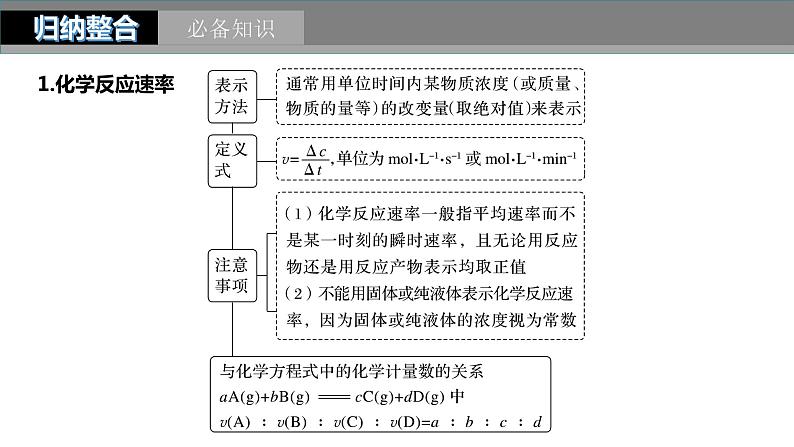
考点一 化学反应速率的概念及计算
考点二 影响化学反应速率的因素
考点三 工业合成氨
真题演练 明确考向
课时精练
化学反应速率的概念及计算
>
①>②>⑤>④
②v(CO)=2v(NO2)=1.4 mol·L-1·min-1;③v(CO)=4v(N2)=1.6 mol·L-1·min-1;④v(CO)=v(CO2)=1.1 mol·L-1·min-1;⑤v(CO)=2v(NO2)=0.02 mol·L-1·s-1=1.2 mol·L-1·min-1,故反应的快慢为③>①>②>⑤>④。
1.对于任何化学反应来说,反应速率越大,反应现象越明显( )2.由v= 计算平均反应速率,用反应物表示为正值,用生成物表示为负值( )3.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )4.同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快( )
×
×
×
×
1.一定温度下反应:4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是A.用A表示的反应速率是0.4 mol·L-1·min-1B.分别用B、C、D表示反应速率,其比值是1∶2∶3C.在2 min末的反应速率,用B表示为0.3 mol·L-1·min-1D.在这2 min内用B和C表示的瞬时速率的值都是逐渐减小的
一、化学反应速率的计算
关键能力
专项突破
√
A是固体,不能用其浓度的变化来表示反应速率;vB=0.3 mol·L-1·min-1,表示2 min内的平均反应速率,在2 min末的速率为瞬时速率;在反应过程中B的浓度逐渐减小,故A、B反应生成C、D的瞬时速率也逐渐减小。
2.一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g),反应过程如图。下列说法不正确的是A.t1 min时,正、逆反应速率相等B.X曲线表示NH3的物质的量随时间的变化关系C.0~8 min,H2的平均反应速率v(H2)=0.011 25 mol·L-1·min-1D.10~12 min,N2的平均反应速率v(N2)=0.002 5 mol·L-1·min-1
√
t1 min时,反应没有达到平衡状态,正、逆反应速率不相等,A项错误;根据图像可知,在0~8 min内,X增加了0.6 mol,Y减少了0.9 mol,X、Y变化的物质的量之比为2∶3,则X曲线表示NH3的物质的量随时间的变
化关系,Y曲线表示H2的物质的量随时间的变化关系,B项正确;
3.温度为T1时,2 g某合金4 min内吸收氢气240 mL,吸氢速率v=_____mL·g-1·min-1。
30
4.工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550 ℃时,在1 L的恒温容器中,反应过程中的部分数据见下表:
若在起始时总压为p0 kPa,反应速率若用单位时间内分压的变化表示,气态物质分压=总压×气态物质的物质的量分数,则10 min内SO2(g)的反应速率v(SO2)=____ kPa·min-1。
列出三段式 2SO2(g)+O2(g) 2SO3(g)初始/mol 4 2 0转化/mol 2 1 210 min时/mol 2 1 2
二、反应速率常数的应用
5.工业上利用CH4(混有CO和H2)与水蒸气在一定条件下制取H2,原理为CH4(g)+H2O(g) CO(g)+3H2(g),该反应的逆反应速率表达式为v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下测得实验数据如表所示:
由上述数据可得该温度下,c2=______,该反应的逆反应速率常数k=_________ L3·mol-3·min-1。
0.2
1.0×104
知识拓展
1.反应速率常数的含义反应速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。在相同浓度的条件下,可用反应速率常数大小来比较化学反应的反应速率。化学反应速率与反应物浓度(或浓度的次方)成正比,而反应速率常数是其比例常数,在恒温条件下,反应速率常数不随反应物浓度的变化而改变。因此,可以应用速率方程求出该温度下任意浓度时的反应速率。
知识拓展
2.速率方程一定温度下,化学反应速率与反应物浓度以其化学计量数为指数的幂的乘积成正比。对于反应:aA+bB===gG+hH则v=k·ca(A)·cb(B)(其中k为反应速率常数)。如:①SO2Cl2 SO2+Cl2 v=k1·c(SO2Cl2)②2NO2 2NO+O2 v=k2·c2(NO2)③2H2+2NO N2+2H2O v=k3·c2(H2)·c2(NO)
知识拓展
3.反应速率常数的影响因素温度对化学反应速率的影响是显著的,反应速率常数是温度的函数。同一反应,温度不同,反应速率常数将有不同的值,但浓度不影响反应速率常数。
返回
影响化学反应速率的因素
>
相关课件
这是一份第7章 第44讲 常考化学反应速率和化学平衡图像的分析,文件包含第7章第44讲常考化学反应速率和化学平衡图像的分析pptx、第7章第44练常考化学反应速率和化学平衡图像的分析docx、第7章第44讲常考化学反应速率和化学平衡图像的分析docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2024年高考化学一轮复习(新高考版) 第8章 第45讲 化学反应速率与反应历程,文件包含2024年高考化学一轮复习新高考版第8章第45讲化学反应速率与反应历程pptx、2024年高考化学一轮复习新高考版第8章第45讲化学反应速率与反应历程docx、第8章第45练化学反应速率与反应历程docx、第8章第45讲化学反应速率与反应历程docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2024年高考化学一轮复习(新高考版) 第7章 第43讲 多池、多室的电化学装置,文件包含2024年高考化学一轮复习新高考版第7章第43讲多池多室的电化学装置pptx、2024年高考化学一轮复习新高考版第7章第43讲多池多室的电化学装置docx、第7章第43讲多池多室的电化学装置docx、第7章第43练多池多室的电化学装置docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。









