





所属成套资源:2024年高考化学一轮复习课件含练习及讲义(鲁科版2019)
第7章 热点强化18 化学反应历程 反应机理的分析与应用
展开
这是一份第7章 热点强化18 化学反应历程 反应机理的分析与应用,文件包含第7章第43讲热点强化18化学反应历程反应机理的分析与应用pptx、第7章第43讲热点强化18化学反应历程反应机理的分析与应用docx等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
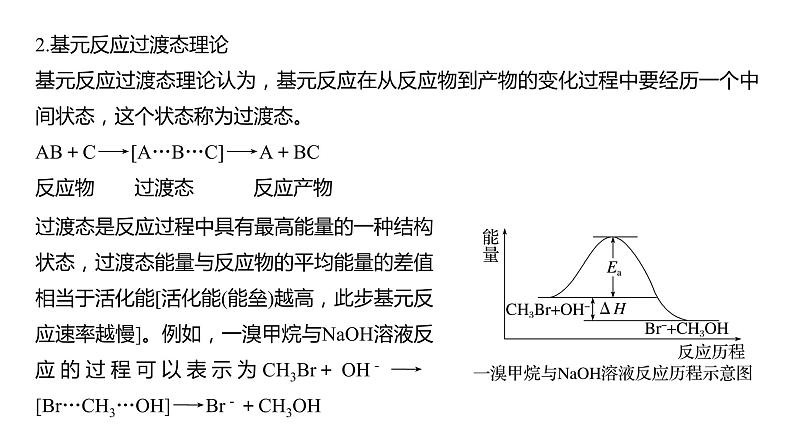
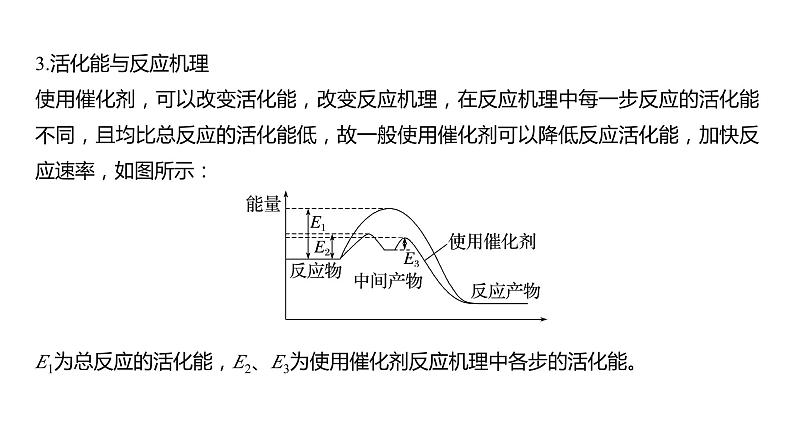
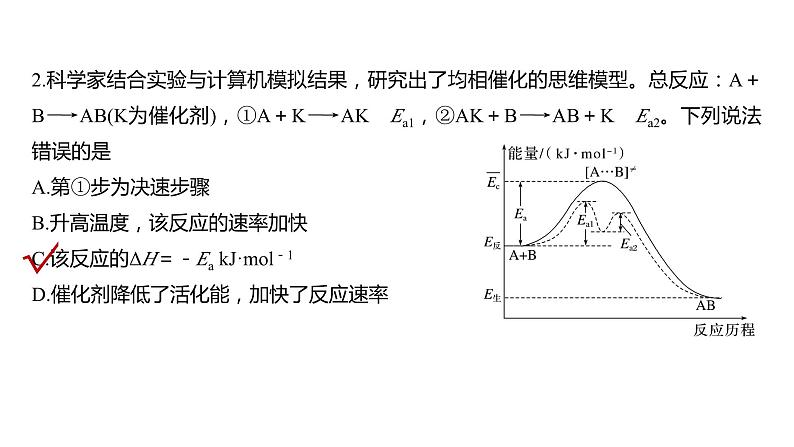
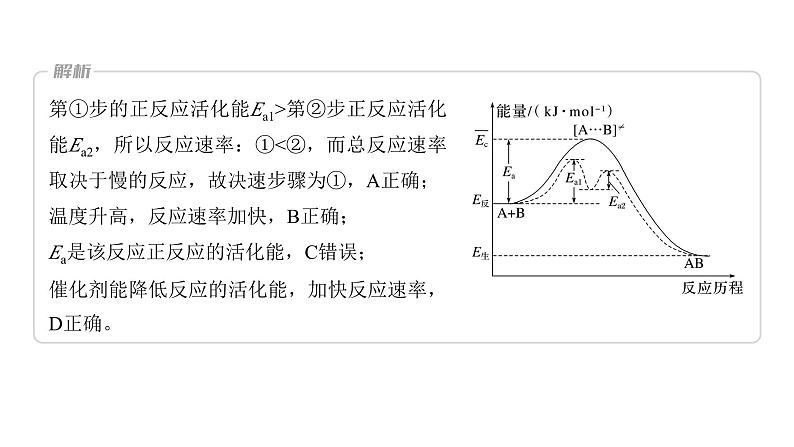
热点强化18 化学反应历程 反应机理的分析与应用1.大多数化学反应都是分几步完成的,其中的每一步反应称为基元反应。如反应:H2O2+2Br-+2H+===Br2+2H2O,通过大量实验提出它们微观过程如下:(1)H++H2O2H3O(2)H3O+Br-===H2O+HOBr(3)HOBr+H++Br-===H2O+Br22.基元反应过渡态理论基元反应过渡态理论认为,基元反应在从反应物到产物的变化过程中要经历一个中间状态,这个状态称为过渡态。AB+C―→[A…B…C]―→A+BC反应物 过渡态 反应产物过渡态是反应过程中具有最高能量的一种结构状态,过渡态能量与反应物的平均能量的差值相当于活化能[活化能(能垒)越高,此步基元反应速率越慢]。例如,一溴甲烷与NaOH溶液反应的过程可以表示为CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH3.活化能与反应机理使用催化剂,可以改变活化能,改变反应机理,在反应机理中每一步反应的活化能不同,且均比总反应的活化能低,故一般使用催化剂可以降低反应活化能,加快反应速率,如图所示:E1为总反应的活化能,E2、E3为使用催化剂反应机理中各步的活化能。1.对于反应2N2O5(g)―→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:第一步 N2O5NO2+NO3 快速平衡第二步 NO2+NO3―→NO+NO2+O2 慢反应第三步 NO+NO3―→2NO2 快反应其中可近似认为第二步反应不影响第一步反应的平衡。下列表述正确的是( )A.v(第一步的逆反应)<v(第二步反应)B.反应的中间产物只有NO3C.第二步中NO2与NO3的碰撞仅部分有效D.第三步反应活化能较高2.科学家结合实验与计算机模拟结果,研究出了均相催化的思维模型。总反应:A+B―→AB(K为催化剂),①A+K―→AK Ea1,②AK+B―→AB+K Ea2。下列说法错误的是( )A.第①步为决速步骤B.升高温度,该反应的速率加快C.该反应的ΔH=-Ea kJ·mol-1D.催化剂降低了活化能,加快了反应速率3.(2023·南昌模拟)二甲醚(CH3OCH3)被称为21世纪的“清洁能源”,科学家研究在酸性条件下,用甲醇可合成二甲醚,反应历程中相对能量变化如图所示。下列叙述错误的是( )A.循环过程中,催化剂参与了中间反应B.该历程中最小的能垒(基元反应活化能)为1.31 kJ·mol-1C.制约总反应速率关键步骤的基元反应方程式为―→CH3OCH3+H+D.总反应方程式为2CH3OHCH3OCH3+H2O4.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是( )A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C—H发生断裂C.①→②放出能量并形成了C—CD.该催化剂可有效提高反应物的平衡转化率5.(2022·哈尔滨质检)已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.0 kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g)ΔH=+313.2 kJ·mol-1过程Ⅱ:……下列说法不正确的是( )A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=+128.9 kJ·mol-1C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能D.铁氧化合物循环制H2具有成本低、产物易分离等优点6.(2021·湖南,14改编)铁的配合物离子(用[L-Fe-H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:下列说法错误的是( )A.该过程的总反应为HCOOHCO2↑+H2↑B.H+浓度过大或者过小,均导致反应速率降低C.该催化循环中Fe元素的化合价未发生变化D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定7.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-+CH3O-,能量变化如图所示。已知为快速平衡,下列说法正确的是( ).A.反应Ⅱ、Ⅲ为决速步B.反应结束后,溶液中存在18OH-C.反应结束后,溶液中存在CH318OHD.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变8.(2022·辽宁实验中学模拟)均相芬顿反应原理是高级氧化技术的经典工艺之一,如图所示(k1和k2为速率常数)。下列说法错误的是( )A.相同条件下,基元反应Ⅰ比Ⅱ的活化能低B.基元反应Ⅰ中氧元素的化合价没有发生变化C.基元反应Ⅱ的化学方程式为H2O2+Fe3+===HO2·+Fe2++H+D.芬顿反应进行的过程中,整个体系的pH会发生变化(忽略体积变化)9.如图是CH4与Zr形成过渡金属化合物的过程。下列说法正确的是( )A.加入合适的催化剂待反应完成时可增大过渡金属化合物的产率B.Zr+CH4―→CH3—Zr…H的活化能为99.20 kJ·mol-1C.整个反应的快慢由状态1前→CH3—Zr…H的反应快慢决定D.Zr+CH4―→CH—Zr…H3 ΔH=-39.54 kJ·mol-110.我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是( )A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*===(CH3)2NCH2+OH*B.该历程中最大能垒(活化能)为2.16 eVC.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)===N(CH3)3(g)+H2O(g) ΔH=-1.02 eV·mol-1D.增大压强或升高温度均能加快反应速率,并增大DMF的平衡转化率11.[2019·全国卷Ⅰ,28(3)]我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=____eV,写出该步骤的化学方程式:______________________________________。
相关课件
这是一份适用于新高考新教材2024版高考化学二轮复习热点提速练5反应机理及其分析课件,共22页。PPT课件主要包含了答案B等内容,欢迎下载使用。
这是一份2024届高三化学高考备考一轮复习:化学反应速率与反应历程(机理)课件,共47页。PPT课件主要包含了a∶b∶c∶d,③①②⑤④,合适的取向,活化分子,反应物分子等内容,欢迎下载使用。
这是一份新高考化学一轮复习课件 第7章 第40讲 热点强化12 化学反应历程、机理的分析应用---2023年高考化学一轮复习(新高考),共23页。PPT课件主要包含了高考化学一轮复习策略等内容,欢迎下载使用。









