



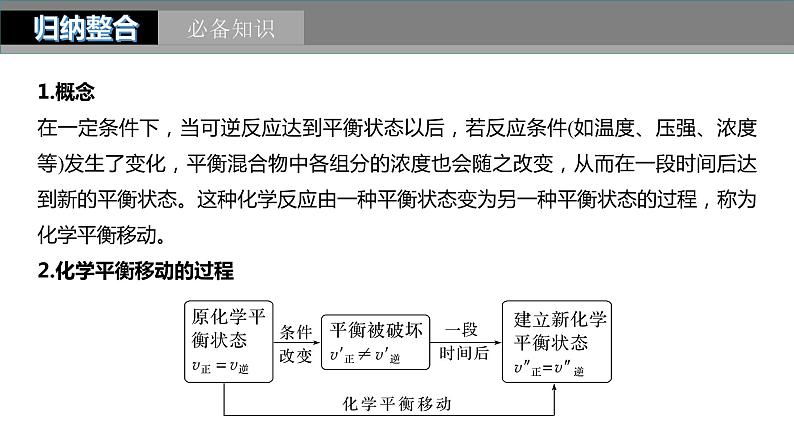








第7章 第42讲 反应条件对化学平衡移动的影响
展开1.下列事实不能用勒·夏特列原理解释的是( )
A.溴水中有下列平衡:Br2+H2OHBr+HBrO,当加入少量AgNO3溶液后,溶液的颜色变浅
B.对于反应:2HI(g)H2(g)+I2(g),缩小容器的容积可使平衡体系的颜色变深
C.反应:CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
D.对于合成NH3的反应,为提高NH3的产率,理论上应采取低温措施
2.反应NH4HS(s)NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况不会使平衡发生移动的是( )
A.温度、容积不变时,通入SO2气体
B.移走一部分NH4HS固体
C.容器体积不变,充入HCl气体
D.保持压强不变,充入氮气
3.一定量混合气体在一体积可变的密闭容器中发生反应:xA(g)+yB(g)zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1。在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是( )
A.平衡向正反应方向移动
B.x+y<z
C.C的体积分数降低
D.B的转化率升高
4.化学反应Ⅰ、Ⅱ、Ⅲ在不同温度时达到平衡,其平衡常数如下表:
编号 | 化学方程式 | 温度 | |
979 K | 1 173 K | ||
Ⅰ | Fe(s)+CO2(g)FeO(s)+CO(g) | 1.47 | 2.15 |
Ⅱ | CO(g)+H2O(g)CO2(g)+H2(g) | 1.62 | b |
Ⅲ | Fe(s)+H2O(g)FeO(s)+H2(g) | a | 1.68 |
根据以上信息判断,下列结论正确的是( )
A.将铁粉磨细可以使平衡Ⅰ向右移动
B.反应Ⅱ、Ⅲ均为放热反应
C.升高温度,反应Ⅲ平衡向正反应方向移动
D.a<b
5.某温度下,0.05 mol乙醇和氢溴酸的混合液共20 mL,发生反应:C2H5OH+HBrC2H5Br+H2O,30 min时测得生成溴乙烷的产量为0.015 mol(溶液体积变化忽略不计),下列说法正确的是( )
A.若将反应物乙醇的量加倍,平衡正移,乙醇的平衡转化率增大
B.加入适量水,有利于生成溴乙烷
C.第30 min时的反应速率:v(C2H5OH)=0.025 mol·L-1·min-1
D.若用NaBr(s)与浓硫酸替换氢溴酸,溴乙烷的产量可能会上升
6.在容积为2 L的密闭容器中,进行如下化学反应:2CuCl2(s)2CuCl(s)+Cl2(g),其化学平衡常数K和温度的关系如表:
T/℃ | 800 | 900 | 1 000 | 1 100 | 1 200 |
K/(mol·L-1) | 1.1 | 1.5 | 1.75 | 1.90 | 2.08 |
根据信息作出的下列判断正确的是( )
A.此反应为放热反应
B.此反应在1 050 ℃达平衡时,1.75 mol·L-1<K=<1.90 mol·L-1
C.1 000 ℃条件下容器容积由2 L变为1 L,平衡逆向移动,达平衡时Cl2的浓度保持不变
D.降温和加入CuCl固体都能使平衡发生移动
7.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是( )
A.Q1=Q2=Q3=197 kJ
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数相等
D.若在上述条件下反应生成2 mol SO3(s)的反应热为ΔH1,则ΔH1>-197 kJ·mol-1
8.如图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)2Z(g)+W(g) ΔH>0;达到平衡时,VA=1.2a L,则下列说法不正确的是( )
A.反应开始时,B容器中化学反应速率快
B.A容器比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为2.4a L(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积会增大
9.研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化的方法,其过程中主要发生下列反应:
反应Ⅰ CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1
反应Ⅱ 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
反应Ⅲ CO2(g)+H2(g)CO(g)+H2O(g) ΔH3=+41.2 kJ·mol-1
(1)写出CO2与H2一步合成二甲醚(反应Ⅳ)的热化学方程式:__________________________。
(2)有利于提高反应Ⅳ平衡转化率的条件是________(填字母)。
A.高温高压 B.低温低压
C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1∶3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。CH3OCH3的选择性=×100%。
①温度低于300 ℃,CO2平衡转化率随温度升高而下降的原因是_______________________。
②关于合成二甲醚工艺的理解,下列说法正确的是________(填字母)。
A.反应Ⅳ在A点和B点时的化学平衡常数:K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
10.甲烷和水蒸气催化制氢主要有如下两个反应:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1
恒定压强为100 kPa时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如下图所示。
回答下列问题:
(1)写出CH4与CO2生成H2和CO的热化学方程式:_______________________________。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是________(填字母)。
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,降低反应温度也能实现单位时间转化率不变
(3)系统中H2的含量在700 ℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于700 ℃,______________________________________________________________;
②高于700 ℃,_____________________________________________________________。
(4)已知投料比为n(CH4)∶n(H2O)=1∶3的混合气体,p=100 kPa。600 ℃时,CH4的平衡转化率为________(保留4位有效数字),反应①的平衡常数的计算式为Kp=_____________(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
高中化学鲁科版 (2019)选择性必修1第2节 化学反应的限度课文课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第2节 化学反应的限度课文课件ppt,共44页。PPT课件主要包含了任务分项突破,课堂小结提升,学科素养测评,自主梳理,一种平衡状态,另一种平衡状态,正反应,逆反应,互动探究,归纳拓展等内容,欢迎下载使用。
苏教版高考化学一轮复习7化学反应速率与化学平衡第22讲化学平衡的移动课件: 这是一份苏教版高考化学一轮复习7化学反应速率与化学平衡第22讲化学平衡的移动课件,共60页。PPT课件主要包含了相同条件,考点2化学平衡移动,不发生,正反应,逆反应,p′乙=2p乙,p′丙=2p丙,答案甲乙=丙丁,等效平衡的应用,答案07a等内容,欢迎下载使用。
第19讲 化学平衡状态 化学平衡移动: 这是一份第19讲 化学平衡状态 化学平衡移动,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,图像分析,3化学平衡特征,特别提醒,2“两标志”,①③④⑦,①③④⑤⑦等内容,欢迎下载使用。












