



所属成套资源:2024年高考化学一轮复习课件含练习及讲义(鲁科版2019)
第7章 热点强化19 化学反应速率和化学平衡简答题课件PPT
展开
这是一份第7章 热点强化19 化学反应速率和化学平衡简答题课件PPT,共36页。PPT课件主要包含了热点精讲,热点专练,Kb>Kc>Kd,T3~T4,p1>p2>p3,思维模型,铝的表面有一层致密的,反应速率加快,度逐渐降低,升高乙烯转化率升高等内容,欢迎下载使用。
文字描述代表一种开放性思维与能力,一般从速率问题、平衡(转化率)问题、安全问题、节能减排等角度作答(考查前两个角度居多),实际上就是效益最大化的问题。1.条件选择类(1)实验最佳条件的选择或控制就是为了又“快”又“好”地生产,即主要是从反应速率与转化率(化学平衡)两个角度来分析。“快”就是提高反应速率,“好”就是提高转化率,原料利用率高,而影响速率与转化率的主要因素就是浓度、温度、压强与催化剂,其中温度与压强是试题中经常考查的因素。
(2)从速率、转化率、产率、纯度等角度分析,选择最佳条件。如针对反应速率时,思考方向为如何提高浸出速率、如何提高反应速率等;针对平衡转化率、产率时,可运用平衡移动原理解释(其他条件不变的情况下,改变××条件,可逆反应平衡向××方向移动,导致××发生变化);针对综合生产效益时,可从原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护,绿色化学等方面作答。(3)选择当前条件的优势,其他条件的不足,往往不足的描述比较容易疏忽,如温度过高或过低,压强过小或过大,也要进行分析。
2.原因分析类(1)依据化学反应速率和平衡移动原理,分析造成图像曲线变化的原因。(2)催化剂对反应的影响、不同反应的选择性问题是这类题目的难点,解题时要多加关注,不同的条件会有不同的选择性。(3)这类题目一般都是多因素影响,需要多角度分析原因。
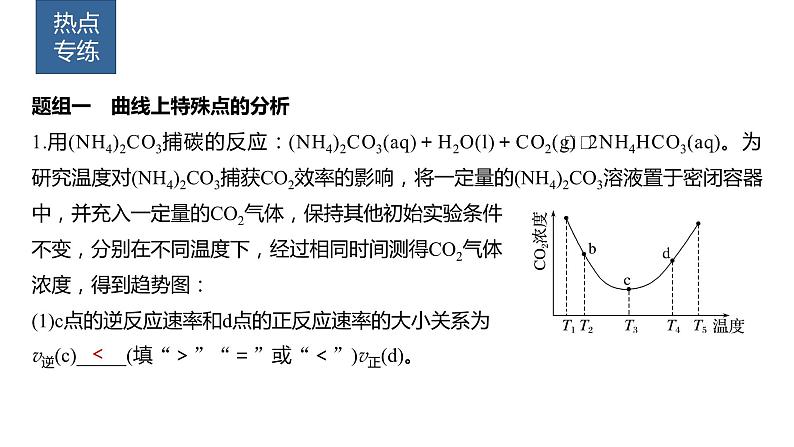
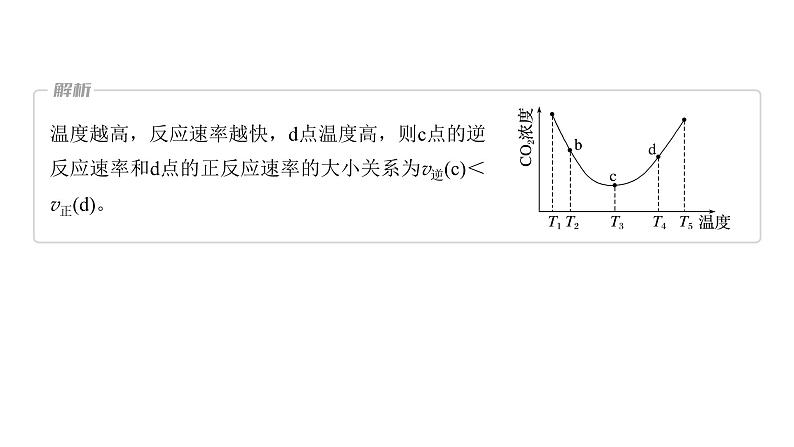
题组一 曲线上特殊点的分析1.用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:(1)c点的逆反应速率和d点的正反应速率的大小关系为v逆(c)_____(填“>”“=”或“<”)v正(d)。
温度越高,反应速率越快,d点温度高,则c点的逆反应速率和d点的正反应速率的大小关系为v逆(c)<v正(d)。
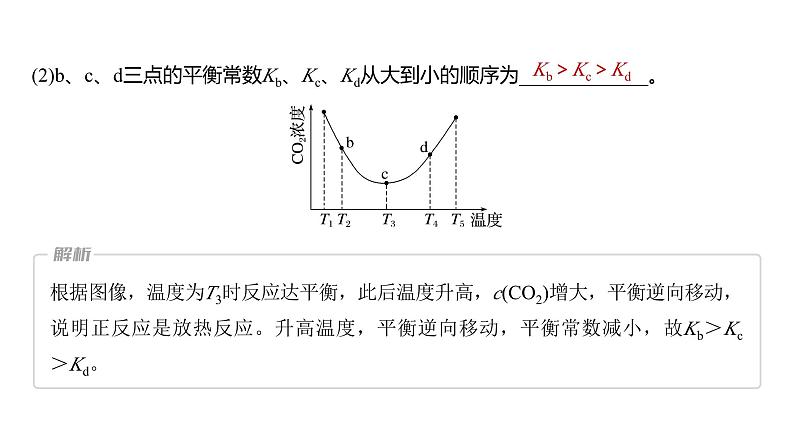
(2)b、c、d三点的平衡常数Kb、Kc、Kd从大到小的顺序为_____________。
根据图像,温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明正反应是放热反应。升高温度,平衡逆向移动,平衡常数减小,故Kb>Kc>Kd。
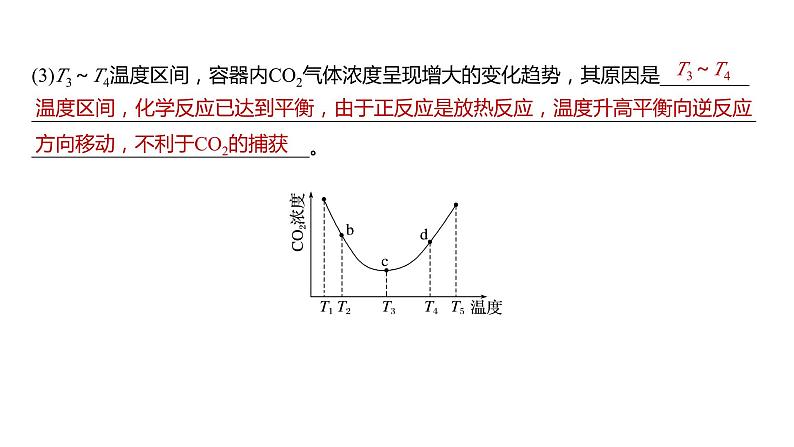
(3)T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是______________________________________________________________________________________________________________。
温度区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,不利于CO2的捕获
2.[2020·天津,16(4)]用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应):CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔHv逆;M点为刚达到平衡点(如图);M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点(如图)。L线的左上方(如E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以,E点:v正>v逆;则L线的右下方(如F点):v正<v逆。
4.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 ml·L-1盐酸的烧杯中,该铝片与盐酸反应生成氢气的速率v与反应时间t可用如图的坐标曲线来表示。
回答下列问题:(1)O→a段不生成氢气的原因是_____________________________________________________________________。
Al2O3薄膜,能与H+反应得到盐和水,无氢气放出
(2)b→c段生成氢气的速率增加较快的主要原因可能是________________________________________。(3)t>c时生成氢气的速率降低的主要原因是______________________________________________。
反应放热,溶液温度升高,
随着反应的进行,溶液中氢离子的浓
题组二 曲线变化趋势的分析
5.乙烯气相水合反应的热化学方程式为C2H4(g)+H2O(g) C2H5OH(g) ΔH=-45.5 kJ·ml-1,如图是乙烯气相水合法制乙醇中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。图中压强(p1、p2、p3、p4)的大小顺序为____________,理由是_________________________________________________________________________。
p4>p3>p2>p1
该反应正向是气体分子数减小的反应,相同温度下,压强
6.汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如图所示。(1)在 =1条件下,最佳温度应控制在______________________________左右。(2)若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________________________________________。
870 K(860~880 K范围内都可以)
升高温度,反应向逆反应方向进行
(3)用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大:____________________________________________________________________________________________________。
加入的CO会与NO的分解产物O2发生反应,促进NO分解平衡向生成N2的方向移动,导致NO的转化率增大
7.下图是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂为______,相应温度为________;使用Mn作催化剂时,脱氮率在b~a段呈现如图变化的可能原因是________________________________________________________________________________________________________________________________________________________________。
b~a段,开始温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡,随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐增大
8.汽车尾气是雾霾形成的原因之一,研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH
相关课件
这是一份第51讲 化学反应速率和化学平衡简答题-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共40页。PPT课件主要包含了高考化学一轮复习策略等内容,欢迎下载使用。
这是一份第7章 热点强化18 化学反应历程 反应机理的分析与应用,文件包含第7章第43讲热点强化18化学反应历程反应机理的分析与应用pptx、第7章第43讲热点强化18化学反应历程反应机理的分析与应用docx等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
这是一份第7章 热点强化17 化学平衡常数与速率常数的关系,文件包含第7章第43讲热点强化17化学平衡常数与速率常数的关系pptx、第7章第43讲热点强化17化学平衡常数与速率常数的关系docx等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。








