






- 浙江专版2023_2024学年新教材高中化学第1章化学反应的热效应第1节反应热第2课时热化学方程式燃烧热课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第1章化学反应的热效应第2节反应热的计算课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第2章化学反应速率与化学平衡第1节化学反应速率第1课时化学反应速率及影响因素课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第2章化学反应速率与化学平衡第1节化学反应速率第2课时活化能课件新人教版选择性必修1 课件 0 次下载
- 浙江专版2023_2024学年新教材高中化学第2章化学反应速率与化学平衡第2节化学平衡第1课时化学平衡状态化学平衡常数课件新人教版选择性必修1 课件 0 次下载
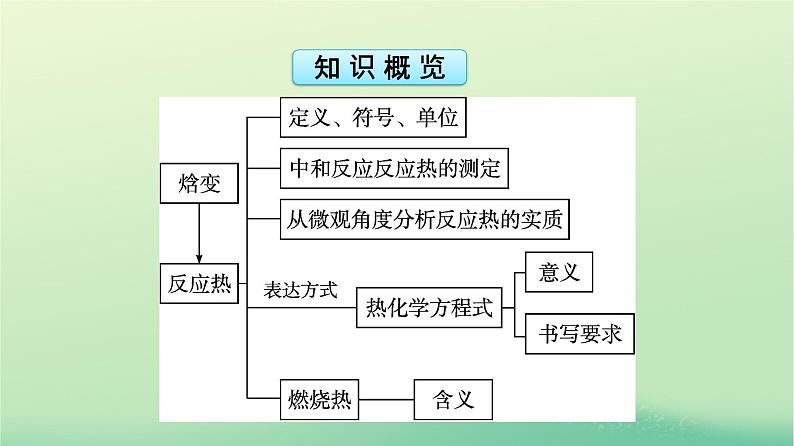
化学选择性必修1第一章 化学反应的热效应第一节 反应热教课内容ppt课件
展开1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。2.了解反应热的概念,通过教材中的“中和反应反应热的测定”实验,掌握反应热的测定方法。3.了解反应热与焓变的关系,能从微观角度认识化学反应中能量变化的主要原因,能进行ΔH的简单计算。
4.认识热化学方程式的意义并能用热化学方程式表示反应中的能量变化,能利用反应焓变合理选择和利用化学反应。5.理解燃烧热的定义,掌握表示物质燃烧热的热化学方程式的书写。
一、反应热与焓变1.体系与环境。体系——容器内的反应物及发生的反应等可看作一个反应体系,又称系统。环境——与体系相互影响的其他部分。热量是指因温度不同而在 体系 与 环境 之间交换或传递的能量。
微解读 反应体系通常有敞开体系(体系与环境有物质交换,也有能量交换。如敞口试管中锌粒与稀硫酸反应)、封闭体系(体系与环境没有物质交换,但有能量交换。如恒温下密闭容器中进行的反应)、孤立体系(体系与环境既没有物质交换,也没有能量交换。如绝热密闭容器中进行的反应)。
2.反应热。(1)定义:在等温条件下,化学反应体系向环境 释放 或从环境 吸收 的热量称为反应热。 (2)产生反应热的原因:化学反应前后体系的 内能 (体系内物质的各种能量的总和)发生了变化;实质是 化学键断裂和形成时的能量变化 。 (3)测量:许多反应热可通过 量热计 直接测定。例如:大量实验测得,在25 ℃和101 kPa下,强酸和强碱的稀溶液发生反应生成1 ml H2O时放出 57.3 kJ的热量。
3.焓变。(1)焓——与内能有关的物理量,符号: H 。 (2)焓变——化学反应体系中生成物与反应物的焓值差,符号: ΔH ,常用单位: kJ·ml-1 。在等压条件下进行的化学反应,其反应热等于 焓变 。
微判断(1)化学反应的反应热一定是化学反应的焓变。( )(2)形成1 ml H—Cl放出能量,该过程中伴随的能量变化属于反应热。( )(3)石墨转变成金刚石吸收能量,该过程中伴随的能量变化属于反应热。( )(4)水蒸气变成液态水放出能量,该过程中伴随的能量变化属于反应热。( )(5)任何反应的反应热都可通过实验直接测定。( )(6)焓是一个物理量,与内能有关。( )
二、吸热反应与放热反应1.图示。
2.结论。当反应体系放热时其焓 减小 ,ΔH < 0;当反应体系吸热时其焓 增大 ,ΔH > 0。
3.常见的放热反应、吸热反应。
微训练 1.下列说法正确的是( )。A.化学反应过程中的能量变化就是热能的变化B.放热反应在常温下一定很容易发生C.反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断D.吸热反应在常温下一定不能发生答案:C
解析:A项,化学反应过程中的能量变化除了热能外,也可以是光能和电能;B项,放热反应在常温下不一定容易发生,如C(s)与O2(g)在点燃条件下才能发生;D项,吸热反应在常温下也能发生,如Ba(OH)2·8H2O晶体与NH4Cl的反应。
2.在一定条件下A与B反应可生成C和D,其能量变化如下图:
若E1>E2,反应体系的总能量 (填“升高”或“降低”),为 (填“吸热”或“放热”)反应,其原因是 。解析:对于放热反应,反应物总能量大于生成物总能量,反应过程中部分热能释放到环境中,使反应体系总能量降低。
反应物的部分内能通过化学反应转化为热能释放到环境中
一、中和反应反应热的测定重难归纳1.实验原理。通过一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得中和反应的反应热。
4.数据处理。其中(m1+m2)表示溶液质量,单位为g,c为比热容,c=4.18 J·(g·℃)-1。
1.装置中的玻璃搅拌器能否用铜制环形搅拌器代替?为什么?提示:不能。原因是铜制环形搅拌器易导热,造成实验过程中热量损失。
2.教材中在探究“中和反应反应热的测定”时,若用浓硫酸代替盐酸,用醋酸代替盐酸或用氨水代替KOH溶液,对结果分别会产生什么影响?提示:浓硫酸溶解于水时放热,使所测ΔH偏小,即ΔH<-57.3 kJ·ml-1;弱酸、弱碱电离时要吸热,使所测ΔH偏大,即ΔH> -57.3 kJ·ml-1。
典例剖析某学生为测定中和反应的反应热,取用50 mL 0.50 ml·L-1的盐酸和50 mL 0.55 ml·L-1的NaOH溶液(密度都是1 g·cm-3)。实验中测得的数据如下表所示:
(1)反应后溶液的比热容为4.18 J·(g·℃)-1。请利用该学生测得的数据计算生成1 ml H2O时的反应热:ΔH= 。 (2)该学生测得反应热的数值比57.3 kJ·ml-1 (填“高”或“低”)。
(3)从下列因素中选出该学生产生实验误差的可能原因 。A.溶液混合后未及时盖好量热计杯盖B.倾倒溶液太快,有少量溶液溅出C.溶液混合后搅拌不够D.未等温度升到最高值就记录温度计示数E.用量筒量取盐酸体积时仰视读数答案:(1)-52.25 kJ·ml-1 (2)低 (3)ABCD
解析:根据实验数据可知,实验3中的数据是异常的,应舍去。所以温度差的平均值是3.125 ℃,ΔH=- kJ·ml-1= kJ·ml-1=-52.25 kJ·ml-1,该学生测得反应热的数值比57.3 kJ·ml-1低。数值偏低,说明实验过程中有热量损失或者是酸、碱有损失。E中实际量取盐酸的体积大于50 mL,结果应该是偏高,所以正确的答案为ABCD。
学以致用1.为了测定酸碱中和反应的反应热,计算时至少需要的数据是( )。①酸溶液的浓度和体积 ②碱溶液的浓度和体积③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度的变化 ⑦操作所需的时间A.①②⑥⑦B.①③④⑤C.③④⑤⑥D.①②③④⑤⑥⑦答案:C
解析:根据计算公式 ×10-3 kJ·ml-1可知, C项正确。
2.(2022广东广州高二期末)某小组用25.00 mL 0.50 ml·L-1 NaOH溶液和25.00 mL 0.50 ml·L-1H2SO4溶液进行反应热的测定,实验测得生成1 ml水的ΔH=-53.5 kJ·ml-1。该值与理论值产生偏差的原因不可能是( )。A.实验装置保温、隔热效果差B.量取NaOH溶液的体积时仰视读数C.分多次把NaOH溶液倒入盛有H2SO4溶液的量热计内筒中D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
解析:由题给信息可知,实验测得的生成1 ml水放出的热量偏小。装置保温、隔热效果差,测得放出的热量偏小,A项不符合题意;量取NaOH溶液的体积时仰视读数,则量取的NaOH溶液偏多,实验放出的热量偏大,B项符合题意;分多次把NaOH溶液倒入盛有H2SO4溶液的小烧杯中,热量散失较多,测得温度偏低,则测得生成1 ml水放出的热量偏小,C项不符合题意;用温度计测定NaOH溶液起始温度后直接插入H2SO4溶液中测温度,H2SO4溶液的起始温度偏高,测得放出的热量偏小,则测得生成1 ml水放出的热量偏小,D项不符合题意。
二、化学反应中能量变化的原因与ΔH的计算重难归纳1.微观角度认识。
ΔH=反应物断键吸收的能量总和-生成物成键放出的能量总和。
2.宏观角度认识。一个化学反应是吸收能量还是放出能量,由反应物的总焓(∑H反)与生成物的总焓(∑H生)的相对大小来决定。若∑H反>∑H生,则会放出能量;若∑H反<∑H生,则需要吸收能量,如下图所示。
怎样从微观和宏观两个角度理解H2(g)+Cl2(g)══2HCl(g)的反应热ΔH=-183 kJ·ml-1中的“183 kJ”?提示:从微观上看,断裂1 ml H—H和1 ml Cl—Cl所吸收的能量比形成2 ml H—Cl释放的能量少183 kJ。从宏观上看 1 ml H2(g)和1 ml Cl2(g)所具有的总能量比2 ml HCl(g)所具有的总能量多183 kJ。
典例剖析已知化学反应A2(g)+B2(g)══2AB(g)中焓的变化示意图如图所示。
(1)下列说法正确的是( )。A.化学反应A2(g)+B2(g)══2AB(g)是吸热反应B.断裂1 ml A2和 1 ml B2中的化学键可放出x kJ能量C.形成2 ml AB中的化学键需要释放y kJ能量D.2 ml AB的总焓高于1 ml A2和1 ml B2的总焓答案:C
解析:根据图示,1 ml A2和1 ml B2的总焓高于2 ml AB的总焓,所以反应A2+B2══2AB是放热反应,选项A和选项D都错误;断裂1 ml A2和1 ml B2中的化学键需吸收x kJ能量,形成2 ml AB中的化学键需要释放y kJ能量,选项B错误,选项C正确。
(2)2AB(g)══A2(g)+B2(g)的ΔH为 。 答案:-(x-y) kJ·ml-1
学以致用1.(2022湖南常德一中月考)关于如图的说法不正确的是( )。A.1 ml固态碘与1 ml H2化合生成2 ml HI气体时,需要吸收5 kJ的能量B.2 ml HI气体分解生成1 ml碘蒸气和1 ml H2时需要吸收12 kJ的能量C.1 ml固态碘变为1 ml碘蒸气时需要吸收17 kJ的能量D.碘蒸气与H2生成HI气体的反应是吸热反应答案:D
解析:由图可知,1 ml I2(s)+1 ml H2(g)吸收5 kJ能量生成2 ml HI(g),A项正确;1 ml I2(g)+1 ml H2(g)放出12 kJ能量生成2 ml HI(g),则2 ml HI气体分解生成1 ml碘蒸气和1 ml H2时需要吸收12 kJ的能量,B项正确;1 ml I2(g)变为1 ml I2(s)放出17 kJ的能量,则1 ml固态碘变为1 ml碘蒸气时需要吸收17 kJ的能量,C项正确;1 ml I2(g)+1 ml H2(g)放出12 kJ能量生成2 ml HI(g),应为放热反应,D项错误。
2.键能是指气态分子中1 ml化学键解离成气态原子所吸收的能量。已知下列化学键的键能:
则反应N2(g)+3H2(g) 2NH3(g)的ΔH= 。 答案:-92 kJ·ml-1解析:ΔH=反应物断键吸收的总能量-生成物成键释放的总能量=946 kJ·ml-1+3×436 kJ·ml-1-6×391 kJ·ml-1=(2 254 kJ·ml-1-2 346 kJ·ml-1)=-92 kJ·ml-1。
1.下列变化一定为放热的化学反应的是( )。A.H2O(g)══H2O(l)放出44 kJ热量B.ΔH>0的化学反应C.形成化学键时共放出能量862 kJ的化学反应D.能量变化如下图所示的化学反应答案:D
解析:化学反应放热还是吸热,取决于H(生成物)与H(反应物)的相对大小。若H(生成物)>H(反应物),则反应吸热,反之放热。A项,H2O(g)══H2O(l)为物理变化;B项,ΔH>0,即H(生成物)>H(反应物),反应吸收热量;C项,无法确定反应放热还是吸热;D项,由图可知H(生成物)
解析:体系与环境不进行能量传递时,反应放出的热量留在体系中,体系的温度会升高,用量热计测定中和反应的反应热时就是利用了这一原理,A项正确。反应放热时,能量从体系传递给环境,体系内能减小,B项错误。体系焓的变化取决于反应物和生成物的总焓的相对大小,与反应条件无关,C项错误。当反应物的总焓小于生成物的总焓时,体系的焓增加,其ΔH为正值,D项错误。
3.已知弱酸电离时吸收能量。在中和反应反应热的测定实验中,下列说法正确的是( )。A.使用玻璃搅拌器匀速搅拌是为了使酸与碱充分反应,提高测定结果的准确度B.为了准确测定反应混合溶液的温度,实验中要用温度计搅拌混合溶液C.若用0.5 ml·L-1 NaOH溶液分别与0.5 ml·L-1的盐酸、醋酸反应,当所取的溶液体积相等时,测得的反应热数值相同
D.在中和反应反应热的测定实验中只测量一次就能准确得到实验结果答案:A解析:温度计不能用来搅拌溶液,易破损,B项错误;CH3COOH电离时吸热,测得的反应热数值偏小,C项错误;实验中一般测量3次,若有异常数据,舍弃后再取平均值作为计算依据,以提高准确度,D项错误。
4.已知在25 ℃和101 kPa下,反应H2(g)+Br2(l)══2HBr(g)的ΔH=-72 kJ·ml-1,蒸发1 ml Br2(l)需要吸收30 kJ的能量,其他相关数据如下表:
则表中a为( )。A.404B.260C.230D.200答案:D
解析:化学反应中,断裂反应物的化学键吸收能量,形成生成物的化学键释放能量,吸收的能量与释放的能量之差即反应热,所以ΔH=(436+30+a-369×2) kJ·ml-1=-72 kJ·ml-1,解得a=200。
5.用“>”“<”或“=”填空:(1)相同状况下,2 ml H所具有的焓 1 ml H2所具有的焓。 (2)反应H2(g)+Cl2(g)══2HCl(g),同温同压下,在光照和点燃条件下均生成1 ml HCl(g)时的反应热分别为ΔH1、ΔH2,则ΔH1 ΔH2。 (3)相同状况下,含有等物质的量磷原子的红磷比白磷的焓低,则红磷和白磷在氧气中充分燃烧,均生成1 ml P2O5时放出的热量:红磷 白磷。
答案:(1)> (2)= (3)<
高中化学第一节 反应热教课ppt课件: 这是一份高中化学第一节 反应热教课ppt课件,共52页。PPT课件主要包含了第一节反应热,新课情景呈现,课前素能奠基,物质的量,燃烧热,课堂素能探究,名师博客呈现,课堂达标验收,HOOH等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算课文配套ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算课文配套ppt课件,共59页。PPT课件主要包含了课前·基础认知,课堂·重难突破,素养·目标定位,随堂训练,素养•目标定位,目标素养,知识概览,答案C等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热评课课件ppt: 这是一份人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热评课课件ppt,共41页。PPT课件主要包含了目录索引,探究二反应热与焓变等内容,欢迎下载使用。













