





还剩22页未读,
继续阅读
所属成套资源:新人教版化学必修第一册PPT课件整册
成套系列资料,整套一键下载
第一章综合评价 高一化学人教版(2019)必修第一册课件PPT
展开
这是一份第一章综合评价 高一化学人教版(2019)必修第一册课件PPT,共30页。
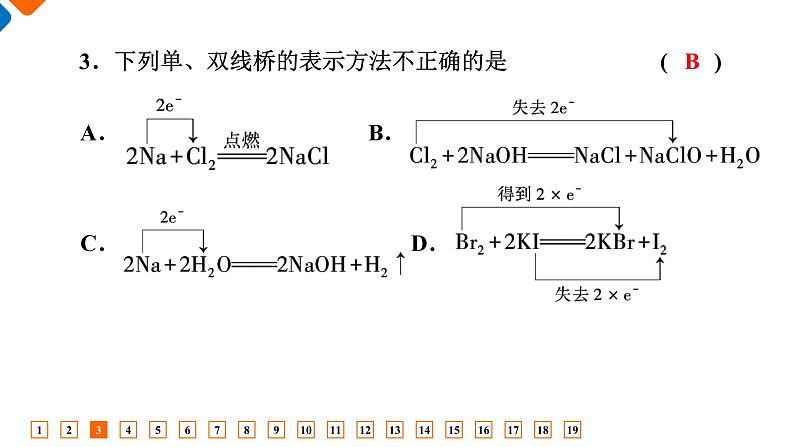
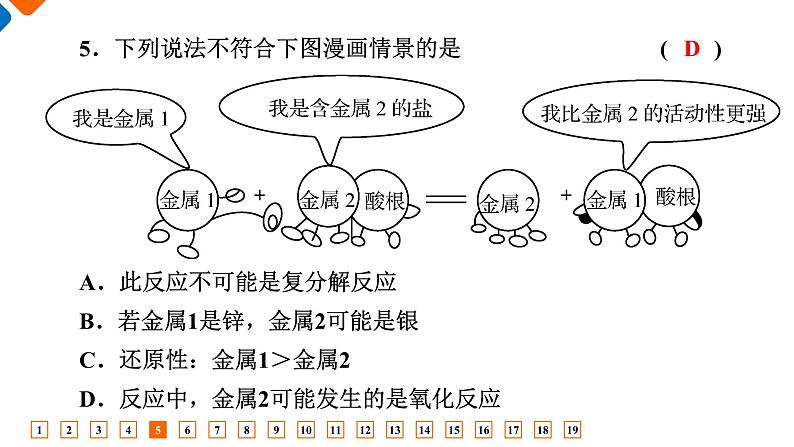
第一章综合评价时间:75分钟 满分:100分一、 单项选择题(本题共14小题,每小题3分,共42分)1.我们生活在千变万化的物质世界里。下列过程或变化中,没有发生氧化还原反应的是 ( )A.木炭燃烧 B.胶体发生丁达尔效应C.爆竹爆炸 D.电解水1B 2.下列对有关物质的分类不正确的是 ( )2D 3.下列单、双线桥的表示方法不正确的是 ( )3B 4A 55.下列说法不符合下图漫画情景的是 ( ) A.此反应不可能是复分解反应B.若金属1是锌,金属2可能是银C.还原性:金属1>金属2D.反应中,金属2可能发生的是氧化反应D 6B 7.下列离子方程式书写正确的是 ( )A.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2OC.铜和硝酸银溶液反应:Cu+Ag+===Cu2++AgD.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-=== Mg(OH)2↓7B 8.下图几种反应类型之间的集合关系正确的是 ( )8B 9.欲配制下列含有四种不同阴、阳离子的溶液,其中能配制成功的是 ( )9B 10.已知反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,据此判断,下列说法正确的是 ( )A.该反应的生成物都属于电解质B.该反应表明Cl2的氧化性比KClO3强C.HCl部分发生氧化反应D.每生成3个Cl2分子,KClO3在反应中得到6个 e-10C 11.离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是 ( )①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOHA.①③ B.①④⑤C.②④⑤ D.①⑤11C 12.为确定某溶液中的离子组成,进行如下实验:①取少量溶液加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色、无味气体;②向①溶液中再滴加BaCl2溶液,产生白色沉淀;③取②上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验现象,下列推断正确的是 ( )12C 13.甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含离子如下表所示: 下列说法正确的是 ( )A.甲可能是NaOH B.甲可能是Na2SO4C.甲、乙、丙两两混合都会有白色沉淀生成D.可用酚酞鉴别三种溶液13C A.Na2CO3+2HCl===2NaCl+CO2 ↑+H2OB.K2CO3+2HNO3===2KNO3+CO2↑+H2OC.K2CO3+H2SO4===K2SO4+CO2 ↑+H2O D.CaCO3+2HCl===CaCl2+CO2 ↑+H2O14D 二、 非选择题(本题共5小题,共58分)15.(10分)无机化合物可根据其组成和性质进行分类。 (1)上图所示的物质分类方法名称是______________。15树状分类法 15(2)以Na、K、H、O、C、S、N中任意两种或三种元素组成合适的物质,分别填在下表中。 H2SO4(或HNO3) NaOH(或KOH) Na2SO4(或K2CO3或Na2SO3或NaNO3) 15(3)写出⑦转化为⑤的化学方程式:___________________________________。(4)写出实验室由⑩制备O2的化学方程式:______________________。(5)实验室制备⑦常用__________和____________________反应,检验该气体的方法是______________________________________________ ____________。2NaOH+CO2===Na2CO3+H2O 稀盐酸 大理石(或石灰石) 将气体通入澄清石灰水中,若变浑浊,即可证明该气体是CO2 16.(10分)氧化镁在医药、建筑等行业应用广泛。热解还原硫酸镁制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:16(1)“酸溶”时,MgCO3溶解的离子方程式为___________________ ______________________。MgCO3+2H+=== Mg2++H2O+CO2↑ 16(2)“氧化”反应的离子方程式如下,请用单线桥标出该反应中电子转移的方向和数目:2Fe2++2H++H2O2===2Fe3++2H2O【答案】16(3)加入氨水“调pH≈4”的目的是使Fe3+沉淀、Mg2+不沉淀,反应的离子方程式为_______________________________________。(4)“过滤Ⅱ”所得的滤液经“操作X”可得到MgSO4·7H2O,操作X为______________________、过滤、洗涤。蒸发浓缩、冷却结晶 1∶2 17既作氧化剂,又作还原剂 作氧化剂 作还原剂 既不作氧化剂,也不作还原剂 17(2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O。该反应中被氧化的物质是________,用单线桥在下面的化学方程式上标出电子转移的方向和数目:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O【答案】H2O2 17(3)将少量Cl2通入FeBr2的溶液中,反应后溶液中Fe2+的量减少,Br-的量不变,这个事实说明Fe2+和Br-的还原性强弱为____________。Fe2+>Br- 18.(12分)某无色透明溶液中可能大量存在Ag+、Ba2+、Cu2+、Fe3+、Na+中的几种离子,请填写下列空白:(1)不做任何实验就可以肯定原溶液中不存在的离子是_________ _____。(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量稀硝酸,沉淀不消失。说明原溶液中肯定有的离子是________,有关的离子方程式为_________________________。18Cu2+、 Fe3+ Ag+ Ag++Cl-===AgCl↓ 18(3)取(2)的滤液,加入过量的稀硫酸,出现白色沉淀,说明原溶液中肯定有________,有关的离子方程式为_________________________。(4)原溶液中可能大量存在的阴离子是______(填字母)。 Ba2+ B 19.(14分)亚硝酸钠(NaNO2)有毒,一次摄入量超过3 g可导致死亡。某些不法商贩用亚硝酸钠煮制肉类食品,因为亚硝酸钠能够提高水的沸点,加快煮制速度,且使肉色鲜亮,容易促进食欲。食用微量的亚硝酸钠不会立即有中毒症状显现,但其可以在人体内沉积,且容易转化为致癌的亚硝酸胺。(1)下列有关亚硝酸钠的说法,正确的是______(填字母)。A.亚硝酸钠既属于钠盐,也属于硝酸盐B.亚硝酸钠由钠、氮、氧三种元素组成C.亚硝酸钠属于氧化物D.亚硝酸钠中N元素只能得电子,不能失电子19B 19(2)在实验室中,亚硝酸钠也被用于处理过量的叠氮化钠,有关反应方程式如下:反应Ⅰ:NaNO2+H2SO4===HNO2+NaHSO4 反应Ⅱ:2NaN3+2HNO2===3N2↑+2NO↑+2NaOH ①上述两个反应中属于非氧化还原反应的是__________(填“反应Ⅰ”或“反应Ⅱ”)。②其中的氧化还原反应的氧化剂是__________(填化学式),该反应的氧化产物与还原产物的化学计量数之比为________。反应Ⅰ HNO2 3∶2 19(3)亚硝酸钠外观与食盐相似,均有咸味。某学校实验探究小组欲对亚硝酸钠与氯化钠进行鉴别,下面是他们的鉴别方法。将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再加淀粉。如果溶液显蓝色则可以证明该样品盐为亚硝酸钠,如果溶液无变化,则可以证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可以用下列化学方程式表示:2NaNO2+2X+2H2SO4===2NO↑+I2+K2SO4+Na2SO4+2H2O其中X是________(填化学式)。每生成1个NO分子,反应中转移电子的个数是_____。 KI 1 谢谢观看Thank you for watching
第一章综合评价时间:75分钟 满分:100分一、 单项选择题(本题共14小题,每小题3分,共42分)1.我们生活在千变万化的物质世界里。下列过程或变化中,没有发生氧化还原反应的是 ( )A.木炭燃烧 B.胶体发生丁达尔效应C.爆竹爆炸 D.电解水1B 2.下列对有关物质的分类不正确的是 ( )2D 3.下列单、双线桥的表示方法不正确的是 ( )3B 4A 55.下列说法不符合下图漫画情景的是 ( ) A.此反应不可能是复分解反应B.若金属1是锌,金属2可能是银C.还原性:金属1>金属2D.反应中,金属2可能发生的是氧化反应D 6B 7.下列离子方程式书写正确的是 ( )A.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2OC.铜和硝酸银溶液反应:Cu+Ag+===Cu2++AgD.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-=== Mg(OH)2↓7B 8.下图几种反应类型之间的集合关系正确的是 ( )8B 9.欲配制下列含有四种不同阴、阳离子的溶液,其中能配制成功的是 ( )9B 10.已知反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,据此判断,下列说法正确的是 ( )A.该反应的生成物都属于电解质B.该反应表明Cl2的氧化性比KClO3强C.HCl部分发生氧化反应D.每生成3个Cl2分子,KClO3在反应中得到6个 e-10C 11.离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是 ( )①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOHA.①③ B.①④⑤C.②④⑤ D.①⑤11C 12.为确定某溶液中的离子组成,进行如下实验:①取少量溶液加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色、无味气体;②向①溶液中再滴加BaCl2溶液,产生白色沉淀;③取②上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验现象,下列推断正确的是 ( )12C 13.甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含离子如下表所示: 下列说法正确的是 ( )A.甲可能是NaOH B.甲可能是Na2SO4C.甲、乙、丙两两混合都会有白色沉淀生成D.可用酚酞鉴别三种溶液13C A.Na2CO3+2HCl===2NaCl+CO2 ↑+H2OB.K2CO3+2HNO3===2KNO3+CO2↑+H2OC.K2CO3+H2SO4===K2SO4+CO2 ↑+H2O D.CaCO3+2HCl===CaCl2+CO2 ↑+H2O14D 二、 非选择题(本题共5小题,共58分)15.(10分)无机化合物可根据其组成和性质进行分类。 (1)上图所示的物质分类方法名称是______________。15树状分类法 15(2)以Na、K、H、O、C、S、N中任意两种或三种元素组成合适的物质,分别填在下表中。 H2SO4(或HNO3) NaOH(或KOH) Na2SO4(或K2CO3或Na2SO3或NaNO3) 15(3)写出⑦转化为⑤的化学方程式:___________________________________。(4)写出实验室由⑩制备O2的化学方程式:______________________。(5)实验室制备⑦常用__________和____________________反应,检验该气体的方法是______________________________________________ ____________。2NaOH+CO2===Na2CO3+H2O 稀盐酸 大理石(或石灰石) 将气体通入澄清石灰水中,若变浑浊,即可证明该气体是CO2 16.(10分)氧化镁在医药、建筑等行业应用广泛。热解还原硫酸镁制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:16(1)“酸溶”时,MgCO3溶解的离子方程式为___________________ ______________________。MgCO3+2H+=== Mg2++H2O+CO2↑ 16(2)“氧化”反应的离子方程式如下,请用单线桥标出该反应中电子转移的方向和数目:2Fe2++2H++H2O2===2Fe3++2H2O【答案】16(3)加入氨水“调pH≈4”的目的是使Fe3+沉淀、Mg2+不沉淀,反应的离子方程式为_______________________________________。(4)“过滤Ⅱ”所得的滤液经“操作X”可得到MgSO4·7H2O,操作X为______________________、过滤、洗涤。蒸发浓缩、冷却结晶 1∶2 17既作氧化剂,又作还原剂 作氧化剂 作还原剂 既不作氧化剂,也不作还原剂 17(2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O。该反应中被氧化的物质是________,用单线桥在下面的化学方程式上标出电子转移的方向和数目:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O【答案】H2O2 17(3)将少量Cl2通入FeBr2的溶液中,反应后溶液中Fe2+的量减少,Br-的量不变,这个事实说明Fe2+和Br-的还原性强弱为____________。Fe2+>Br- 18.(12分)某无色透明溶液中可能大量存在Ag+、Ba2+、Cu2+、Fe3+、Na+中的几种离子,请填写下列空白:(1)不做任何实验就可以肯定原溶液中不存在的离子是_________ _____。(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量稀硝酸,沉淀不消失。说明原溶液中肯定有的离子是________,有关的离子方程式为_________________________。18Cu2+、 Fe3+ Ag+ Ag++Cl-===AgCl↓ 18(3)取(2)的滤液,加入过量的稀硫酸,出现白色沉淀,说明原溶液中肯定有________,有关的离子方程式为_________________________。(4)原溶液中可能大量存在的阴离子是______(填字母)。 Ba2+ B 19.(14分)亚硝酸钠(NaNO2)有毒,一次摄入量超过3 g可导致死亡。某些不法商贩用亚硝酸钠煮制肉类食品,因为亚硝酸钠能够提高水的沸点,加快煮制速度,且使肉色鲜亮,容易促进食欲。食用微量的亚硝酸钠不会立即有中毒症状显现,但其可以在人体内沉积,且容易转化为致癌的亚硝酸胺。(1)下列有关亚硝酸钠的说法,正确的是______(填字母)。A.亚硝酸钠既属于钠盐,也属于硝酸盐B.亚硝酸钠由钠、氮、氧三种元素组成C.亚硝酸钠属于氧化物D.亚硝酸钠中N元素只能得电子,不能失电子19B 19(2)在实验室中,亚硝酸钠也被用于处理过量的叠氮化钠,有关反应方程式如下:反应Ⅰ:NaNO2+H2SO4===HNO2+NaHSO4 反应Ⅱ:2NaN3+2HNO2===3N2↑+2NO↑+2NaOH ①上述两个反应中属于非氧化还原反应的是__________(填“反应Ⅰ”或“反应Ⅱ”)。②其中的氧化还原反应的氧化剂是__________(填化学式),该反应的氧化产物与还原产物的化学计量数之比为________。反应Ⅰ HNO2 3∶2 19(3)亚硝酸钠外观与食盐相似,均有咸味。某学校实验探究小组欲对亚硝酸钠与氯化钠进行鉴别,下面是他们的鉴别方法。将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再加淀粉。如果溶液显蓝色则可以证明该样品盐为亚硝酸钠,如果溶液无变化,则可以证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可以用下列化学方程式表示:2NaNO2+2X+2H2SO4===2NO↑+I2+K2SO4+Na2SO4+2H2O其中X是________(填化学式)。每生成1个NO分子,反应中转移电子的个数是_____。 KI 1 谢谢观看Thank you for watching
相关资料
更多









